英国における多施設共同臨床試験[PANORAMIC試験](海外データ)
英国における多施設共同臨床試験[PANORAMIC試験](海外データ)1)
1)Butler CC et al. Lancet. 2023; 401(10373): 281-293.
https://creativecommons.org/licenses/by/4.0/
著者にはMSD社より助成金等を受領する者が含まれる
試験概要

COVID-19:新型コロナウイルス感染症、SARS-CoV-2:重症急性呼吸器症候群関連コロナウイルス2
患者背景
50歳から64歳で臨床的な脆弱性やリスクを有さない患者が約20%含まれました。
ワクチン接種済み患者は99%を占めました。
年齢区分及び患者状態(NHS優先順位), n(%)
ワクチン接種回数, n(%)
主な併存疾患,n(%)
有効性
1)無作為化後28日以内のすべての原因による入院及び/又は死亡※:主要評価項目
※ 待機的手術など事前に計画した入院を除く
無作為化後28日以内の入院及び/又は死亡はラゲブリオ®+通常治療群で1%(105/12,529例)、通常治療群で1%(98/12,525例)であり、優越性は認められませんでした[オッズ比1.06(95% BCI:0.81, 1.41)]。

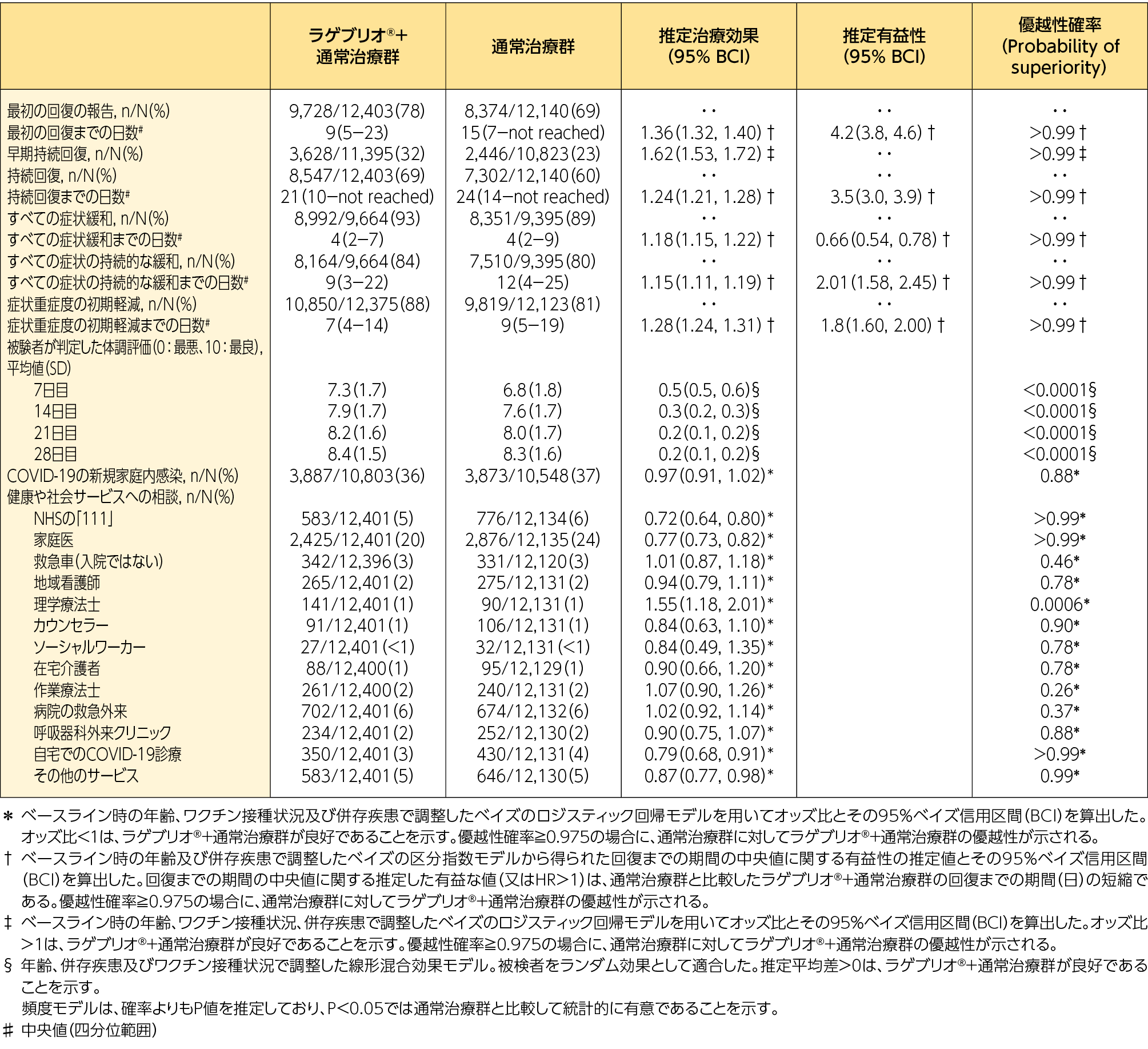
2)最初の回復までの日数*:副次評価項目
*被験者がCOVID-19からの完全な回復を最初に報告した日までの日数
無作為化後最初の回復までの日数(中央値)はラゲブリオ®+通常治療群で9日、通常治療群で15日であり、有益性は4.2日と推定されました。
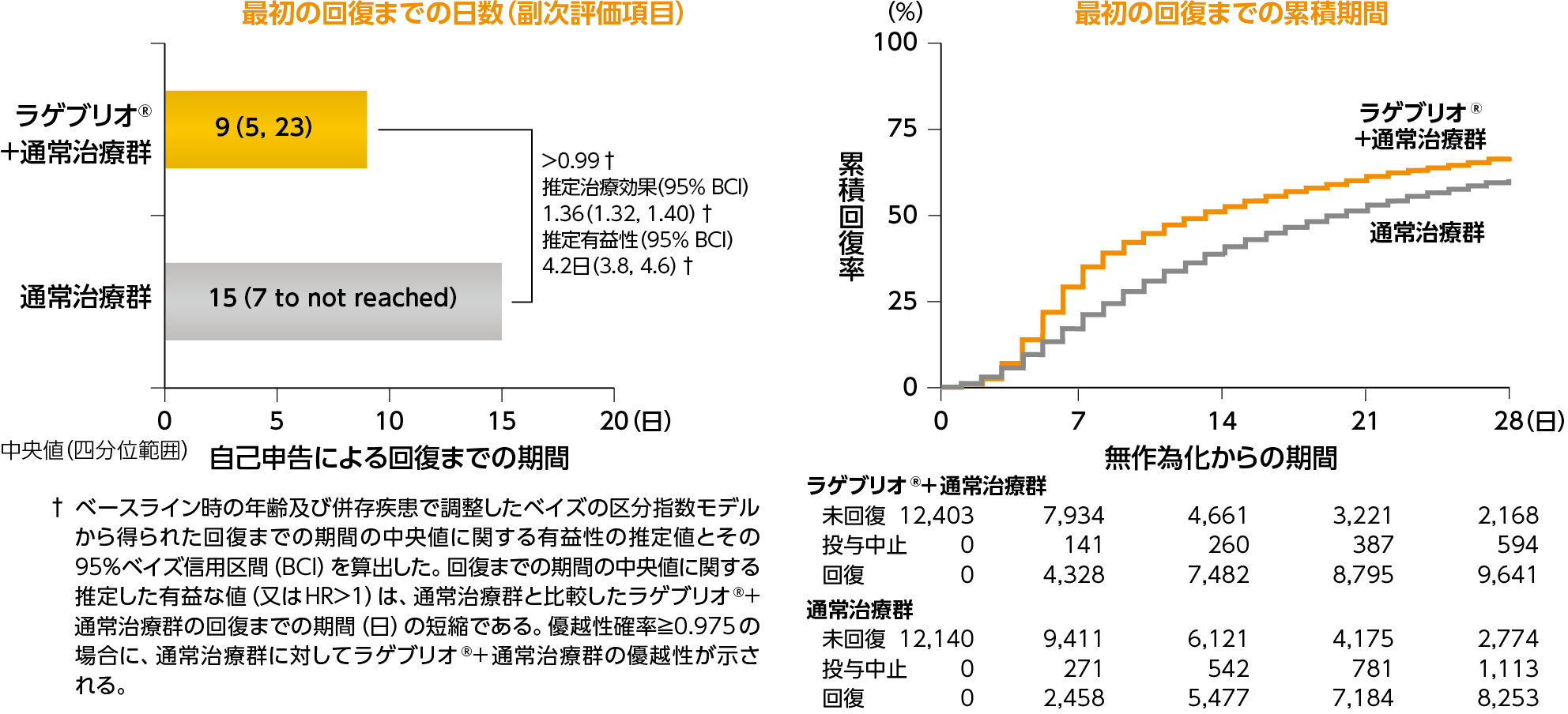
3)最初の回復までの日数*の群間差:副次評価項目のサブグループ解析
*被験者がCOVID-19からの完全な回復を最初に報告した日までの日数
無作為化後最初の回復までの日数は、リスクカテゴリー、併存疾患、年齢など、いずれのサブグループにおいても、全体集団と同様の傾向がみられました。
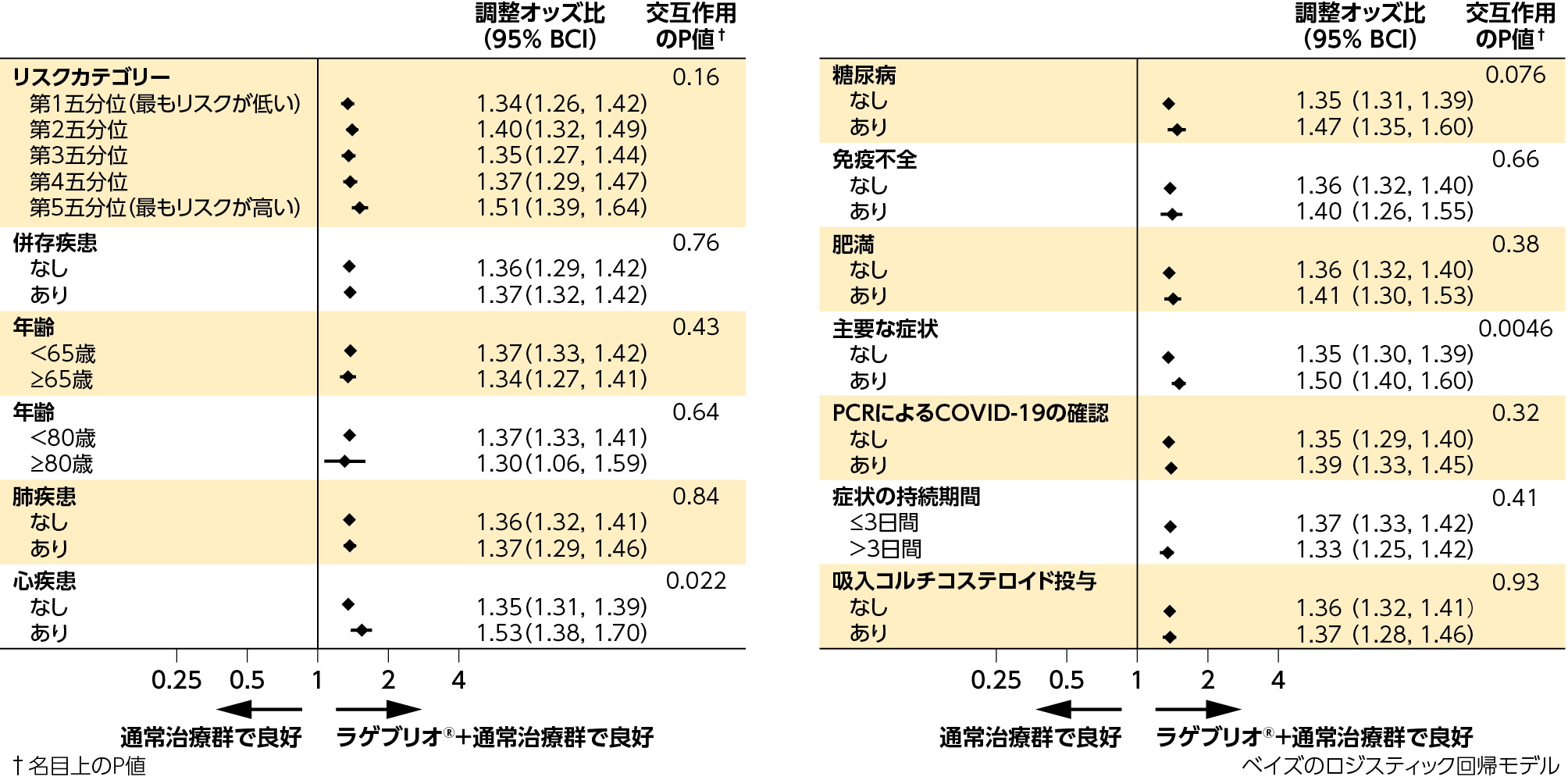
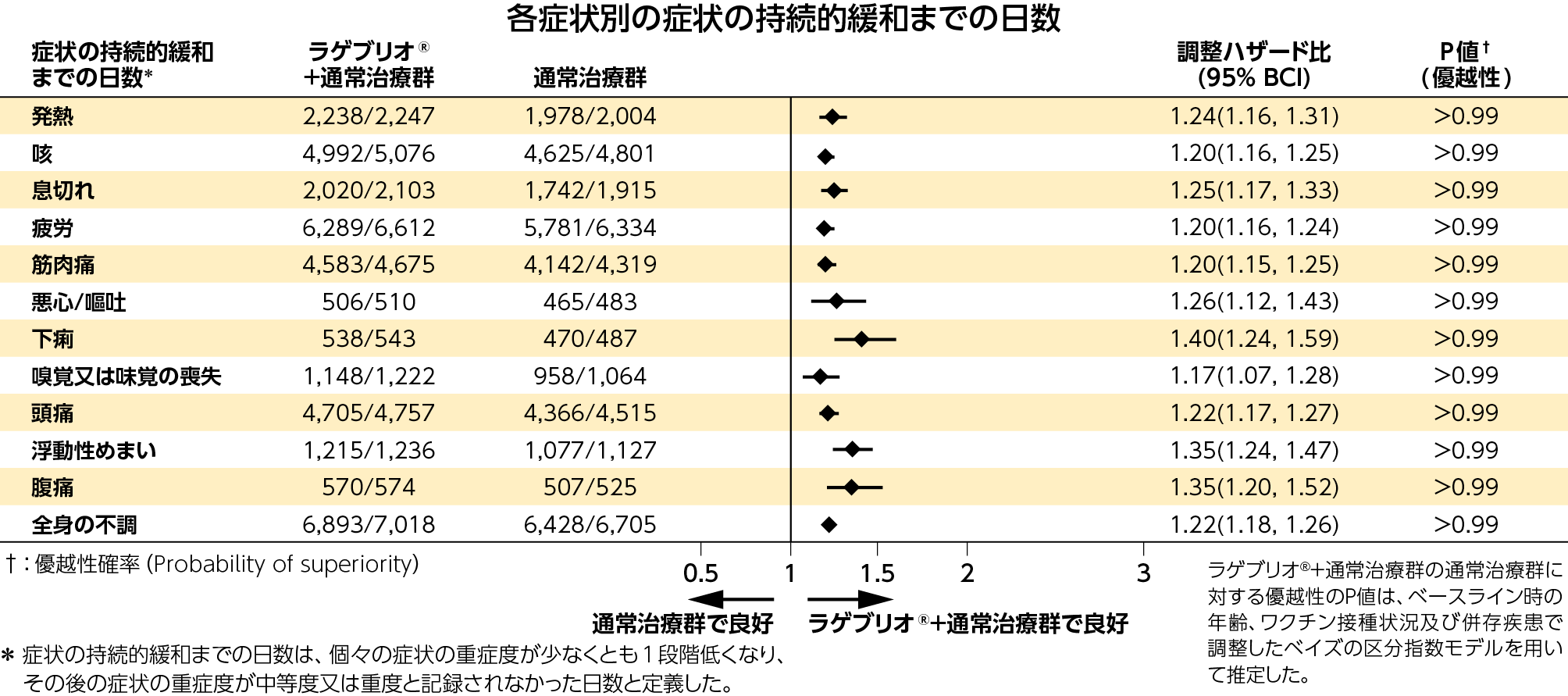
4)各症状別の症状緩和までの日数、症状の持続的緩和までの日数、症状重症度の初期軽減までの日数:副次評価項目
症状緩和までの日数、症状の持続的緩和までの日数、症状重症度の初期軽減までの日数のいずれにおいても、ラゲブリオ®+通常治療群と通常治療群との間に差が認められました。

5)ウイルス学的サブ試験
7日目のSARS-CoV-2ウイルス量が検出下限未満であった割合はラゲブリオ®+通常治療群で通常治療群よりも有意に高いことが示されました(P=0.039:Firthロジスティック回帰)。
【主要評価項目】7日目のSARS-CoV-2ウイルス量が検出不能であった被験者の割合
【副次評価項目】0~7日目まで、及び14日目のSARS-CoV-2ウイルス量が検出不能であった被験者の割合

安全性
- 重篤な有害事象は、ラゲブリオ®+通常治療群で50例(0.4%)、通常治療群で45例(0.3%)に認められました。
- 主な重篤な有害事象は、ラゲブリオ®+通常治療群で胃腸障害16例、一般・全身障害及び投与部位の状態10例、心臓障害9例、感染症及び寄生虫症9例、呼吸器、胸郭及び縦隔障害6例、傷害、中毒及び処置合併症5例、その他*22例、通常治療群で感染症及び寄生虫症15例、胃腸障害11例、傷害、中毒及び処置合併症5例、腎及び尿路障害4例、呼吸器、胸郭及び縦隔障害4例、心臓障害3例、一般・全身障害及び投与部位の状態3例、その他*18例に認められました。
- 治験薬に関連する重篤な有害事象は認められませんでした。
- ラゲブリオ®に起因する投与中止に至った副作用は、ラゲブリオ®+通常治療群で145例(1.1%)に認められました。
* 耳及び迷路障害、眼障害、肝胆道系障害、免疫系障害、代謝及び栄養障害、筋骨格系及び結合組織障害、良性・悪性・詳細不明の腫瘍(嚢胞及びポリープを含む)、神経系障害、妊娠、産褥と周産期の状態、精神障害、生殖系及び乳房障害、皮膚及び皮下組織障害、外科及び医療処置、血管障害を含む。