KEYNOTE-204試験(全体集団)
古典的ホジキンリンパ腫:国際共同臨床試験成績:国際共同第Ⅲ相試験<KEYNOTE-204試験>(全体集団)
電子添文改訂時評価資料:国際共同第Ⅲ相試験(KEYNOTE-204試験)
Kuruvilla J et al. Lancet Oncol 2021; 22: 512–524
本試験はMSD社の資金提供により行われた。John KuruvillaはMSD社から謝礼などを受領している。また、著者のうち、Ying Zhu、Akash Nahar、Patricia MarinelloはMSD社の社員である。その他の著者にMSD社より顧問料などを受領している者が含まれる。
試験概要
【目的】
再発又は難治性の古典的ホジキンリンパ腫患者におけるキイトルーダ®とブレンツキシマブ ベドチン(BV)の有効性及び安全性を比較検討する。
【デザイン】
国際共同非盲検無作為化第Ⅲ相試験[優越性試験][第2回中間解析結果(データカットオフ日:2020年1月16日)]
【対象】
1レジメン以上の化学療法歴を有する再発又は難治性の古典的ホジキンリンパ腫患者304例(日本人患者16例を含む)
【方法】
キイトルーダ®群[キイトルーダ®200mgを3週間間隔(Q3W)で点滴静注]又はBV群[BV 1.8mg/kgをQ3Wで点滴静注]に1:1の割合で無作為に割り付けた。疾患進行(PD)、許容できない有害事象の発現等による投与中止又は投与完了まで継続した(最大35サイクル)。
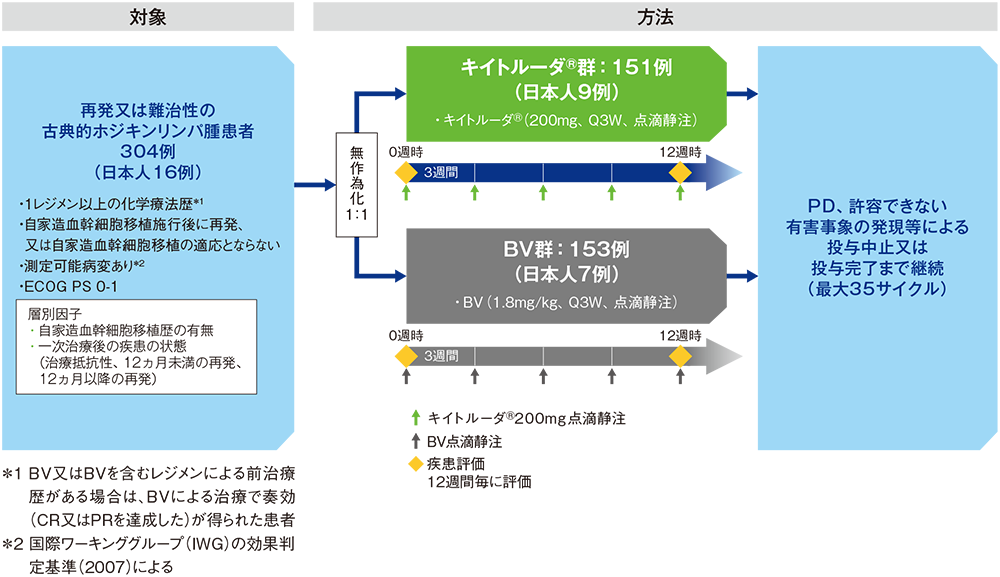
【評価項目】
主要評価項目:無増悪生存期間(progression free survival: PFS)[自家造血幹細胞移植又は同種造血幹細胞移植後の臨床データ及び画像データを含む]*3 ※、全生存期間(overall survival: OS)※
副次評価項目:PFS(自家造血幹細胞移植又は同種造血幹細胞移植後の臨床データ及び画像データは含めない)*3,4 、奏効率(objective response rate: ORR)*3,4 ※ 、完全奏効率(complete remission rate: CRR)*3,4 、安全性など
探索的評価項目:奏効期間(duration of response: DOR)*3,4など
※検証的解析項目
【判定基準】
PFS、ORR、CRRは、盲検下独立中央判定などによりIWG効果判定基準(2007)に基づき評価した。
【解析計画】
解析対象集団:有効性はITT集団*5、安全性はASaT集団*6を解析対象とした。
有効性評価の統計手法:OS及びPFSはKaplan-Meier法を用いて生存曲線を推定し、層別ログランク検定を用いて群間を比較した。ハザード比と95%信頼区間(CI)は、投与群を共変量とした層別Cox比例ハザードモデルにより算出した。ORRはClopper-Pearson法を用いて、正確な95%CIを算出し、層の症例数に基づき重み付けした層別Miettinen and Nurminen法を用いて群間を比較した。層別ログランク検定、層別Cox比例ハザードモデル及び層別Miettinen and Nurminen法の層別因子には、無作為化に用いた層別因子[自家造血幹細胞移植歴の有無、一次治療後の疾患の状態(治療抵抗性、12ヵ月未満の再発、12ヵ月以降の再発)]を用いた。また、層別Cox比例ハザードモデルを用いて、層別因子(自家造血幹細胞移植歴の有無、一次治療後の疾患の状態)、性別(女性、男性)、年齢(65歳未満、65歳以上)、年齢(65歳未満、65歳以上75歳未満、75歳以上85歳未満、85歳以上)、ECOG PS(0、1)、PD-L1発現状況(陽性、陰性)、地域(米国、米国以外)、地域(ヨーロッパ、ヨーロッパ以外)、BV治療歴(あり、なし)について、主要評価項目(PFS及びOS)のサブグループ解析を計画した。治験実施計画書に記載されていないが、Cox比例ハザードモデルを用いた前治療数別(造血幹細胞移植を除く)、自家造血幹細胞移植歴別、BV治療歴別のPFS及び日本人集団について、評価資料として電子添文改訂時に評価された。そのほか、治験薬投与後に同種造血幹細胞移植を受けた患者については、同種造血幹細胞移植に関連する合併症を収集することが規定されていた。
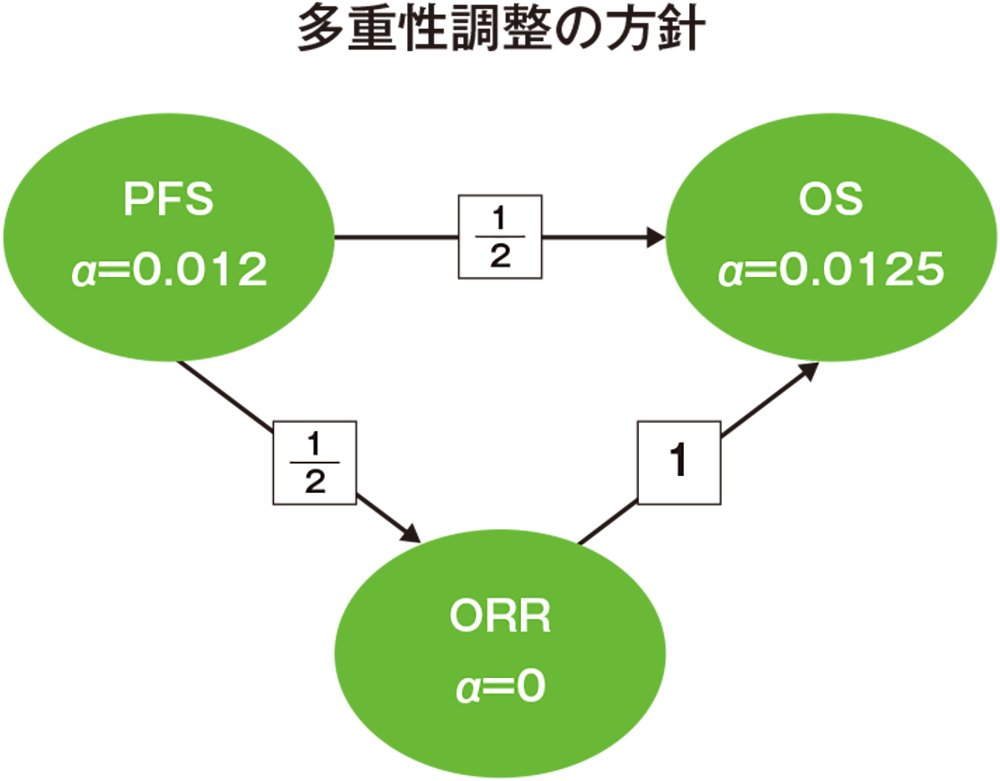
多重性の調整:本試験では4回の中間解析を事前に計画し、PFSは2回の中間解析及び最終解析、OSは2回の中間解析及び最終解析、ORRは1回の最終解析を実施することとした。Maurer and Bretzのgraphical approachに基づいてOS、PFS(主要)及びORRの仮説間で試験全体の有意水準を片側2.45%に厳密に制御するとともに、α消費関数を用いて中間解析と最終解析で用いる有意水準を設定した。PFS(副次)の仮説にはα=0.05%(片側)を配分し、この評価項目については1回目の中間解析以降の解析は実施しないこととした。
*3 盲検下独立中央判定による評価
*4 治験担当医師判定による評価
*5 ITT(intention-to-treat)集団:無作為化されたすべての患者
*6 ASaT(all subjects as treated)集団:治験薬を1回以上投与されたすべての患者
(補足)主要評価項目と副次評価項目のPFSの違い
治験薬投与中にPDが認められず造血幹細胞移植を受けた場合、主要評価項目のPFSでは造血幹細胞移植の実施を打ち切りとせず、治験薬投与中止の有無にかかわらない患者の真のPDを評価したが、副次評価項目のPFSでは造血幹細胞移植の実施を打ち切りとした
4. 効能又は効果(抜粋)
〇再発又は難治性の古典的ホジキンリンパ腫
5. 効能又は効果に関連する注意(抜粋)
〈再発又は難治性の古典的ホジキンリンパ腫〉
5.5 臨床試験に組み入れられた患者の前治療歴等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.12、17.1.13参照]
9. 特定の背景を有する患者に関する注意(抜粋)
9.1 合併症・既往歴等のある患者
9.1.3 臓器移植歴(造血幹細胞移植歴を含む)のある患者
本剤の投与により移植臓器に対する拒絶反応又は移植片対宿主病が発現するおそれがある。
15. その他の注意(抜粋)
15.1 臨床使用に基づく情報
15.1.2 臨床試験において、本剤による治療後に同種造血幹細胞移植が実施された症例で、重篤な移植片対宿主病等の移植関連合併症が認められた。
患者背景
患者背景(ITT集団)
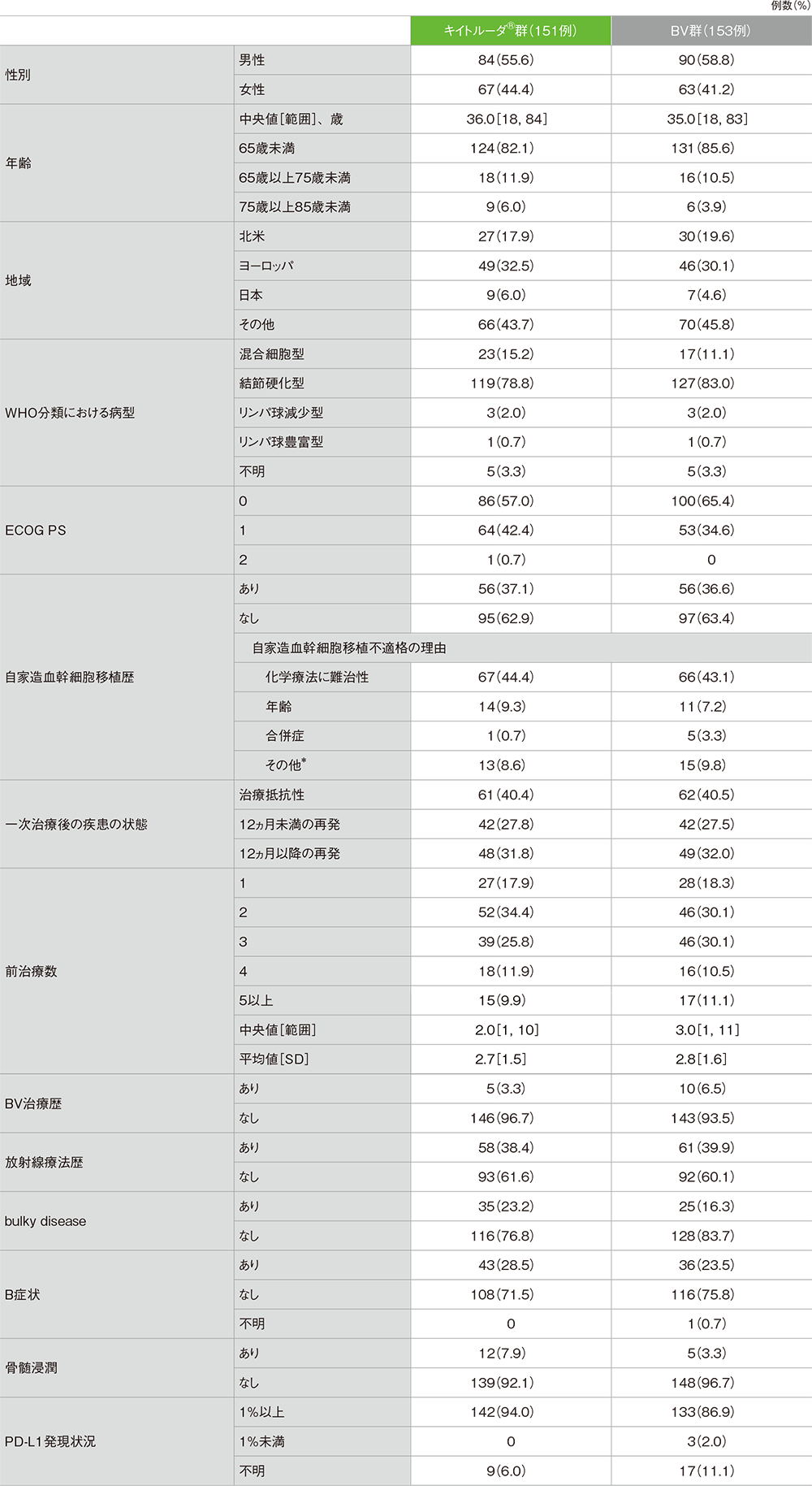
*医師の判断、患者の意思、社会的理由が含まれる。
治験薬投与状況(ASaT集団)
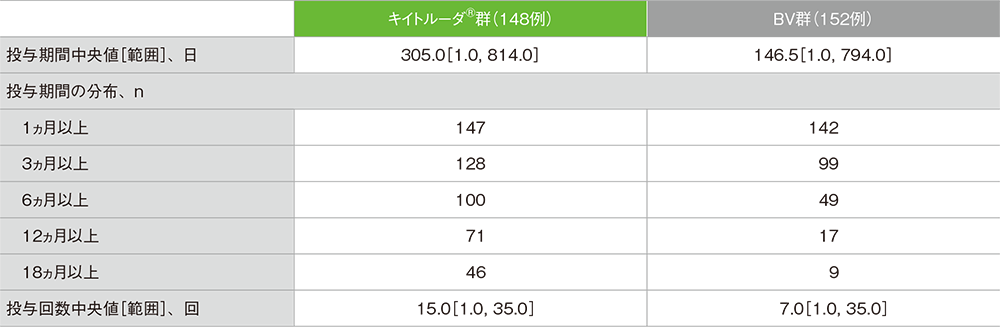
主要評価項目
無増悪生存期間(PFS)(自家造血幹細胞移植又は同種造血幹細胞移植後の臨床データ及び画像データを含む)(検証的解析結果)
- BV群に対するキイトルーダ®群のハザード比は0.65(95%CI:0.48, 0.88)であり、PFSを有意に延長しました(p=0.00271、層別ログランク検定[片側]、有意水準α=0.0043、検証的解析結果)。
- PFS中央値はキイトルーダ®群で13.2ヵ月(95%CI:10.9, 19.4)、BV群で8.3ヵ月(95%CI:5.7, 8.8)でした。
無増悪生存期間(PFS)(主要評価項目)のKaplan-Meier曲線(ITT集団)
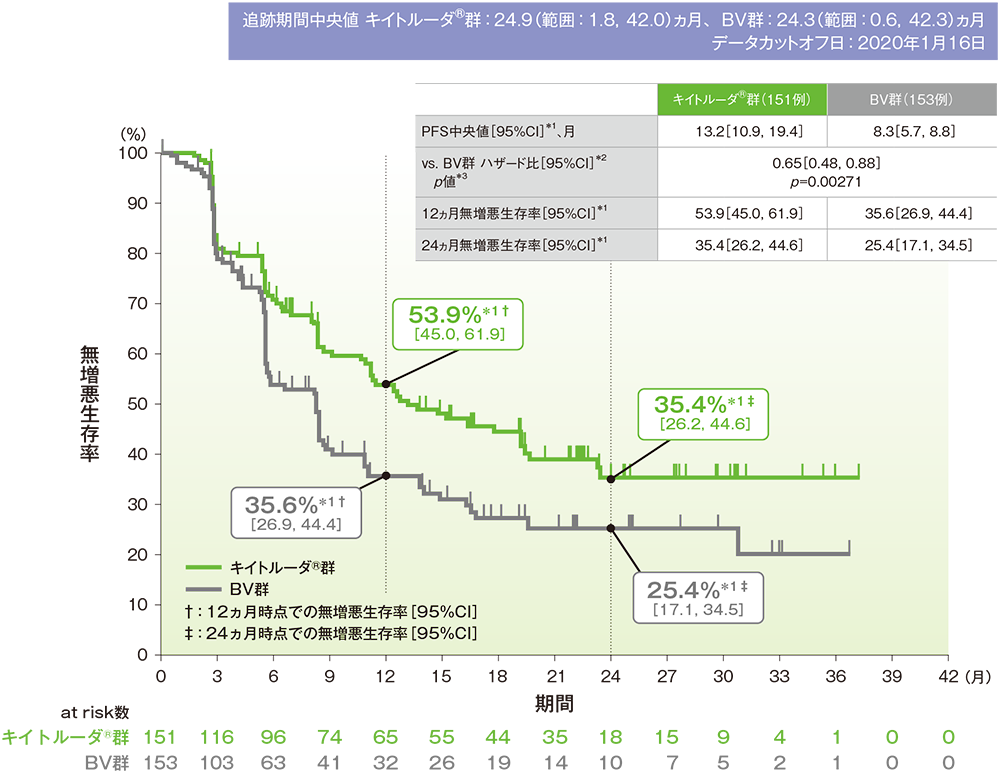
IWGの効果判定基準に基づく盲検下独立中央判定
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[自家造血幹細胞移植歴(あり、なし)、一次治療後の疾患の状態(治療抵抗性、12ヵ月未満の再発、12ヵ月以降の再発)]を考慮した層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子を考慮した層別ログランク検定[片側]、有意水準α=0.0043(検証的解析結果)
副次評価項目
無増悪生存期間(PFS)(自家造血幹細胞移植又は同種造血幹細胞移植後の臨床データ及び画像データは含めない)
- PFS中央値*1はキイトルーダ®群で12.6ヵ月(95%CI:8.7, 19.2)、BV群で8.2ヵ月(95%CI:5.6, 8.6)でした(ハザード比*2:0.62)。
IWGの効果判定基準に基づく盲検下独立中央判定
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[自家造血幹細胞移植歴(あり、なし)、一次治療後の疾患の状態(治療抵抗性、12ヵ月未満の再発、12ヵ月以降の再発)]を考慮した層別Cox比例ハザードモデルに基づく
サブグループ解析
前治療数別の無増悪生存期間(PFS)
前治療数別(造血幹細胞移植を除く)の無増悪生存期間(PFS)の要約(ITT集団)
※本解析は事前規定されていないが、評価資料として電子添文改訂時に評価されたため記載した
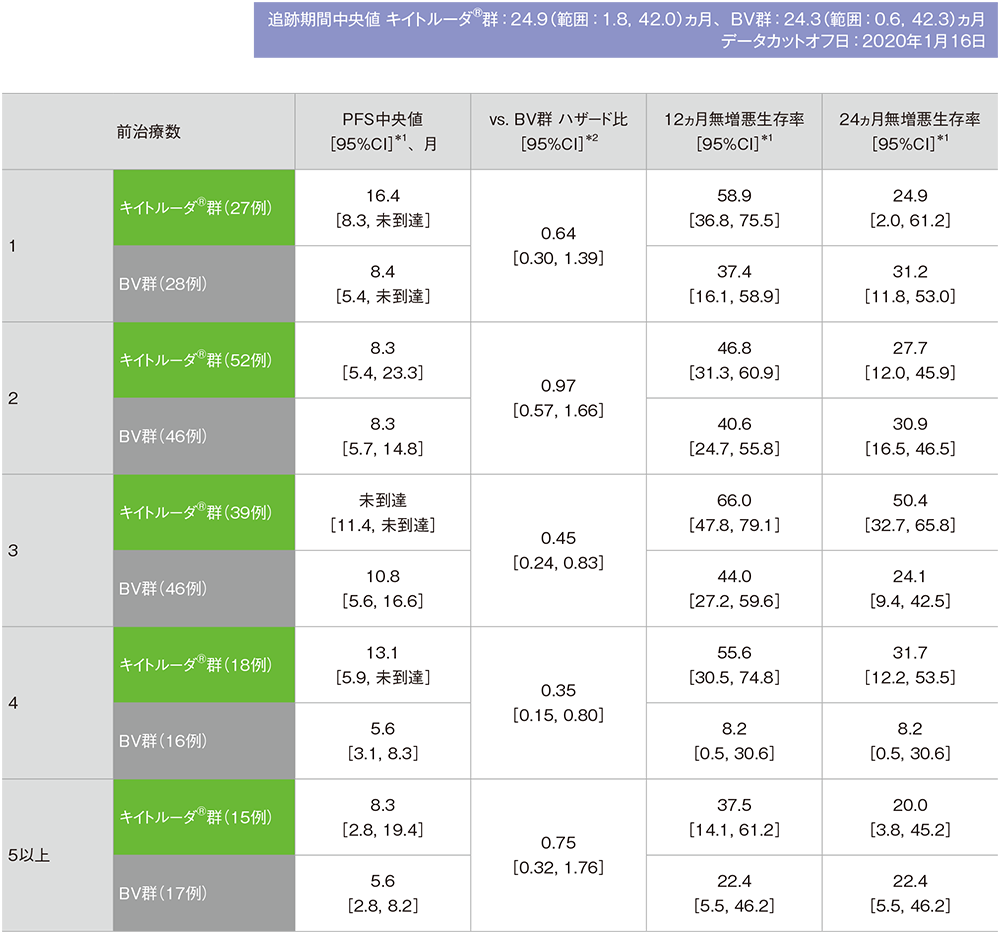
IWGの効果判定基準に基づく盲検下独立中央判定
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づく
サブグループ解析
自家造血幹細胞移植歴別の無増悪生存期間(PFS)
自家造血幹細胞移植歴別の無増悪生存期間(PFS)の要約(ITT集団)
※本解析は事前規定されていないが、評価資料として電子添文改訂時に評価されたため記載した
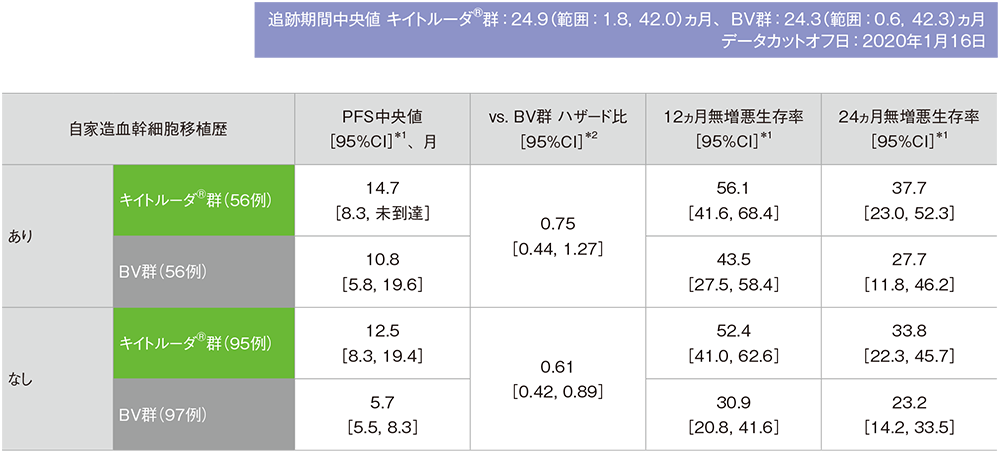
IWGの効果判定基準に基づく盲検下独立中央判定
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づく
サブグループ解析
BV治療歴別の無増悪生存期間(PFS)
BV治療歴別の無増悪生存期間(PFS)の要約(ITT集団)
※本解析は事前規定されていないが、評価資料として電子添文改訂時に評価されたため記載した
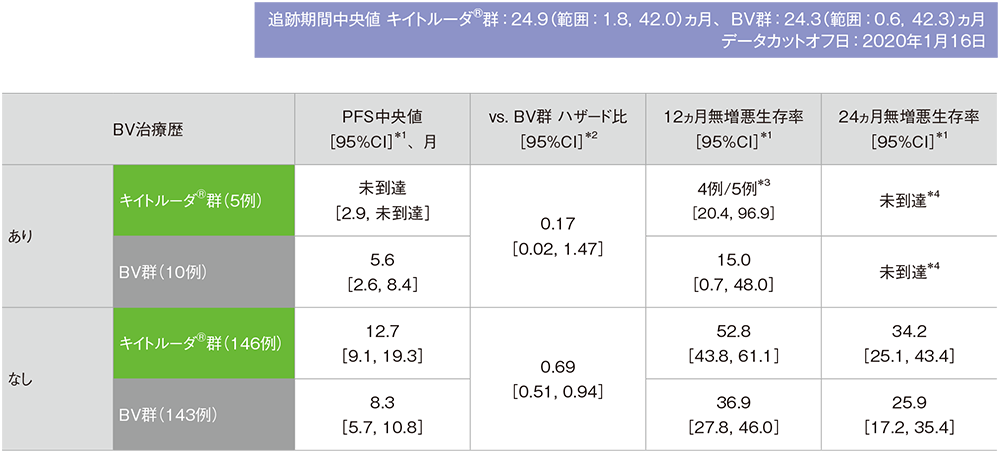
IWGの効果判定基準に基づく盲検下独立中央判定
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づく
*3 無増悪生存数/評価例数
*4 24ヵ月時点のリスク人数は0であった
サブグループ解析
無増悪生存期間(PFS)のハザード比のフォレストプロット
無増悪生存期間(PFS)のフォレストプロット(ITT集団)
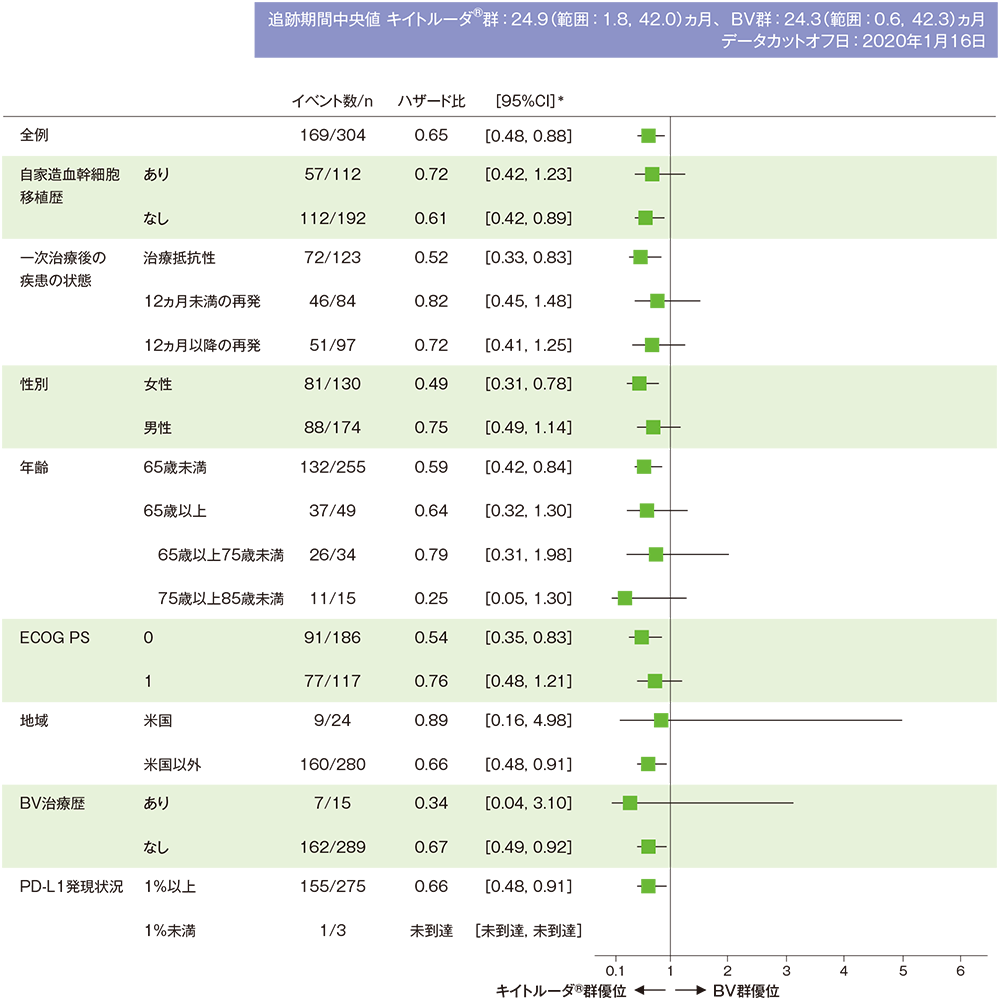
* 投与群を共変量とし、自家造血幹細胞移植歴(あり、なし)、一次治療後の疾患の状態(治療抵抗性、12ヵ月未満の再発、12ヵ月以降の再発)を層別因子とした層別Cox比例ハザードモデルに基づく
副次評価項目
奏効率(ORR)、完全奏効率(CRR)
- ORRはキイトルーダ®群で65.6%(95%CI:57.4, 73.1)、BV群で54.2%(95%CI:46.0, 62.3)であり、BV群に対するキイトルーダ®群の優越性は検証されませんでした(p=0.022534、層別Miettinen and Nurminen法[片側]、有意水準α=0.0060、検証的解析結果)。
- CRRはキイトルーダ®群で24.5%(95%CI:17.9, 32.2)、BV群で24.2%(95%CI:17.6, 31.8)でした。
奏効率(ORR)(ITT集団)(検証的解析結果)
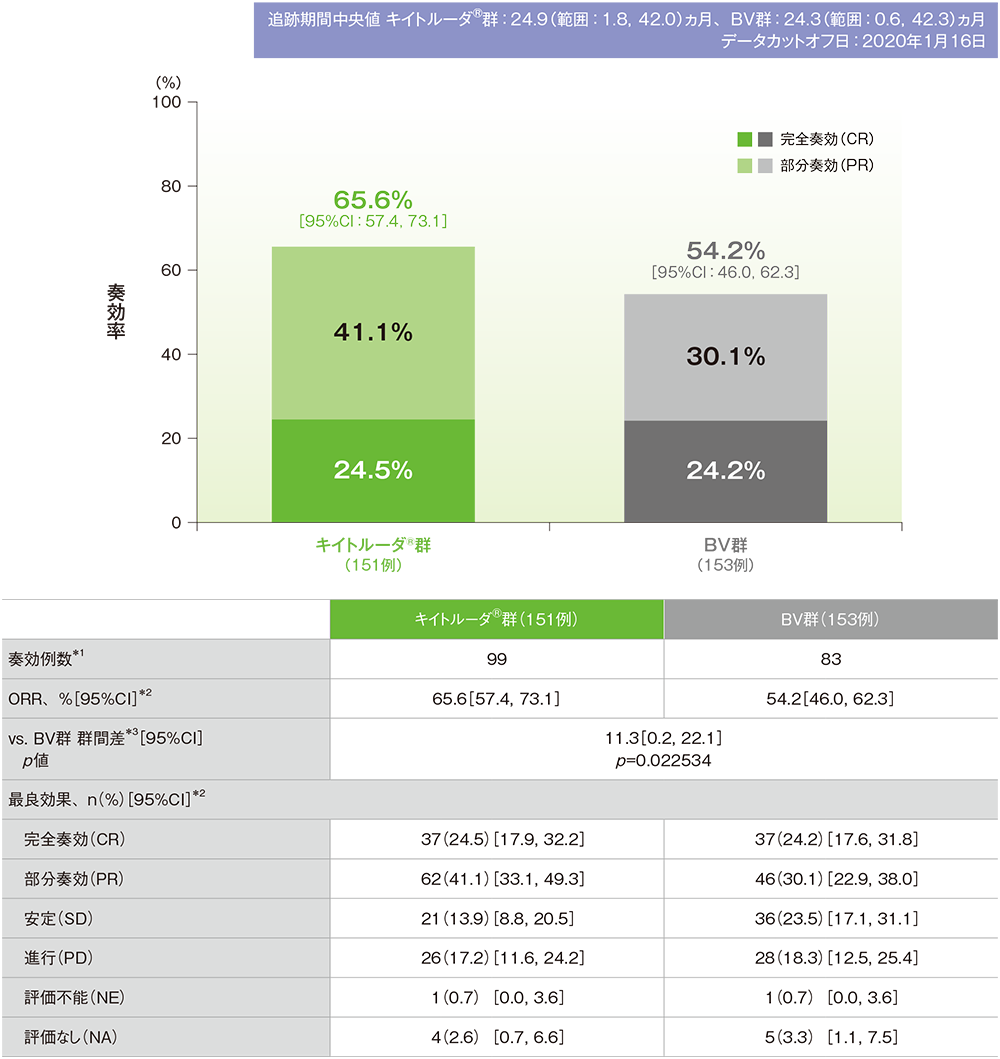
IWGの効果判定基準に基づく盲検下独立中央判定
*1 自家造血幹細胞移植又は同種造血幹細胞移植後のデータは含めない
*2 二項分布の確率計算による正確法
*3 造血幹細胞移植歴(あり、なし)、一次治療後の疾患の状態(治療抵抗性、12ヵ月未満の再発、12ヵ月以降の再発)を層別因子とした層別Miettinen and Nurminen法[片側]、有意水準α=0.0060(検証的解析結果)
探索的評価項目
奏効期間(DOR)
- 奏効までの期間中央値はキイトルーダ®群で2.8ヵ月(範囲:1.0, 31.2)、BV群で2.8ヵ月(範囲:1.3,7.3)でした。
- DOR中央値はキイトルーダ®群で20.7ヵ月(範囲:0.0+, 33.2+)、BV群で13.8ヵ月(範囲:0.0+,33.9+)でした。
奏効期間(DOR)のKaplan-Meier曲線(ITT集団)
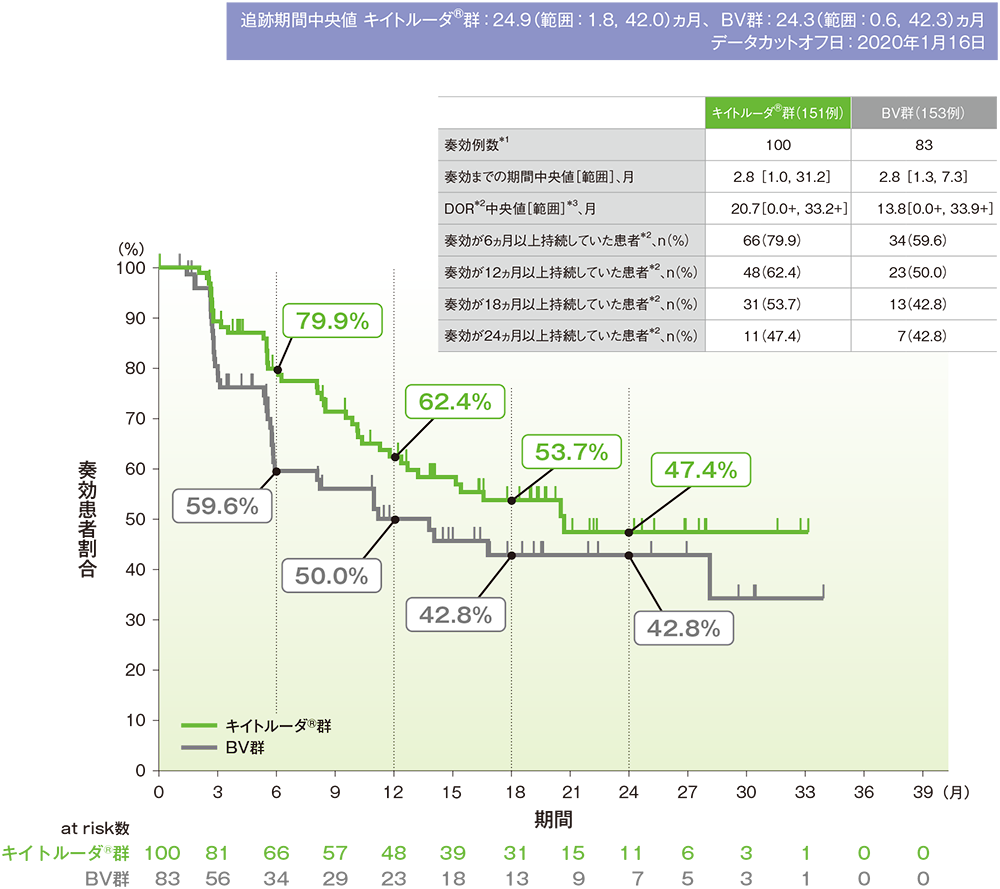
IWGの効果判定基準に基づく盲検下独立中央判定
*1 CR又はPRが認められた患者数。自家造血幹細胞移植又は同種造血幹細胞移植後のデータを含む
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3「+」は最後の疾患評価までPDがみられなかったことを示す
安全性
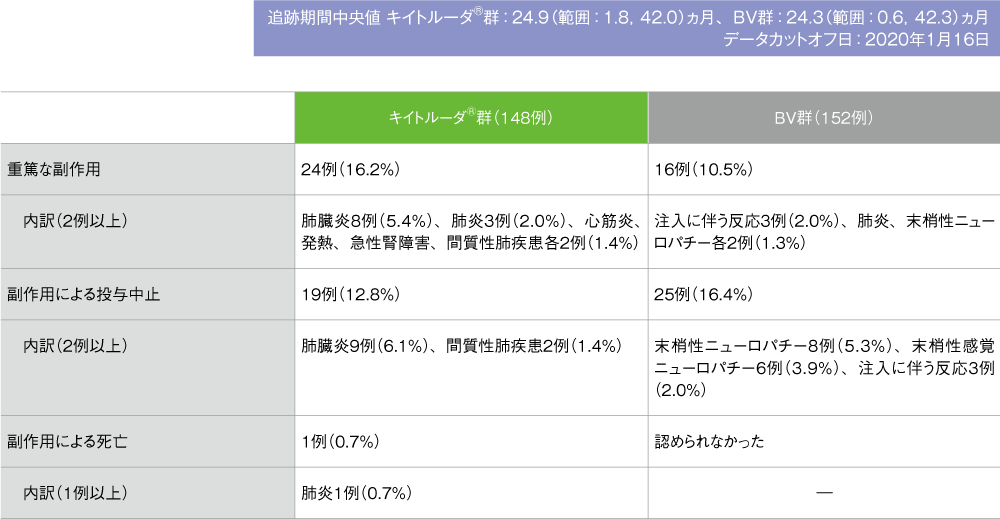
副作用(ASaT集団)
- 副作用はキイトルーダ®群で148例中110例(74.3%)、BV群で152例中117例(77.0%)に認められました。主な副作用(発現率10%以上)はキイトルーダ®群で甲状腺機能低下症23例(15.5%)、発熱19例(12.8%)、そう痒症16例(10.8%)、BV群で末梢性ニューロパチー28例(18.4%)、悪心及び末梢性感覚ニューロパチー各20例(13.2%)、疲労16例(10.5%)でした。
- 重篤な副作用はキイトルーダ®群で148例中24例(16.2%)、BV群で152例中16例(10.5%)に認められました。2例以上に認められた重篤な副作用はキイトルーダ®群で肺臓炎8例(5.4%)、肺炎3例(2.0%)、心筋炎、発熱、急性腎障害及び間質性肺疾患各2例(1.4%)、BV群では注入に伴う反応3例(2.0%)、肺炎及び末梢性ニューロパチー各2例(1.3%)でした。
- 副作用による投与中止はキイトルーダ®群で148例中19例(12.8%)、BV群で152例中25例(16.4%)に認められました。2例以上に認められた投与中止に至った副作用はキイトルーダ®群で肺臓炎9例(6.1%)、間質性肺疾患2例(1.4%)、BV群で末梢性ニューロパチー8例(5.3%)、末梢性感覚ニューロパチー6例(3.9%)、注入に伴う反応3例(2.0%)でした。
- 副作用による死亡はキイトルーダ®群で148例中1例(0.7%)に認められ、内訳は、キイトルーダ®群で肺炎1例(0.7%)でした。本試験において、BV群では副作用による死亡は認められませんでした。
主な副作用(いずれかの投与群で発現率5%以上)(ASaT集団)
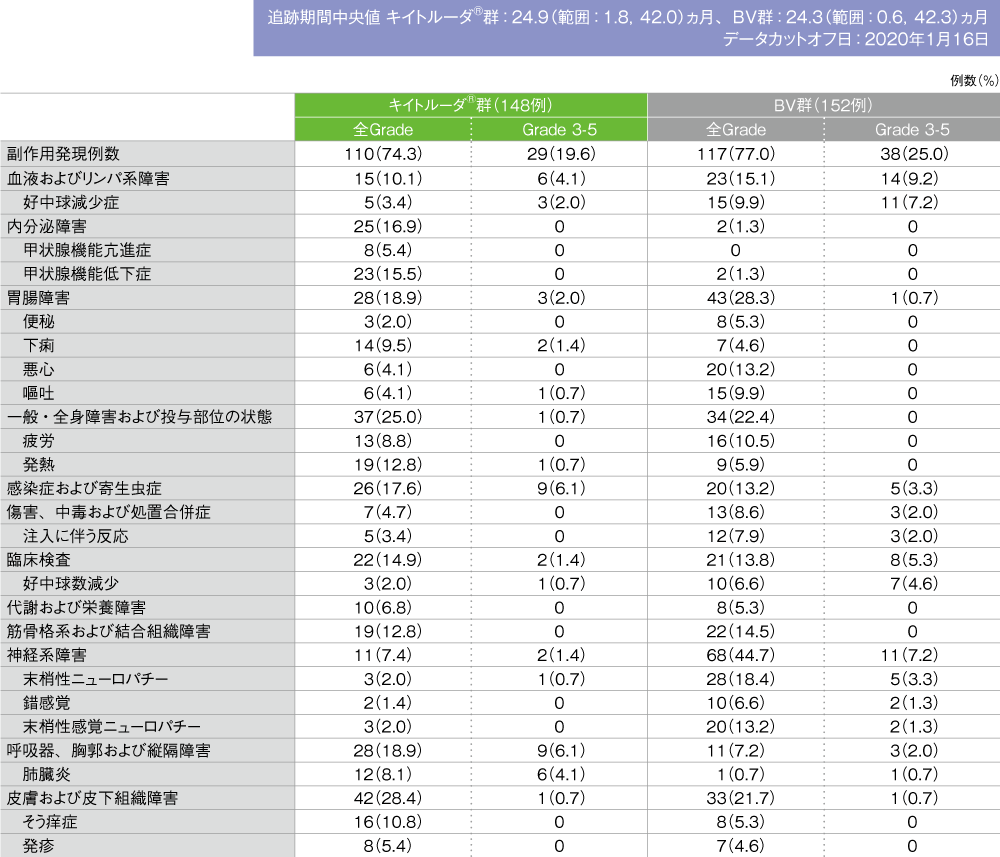
MedDRA/J version 22.1、GradeはCTCAE version 4.0
重篤な副作用、副作用による投与中止、副作用による死亡(ASaT集団)
MedDRA/J version 22.1
安全性
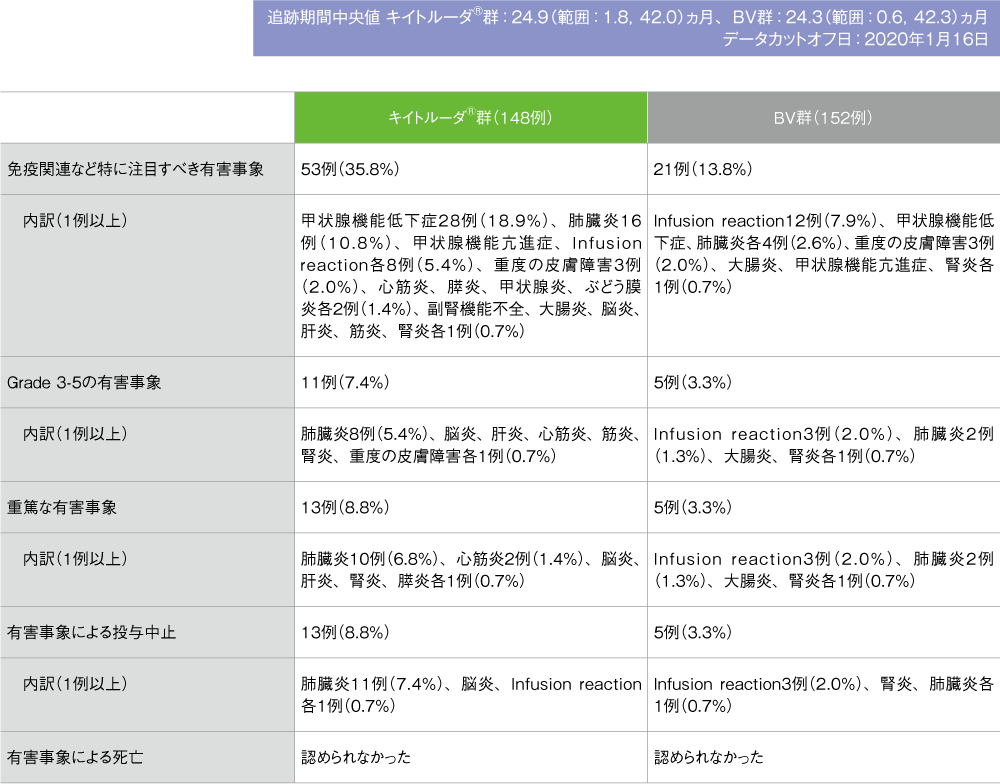
免疫関連など特に注目すべき有害事象(ASaT集団)※
※カテゴリー別で集計
- 免疫関連など特に注目すべき有害事象はキイトルーダ®群で148例中53例(35.8%)、BV群で152例中21例(13.8%)に認められました。このうち、主な有害事象(発現率5%以上)はキイトルーダ®群で甲状腺機能低下症28例(18.9%)、肺臓炎16例(10.8%)、甲状腺機能亢進症及びInfusion reaction各8例(5.4%)、BV群でInfusion reaction12例(7.9%)でした。
免疫関連など特に注目すべき有害事象(ASaT集団)
MedDRA/J version 22.1、GradeはCTCAE version 4.0
造血幹細胞移植による治験薬投与中止、治験薬投与終了後の造血幹細胞移植実施状況、治験薬投与後の同種造血幹細胞移植に関連する合併症

造血幹細胞移植による治験薬投与中止
- 治験薬の投与を1回以上受けた患者のうち、キイトルーダ®群で148例中16例(10.8%)、BV群で152例中17例(11.2%)が造血幹細胞移植により治験薬の投与を中止しました。
治験薬投与終了後の造血幹細胞移植実施状況
治験薬投与終了後の造血幹細胞移植実施状況(ASaT集団)

3例の患者は自家造血幹細胞移植と同種造血幹細胞移植を1回ずつ受けており、いずれにもカウントされている。
治験薬投与後の同種造血幹細胞移植に関連する合併症
- 治験薬投与終了後に同種造血幹細胞移植を受けた患者のうち、キイトルーダ®群で14例中12例(85.7%)、BV群で13例中7例(53.8%)が同種造血幹細胞移植後に有害事象を発現しました。主な同種造血幹細胞移植後の有害事象(発現率20%以上)は、キイトルーダ®群で急性移植片対宿主病8例(57.1%)、慢性移植片対宿主病及び発熱各3例(21.4%)、BV群で急性移植片対宿主病5例(38.5%)、慢性移植片対宿主病3例(23.1%)でした。
- キイトルーダ®群の2例が同種造血幹細胞移植後の有害事象により死亡しました。死亡に至った有害事象は血液量減少性ショック及び呼吸不全各1例であり、治験薬との因果関係は関連なしと判定されました。