データカットオフ:2022年1月12日
MSI-High固形癌:国際共同臨床試験成績:国際共同第Ⅱ相試験<KEYNOTE-158試験> アップデート解析結果(2022年1月12日カットオフ)
承認時評価資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)
国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
※ ここではグループKを含む全コホートから、高頻度マイクロサテライト不安定性(microsatellite instability-high; MSI-High)固形癌患者の成績についてご紹介します。
<各グループに組み入れられたがん種>
A:肛門癌(扁平上皮癌)、B:胆道癌[腺癌:胆嚢又は胆道系(肝内又は肝外胆管癌)、ただしファーター膨大部腫瘍は除く]、C:肺、虫垂、小腸、結腸、直腸及び膵臓由来の神経内分泌腫瘍(高分化型又は中分化型神経内分泌腫瘍)、D:子宮内膜癌(肉腫又は間葉性腫瘍は除く)、E:子宮頸癌(扁平上皮癌)、F:外陰癌(扁平上皮癌)、G:小細胞肺癌、H:中皮腫、I:甲状腺癌、J:唾液腺癌(肉腫又は間葉性腫瘍は除く)、K:MSI-Highの進行性固形がん(結腸・直腸癌を除く)
試験概要
【目的】一次治療として標準的な化学療法歴のある切除不能な局所進行又は転移性のミスマッチ修復(MMR)欠損又はMSI-High*1を有する固形がん患者におけるキイトルーダ®の有効性及び安全性を検討する。
【デザイン】国際共同非無作為化非盲検第Ⅱ相試験
【対象】一次治療として標準的な化学療法歴のある切除不能な局所進行又は転移性のミスマッチ修復(MMR)欠損又はMSI-Highを有する固形癌(non-CRC)患者 アップデート解析のデータカットオフ時点(2022年1月12日)(373例)、承認時評価資料のデータカットオフ時点(2017年4月28日)(94例)
【方法】キイトルーダ®200mgを3週間間隔(Q3W)で点滴静注した。投与開始後12ヵ月までは9週間毎、12ヵ月以降は12週間毎に画像検査による評価を行い、疾患進行(PD)又は許容できない有害事象の発現等による投与中止まで、最長約2年間投与を継続した。
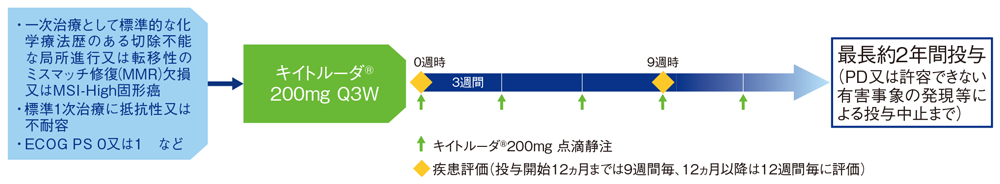
【評価項目】主要評価項目:奏効率(overall response rate; ORR)
副次評価項目:奏効期間(duration of response; DOR)、無増悪生存期間(progression free survival; PFS)、全生存期間(overall survival; OS)、安全性
【判定基準】ORR、DOR、PFSは、独立判定委員会(independent review committee; IRC)がRECISTガイドライン1.1版に基づき評価した。
【解析計画】解析対象集団:有効性*2及び安全性の主要解析はASaT集団*3を対象として実施した。
有効性評価の統計手法:ORRは、点推定値及び二項分布に基づく正確法による95%信頼区間(CI)を算出した。DOR、PFS、OSは、Kaplan-Meier法による生存曲線及びその中央値の推定値を計算した。また、サブグループ解析として、がん種別のORR、DOR、PFS、OSを全体集団と同様の統計手法にて検討した。さらに、日本人集団におけるORR、DOR、PFS、OSは、治験実施計画書に記載されていないが、全体集団と同様の統計手法にて検討し、評価資料として承認時に評価された。
【データカットオフ】2017年4月28日(承認時評価資料)、2022年1月12日(アップデート解析)
*1 本試験ではMMR欠損及びMSI-Highの判定には、それぞれIHC法及びPCR法を用いて検査された。
*2 ORRは、全体(グループA~K)及びグループKのASaT集団を対象とした。
*3 ASaT(all subjects as treated)集団:治験薬を1回以上投与されたすべての患者。
5. 効能又は効果に関連する注意(抜粋)
〈がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)〉
5.9 十分な経験を有する病理医又は検査施設における検査により、MSI-Highが確認された進行・再発の固形癌患者に投与すること。検査にあたっては、関連学会のガイドライン等の最新の情報を参考に、先行の化学療法等によるMSI検査結果への影響及び検査に用いる検体の採取時期について確認し、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.10 結腸・直腸癌以外の固形癌の場合、本剤の一次治療における有効性及び安全性は確立していない。また、二次治療において標準的な治療が可能な場合にはこれらの治療を優先すること。
5.11 本剤の手術の補助療法における有効性及び安全性は確立していない。
5.12 臨床試験に組み入れられた患者のがん種等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと。[17.1.14、17.1.15参照]
患者背景(ASaT集団)
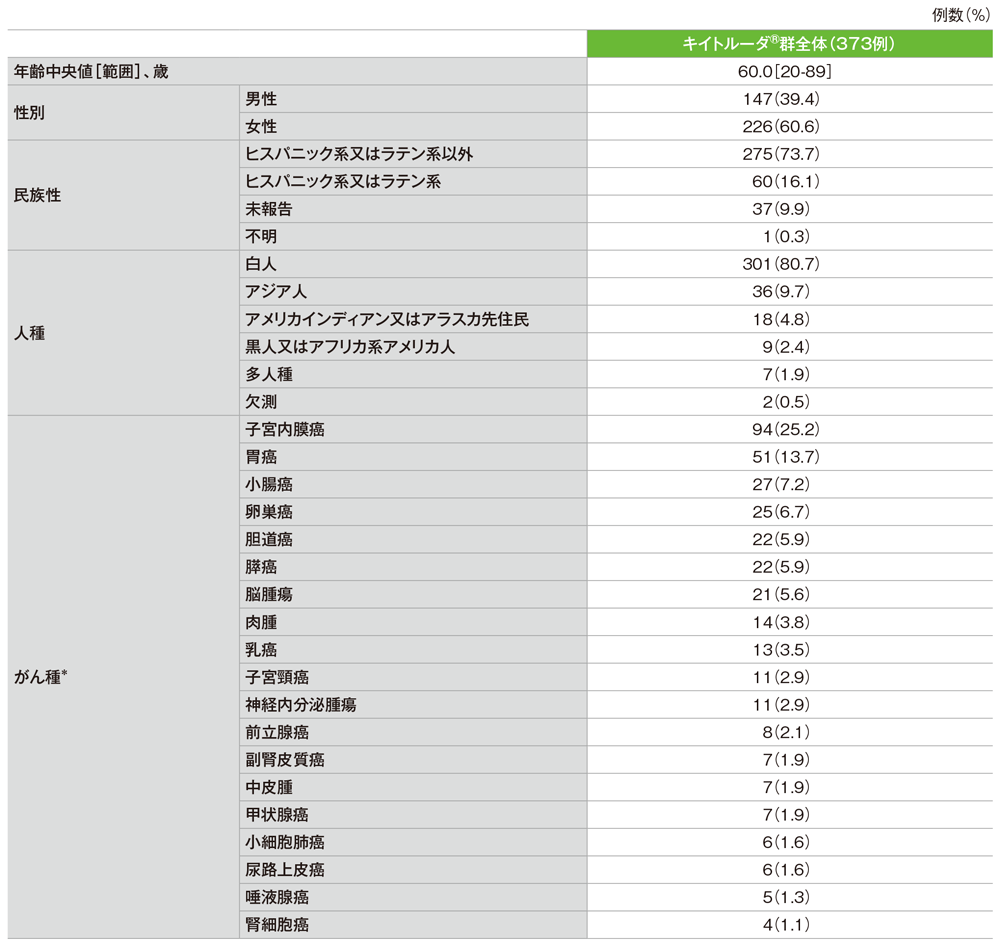
*患者数が3例以下のがん種:肛門癌、頭頸部癌、上咽頭癌、後腹膜腫瘍、精巣腫瘍、膣癌、外陰癌、虫垂腺癌 NOS(not otherwise specified)、肝細胞癌、原発不明癌
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)より作成
主要評価項目 奏効率:ORR
奏効率(ORR)(ASaT集団)
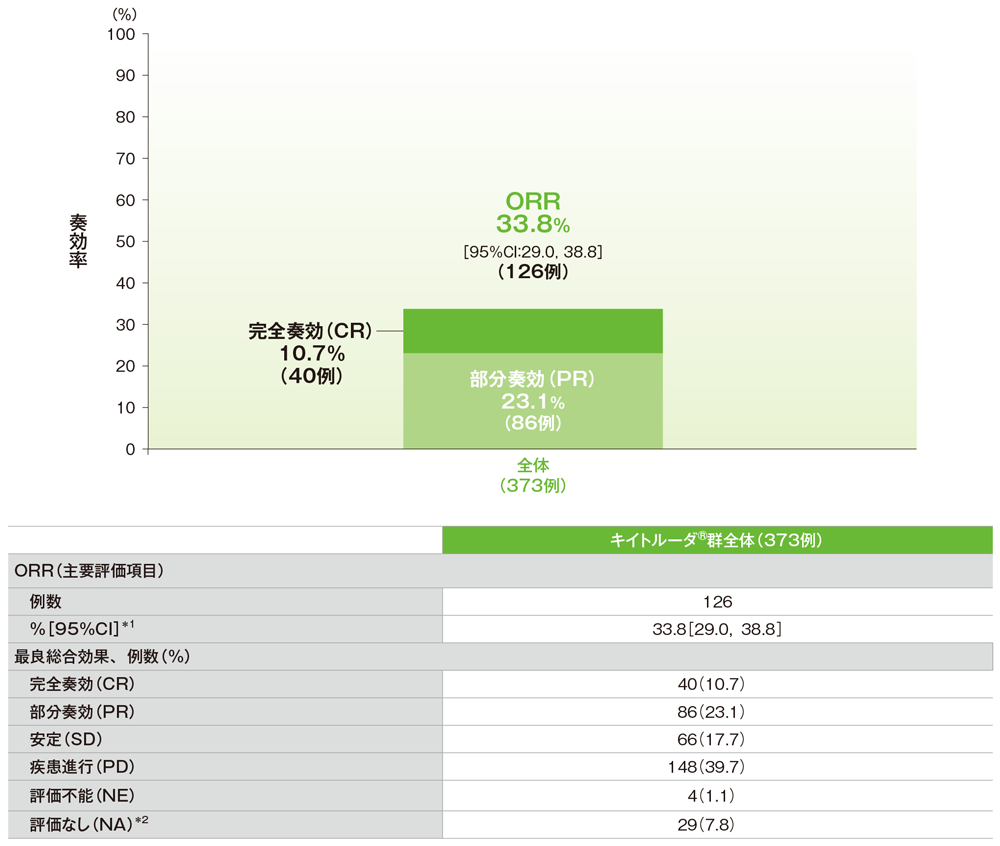
*1 二項分布の確率計算による正確法
*2 ベースライン後奏効率の評価を行っていない患者
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)より作成
- ORRはキイトルーダ®群全体において33.8%(95%CI:29.0, 38.8)でした。
ベースラインからの腫瘍径の最大変化率(ウォーターフォールプロット)
ベースラインからの腫瘍径の最大変化率(ウォーターフォールプロット)(ASaT集団)
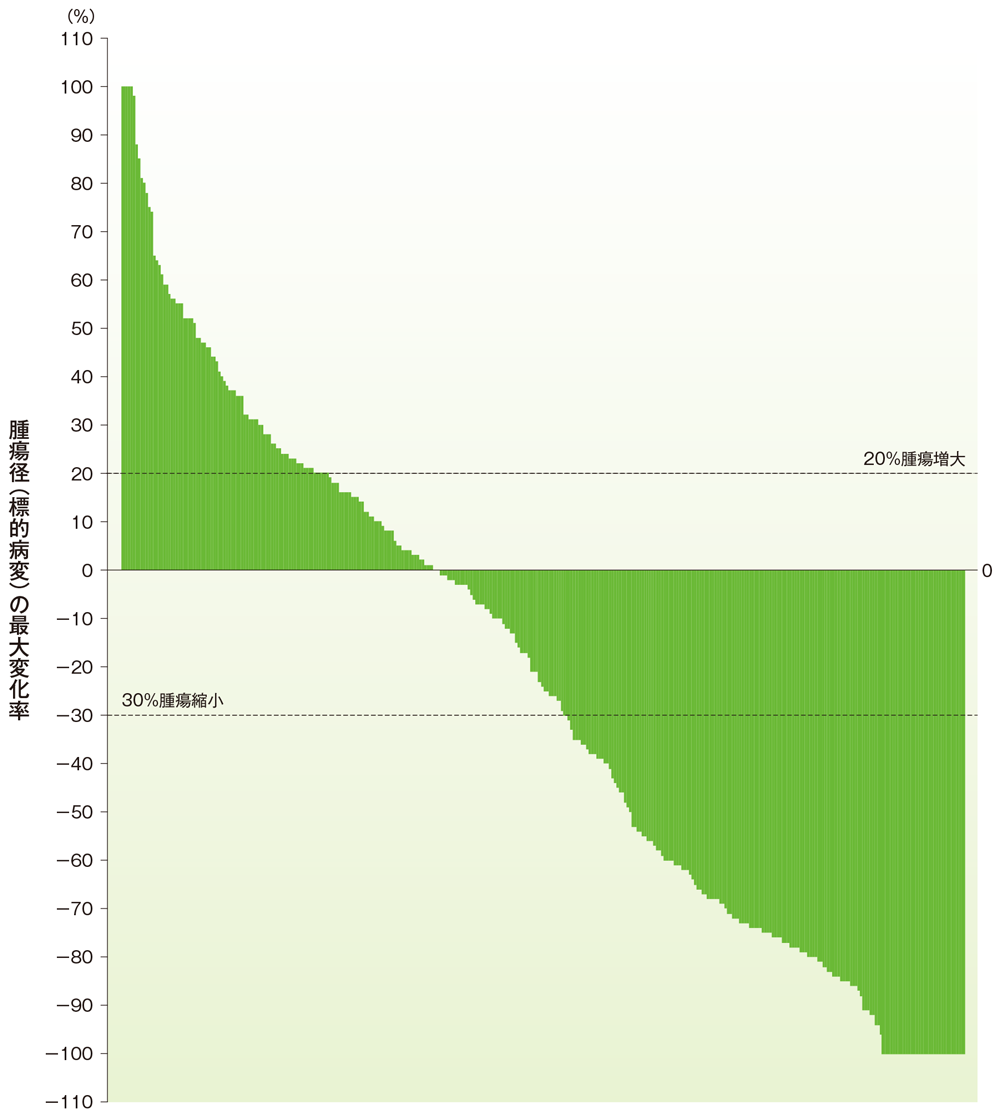
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
副次評価項目 奏効期間:DOR
奏効期間(DOR)のKaplan-Meier曲線(ASaT集団)
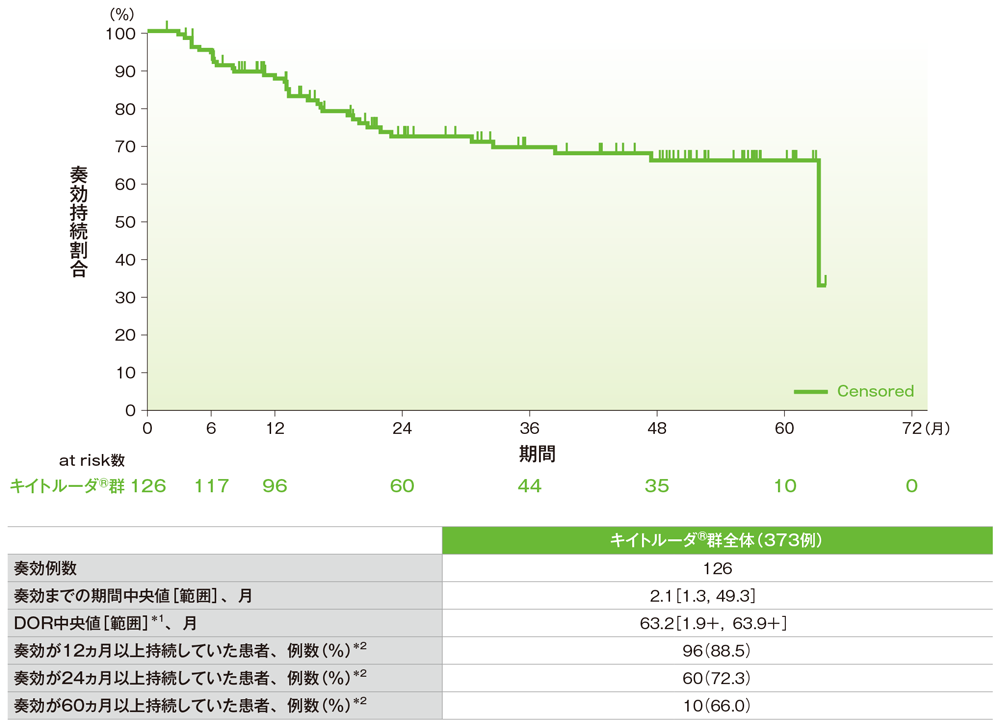
*1 「+」は最後の疾患評価までにPDがみられないことを示す
*2 Kaplan-Meier曲線から推定される値
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 奏効までの期間中央値は2.1ヵ月(範囲:1.3, 49.3)、奏効期間中央値は63.2ヵ月(範囲:1.9+, 63.9+)*1でした。
- 奏効が認められた患者126例のうち、奏効が12ヵ月以上持続していた患者*2は96例(88.5%)、24ヵ月以上持続していた患者*2は60例(72.3%)、60ヵ月以上持続していた患者*2は10例(66.0%)でした。
副次評価項目 無増悪生存期間:PFS
無増悪生存期間(PFS)のKaplan-Meier曲線(ASaT集団)
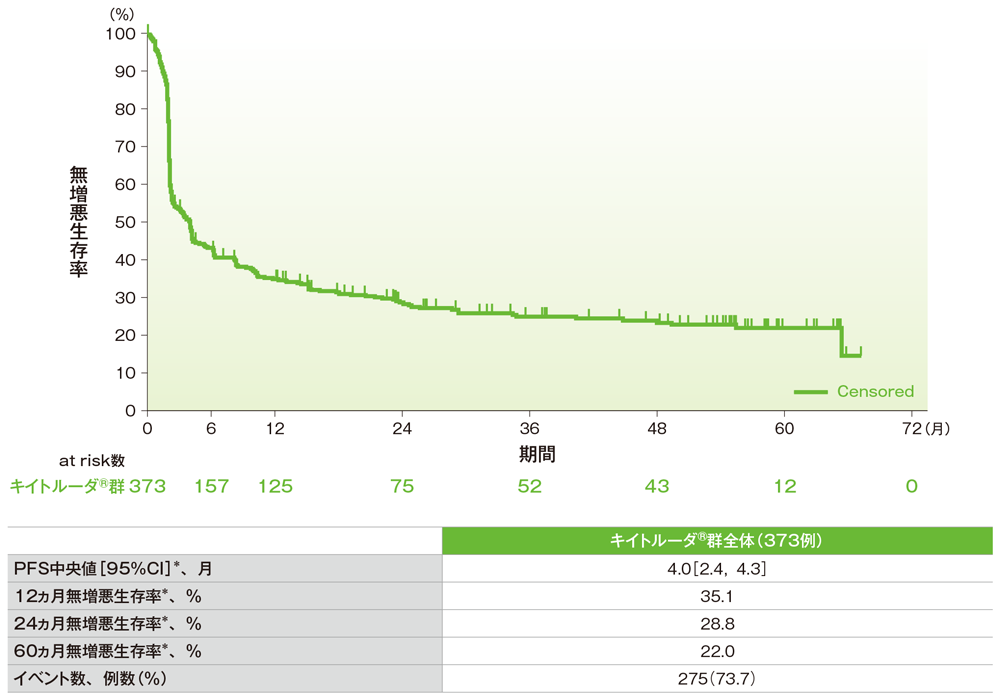
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- PFS中央値は4.0ヵ月(95%CI:2.4, 4.3)でした。
- 12ヵ月無増悪生存率は35.1%、24ヵ月無増悪生存率は28.8%、60ヵ月無増悪生存率は22.0%でした。
副次評価項目 全生存期間:OS
全生存期間(OS)のKaplan-Meier曲線(ASaT集団)
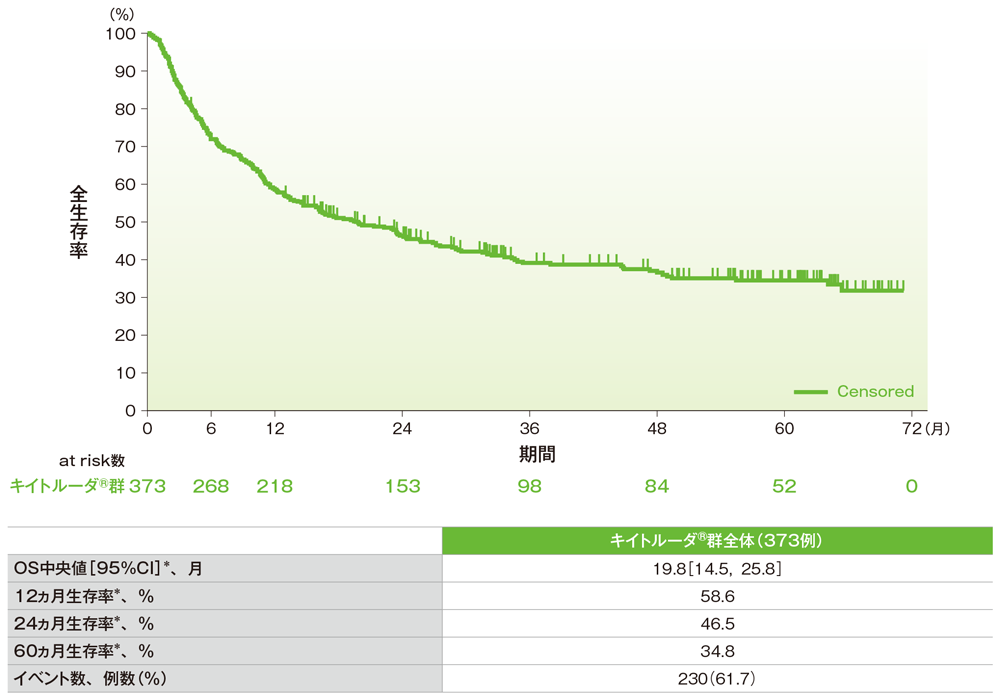
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- OS中央値は19.8ヵ月(95%CI:14.5, 25.8)でした。
- 12ヵ月生存率は58.6%、24ヵ月生存率は46.5%、60ヵ月生存率は34.8%でした。
サブグループ解析 がん種別の奏効率(CR+PR)*1
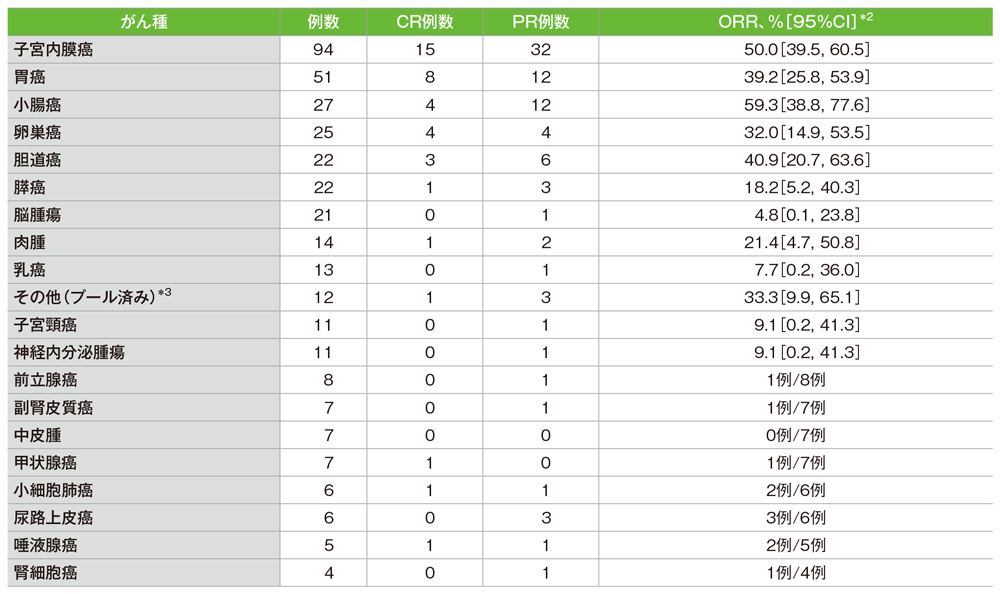
*1 解析対象は、治験薬を1回以上投与した患者
*2 二項分布の確率計算による正確法
*3 その他(プール済み)は、患者数が3例以下のがん種[肛門癌、頭頸部癌、上咽頭癌、後腹膜腫瘍、精巣腫瘍、膣癌、外陰癌、虫垂腺癌 NOS(not otherwise specified)、肝細胞癌、原発不明癌]を含む
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- がん種別の奏効率は、小腸癌59.3%(16/27例)、子宮内膜癌50.0%(47/94例)、胆道癌40.9%(9/22例)及び胃癌39.2%(20/51例)でした。
サブグループ解析 がん種別のPFS、OS、DOR*1、2
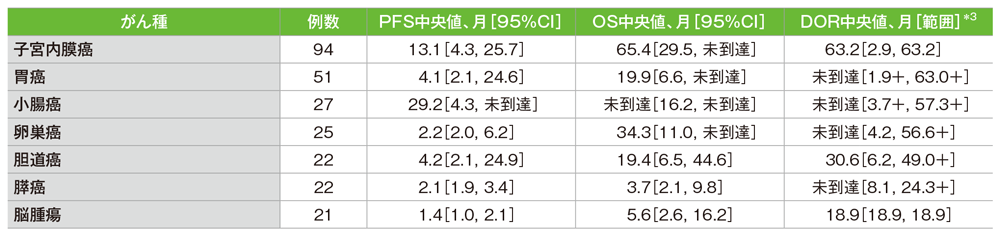
*1 20例以上のがん種のデータを掲載
*2 PFS、OSの解析対象は、治験薬を1回以上投与した患者。DORの解析対象は、奏効を達成した患者
*3「+」は最後の疾患評価までにPDがみられないことを示す
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
子宮内膜癌のベースラインからの腫瘍径の最大変化率
ベースラインからの腫瘍径の最大変化率(子宮内膜癌)
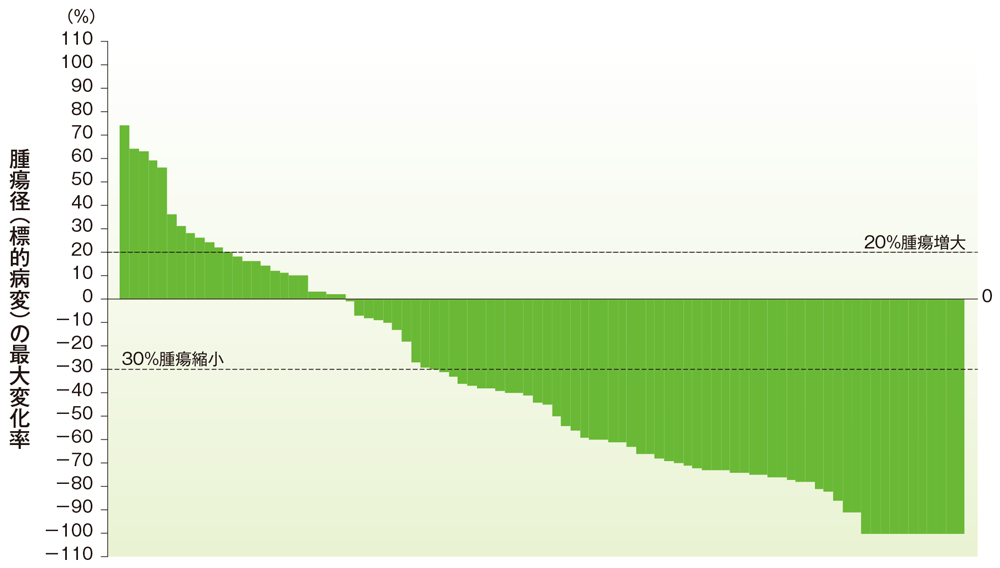
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 子宮内膜癌患者の奏効率は50.0%(95%CI:39.5, 60.5)でした(ORR:サブグループ解析にて規定)。
サブグループ解析 子宮内膜癌の無増悪生存期間(PFS)
無増悪生存期間(PFS)のKaplan-Meier曲線(子宮内膜癌)
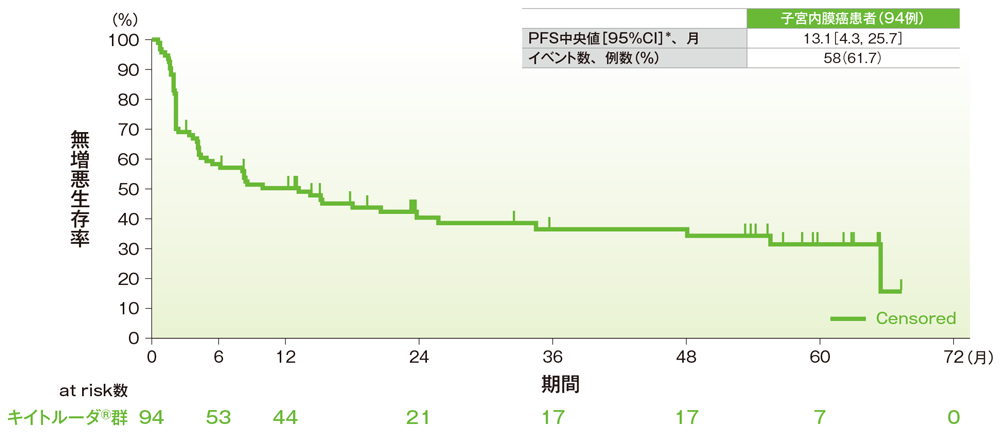
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 子宮内膜癌患者のPFS中央値は13.1ヵ月(95%CI:4.3, 25.7)でした。
サブグループ解析 子宮内膜癌の全生存期間(OS)
全生存期間(OS)のKaplan-Meier曲線(子宮内膜癌)
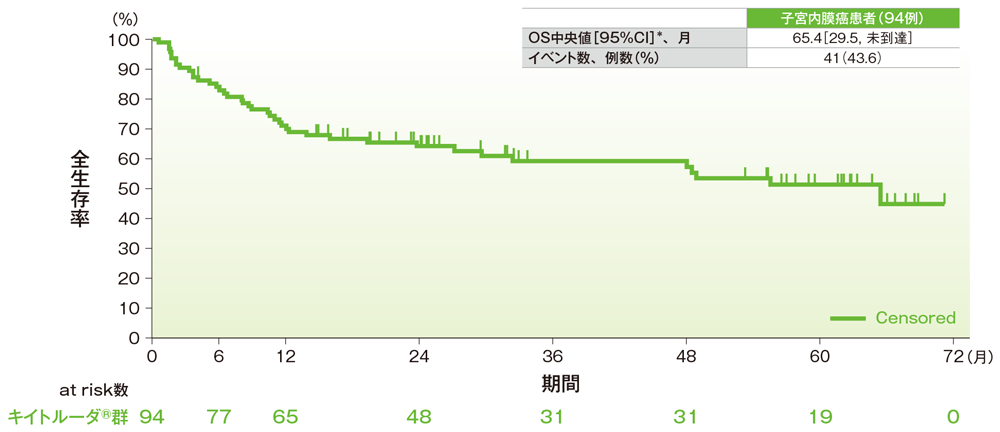
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 子宮内膜癌患者のOS中央値は65.4ヵ月(95%CI:29.5, 未到達)でした。
サブグループ解析 子宮内膜癌の奏効までの期間及び奏効期間(DOR)
奏効期間(DOR)のKaplan-Meier曲線(子宮内膜癌)
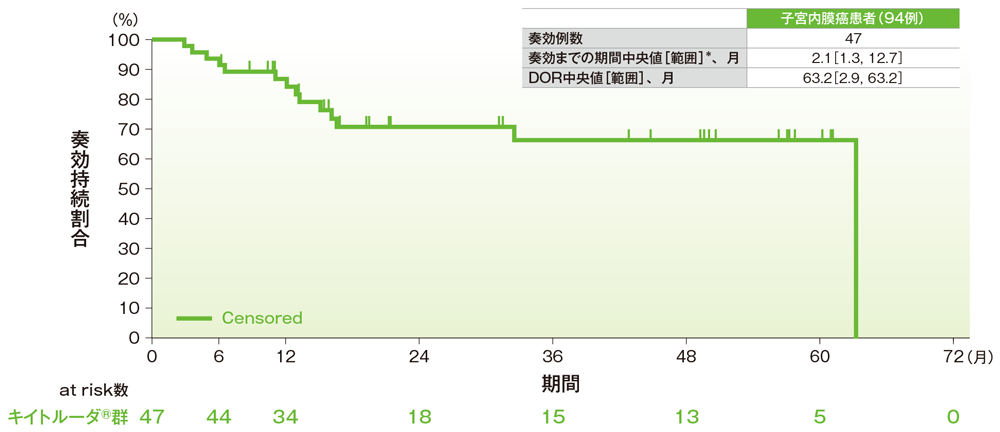
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 子宮内膜癌患者の奏効期間中央値は63.2ヵ月(範囲:2.9, 63.2)でした。
胃癌のベースラインからの腫瘍径の最大変化率
ベースラインからの腫瘍径の最大変化率(胃癌)
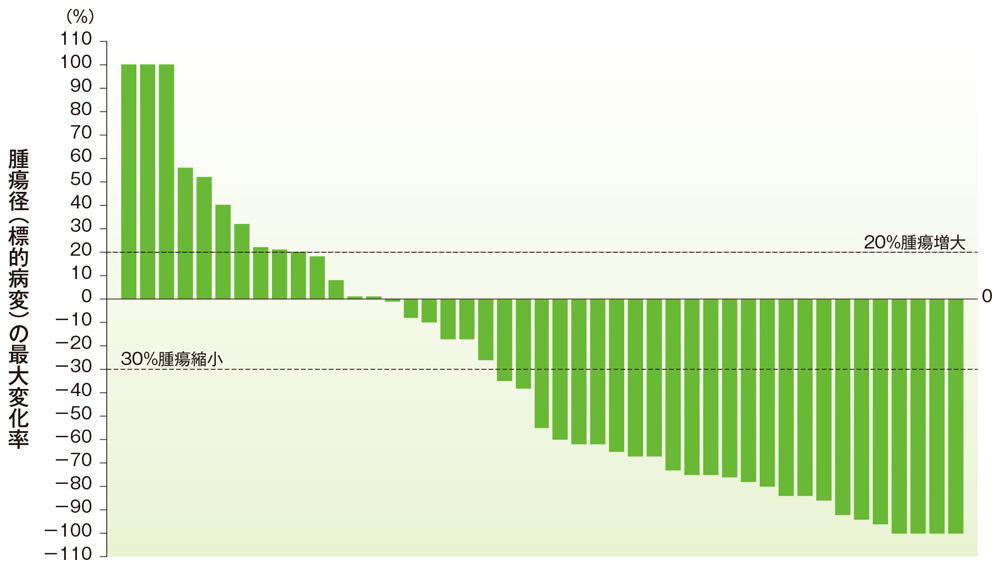
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 胃癌患者の奏効率は39.2%(95%CI:25.8, 53.9)でした(ORR:サブグループ解析にて規定)。
サブグループ解析 胃癌の無増悪生存期間(PFS)
無増悪生存期間(PFS)のKaplan-Meier曲線(胃癌)
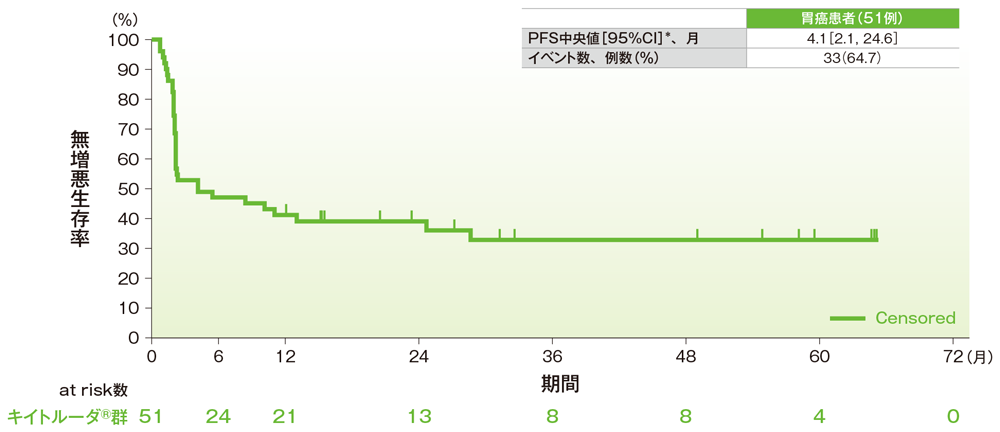
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 胃癌患者のPFS中央値は4.1ヵ月(95%CI:2.1, 24.6)でした。
サブグループ解析 胃癌の全生存期間(OS)
全生存期間(OS)のKaplan-Meier曲線(胃癌)
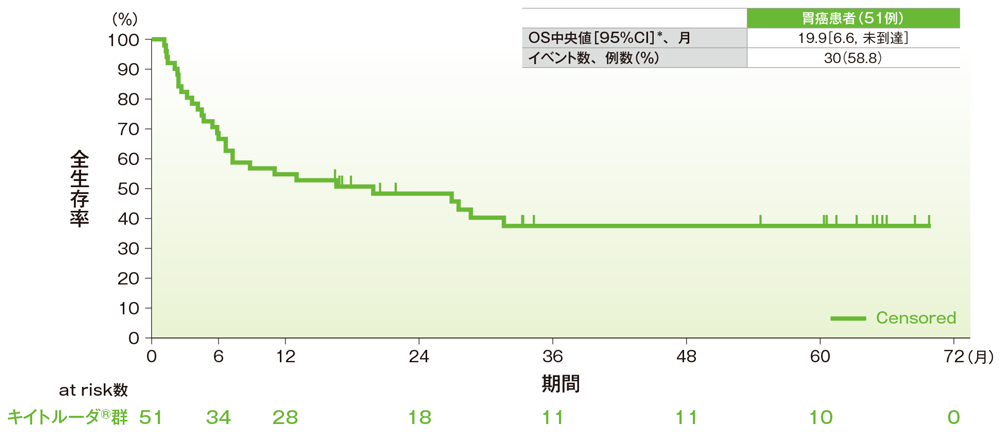
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 胃癌患者のOS中央値は19.9ヵ月(95%CI:6.6, 未到達)でした。
サブグループ解析 胃癌の奏効までの期間及び奏効期間(DOR)
奏効期間(DOR)のKaplan-Meier曲線(胃癌)
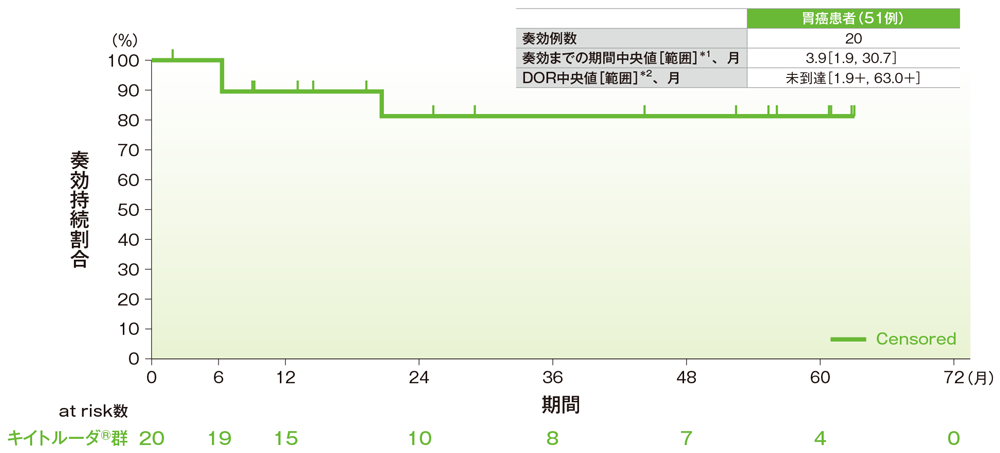
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2「+」は最後の疾患評価までにPDがみられないことを示す
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 胃癌患者の奏効期間は中央値に未到達(範囲:1.9+, 63.0+)でした。
小腸癌のベースラインからの腫瘍径の最大変化率
ベースラインからの腫瘍径の最大変化率(小腸癌)
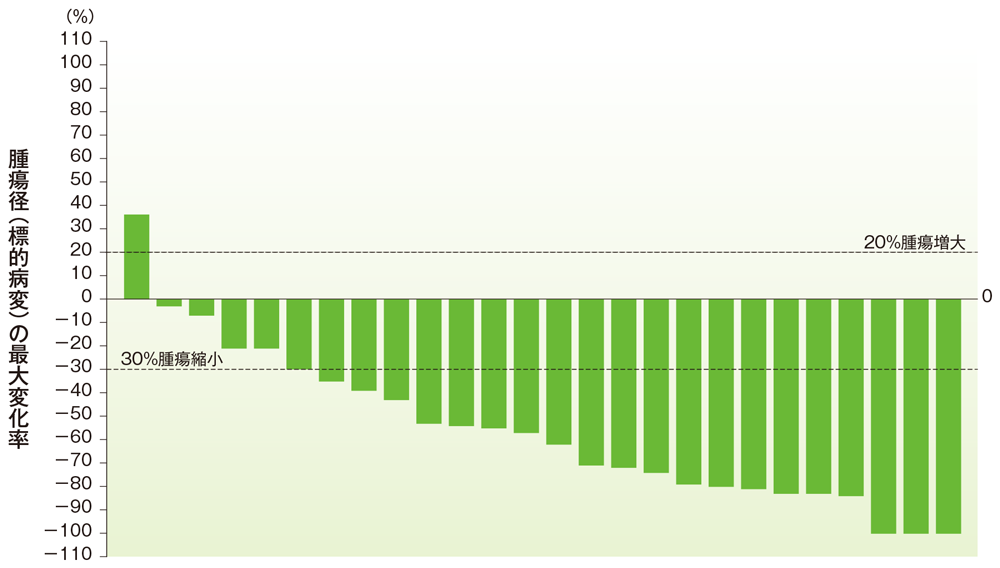
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 小腸癌患者の奏効率は59.3%(95%CI:38.8, 77.6)でした(ORR:サブグループ解析にて規定)。
サブグループ解析 小腸癌の無増悪生存期間(PFS)
無増悪生存期間(PFS)のKaplan-Meier曲線(小腸癌)
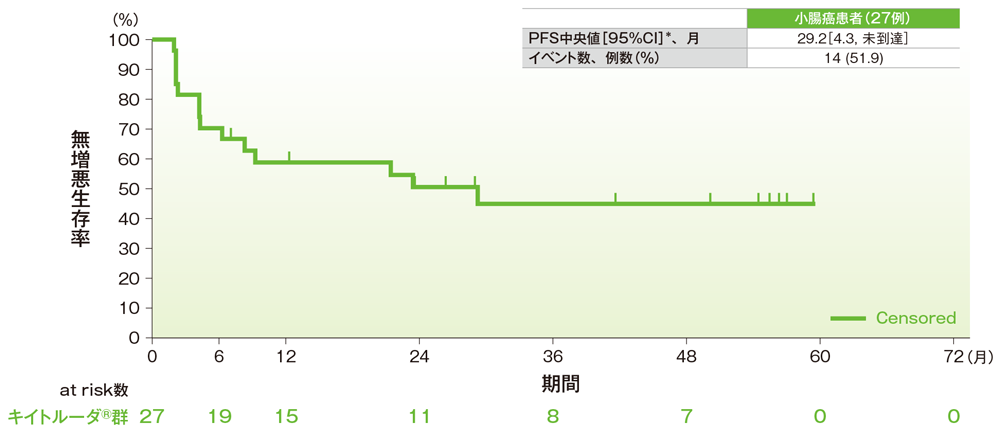
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 小腸癌患者のPFS中央値は29.2ヵ月(95%CI:4.3, 未到達)でした。
サブグループ解析 小腸癌の全生存期間(OS)
全生存期間(OS)のKaplan-Meier曲線(小腸癌)
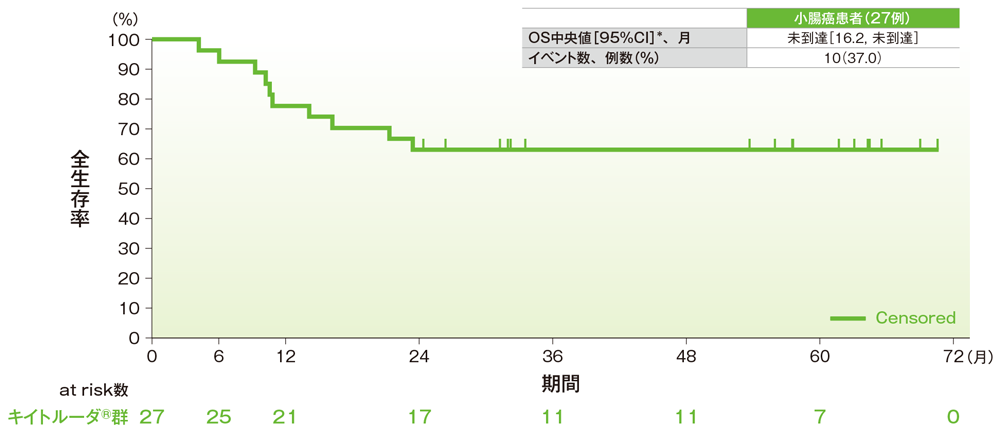
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 小腸癌患者のOSは中央値に未到達(95%CI:16.2, 未到達)でした。
サブグループ解析 小腸癌の奏効までの期間及び奏効期間(DOR)
奏効期間(DOR)のKaplan-Meier曲線(小腸癌)
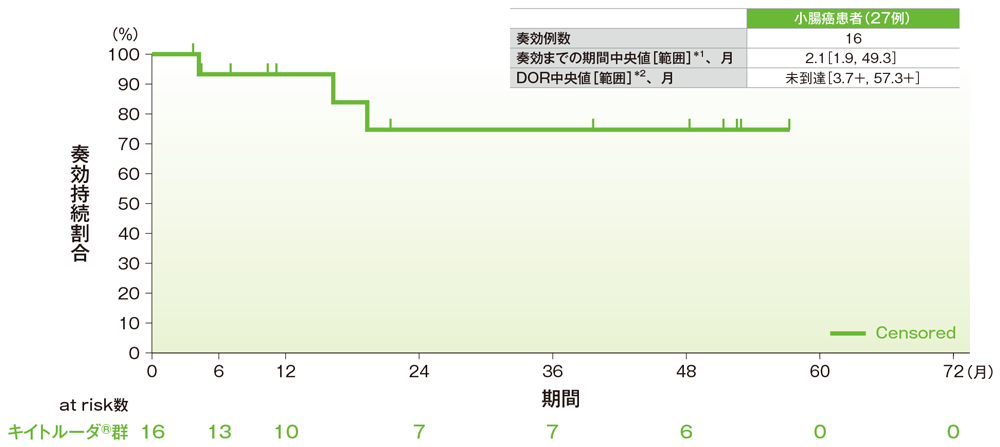
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までにPDがみられないことを示す
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 小腸癌患者の奏効期間は中央値に未到達(範囲:3.7+, 57.3+)でした。
卵巣癌のベースラインからの腫瘍径の最大変化率
ベースラインからの腫瘍径の最大変化率(卵巣癌)
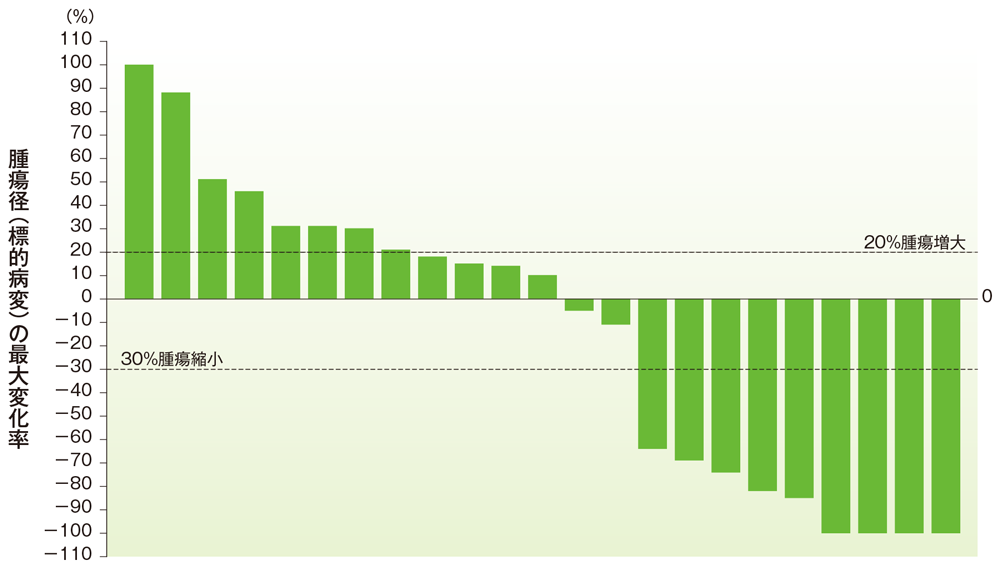
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 卵巣癌患者の奏効率は32.0%(95%CI:14.9, 53.5)でした(ORR:サブグループ解析にて規定)。
サブグループ解析 卵巣癌の無増悪生存期間(PFS)
無増悪生存期間(PFS)のKaplan-Meier曲線(卵巣癌)
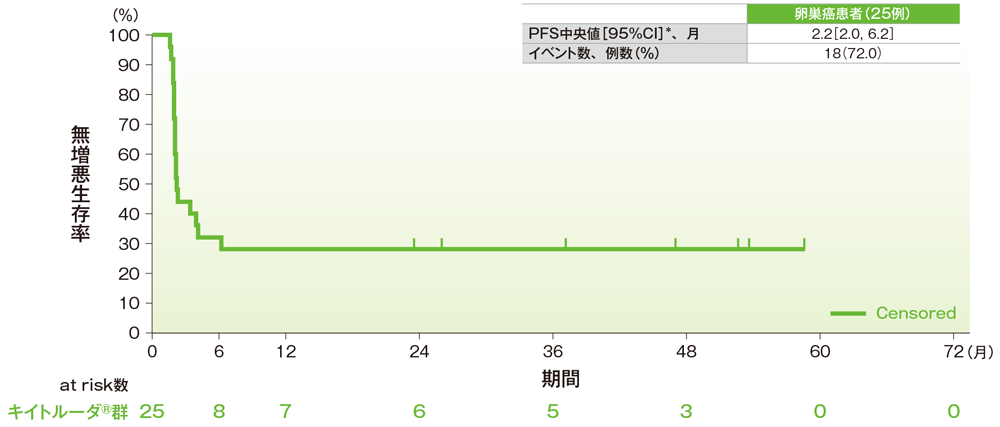
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 卵巣癌患者のPFS中央値は2.2ヵ月(95%CI:2.0, 6.2)でした。
サブグループ解析 卵巣癌の全生存期間(OS)
全生存期間(OS)のKaplan-Meier曲線(卵巣癌)
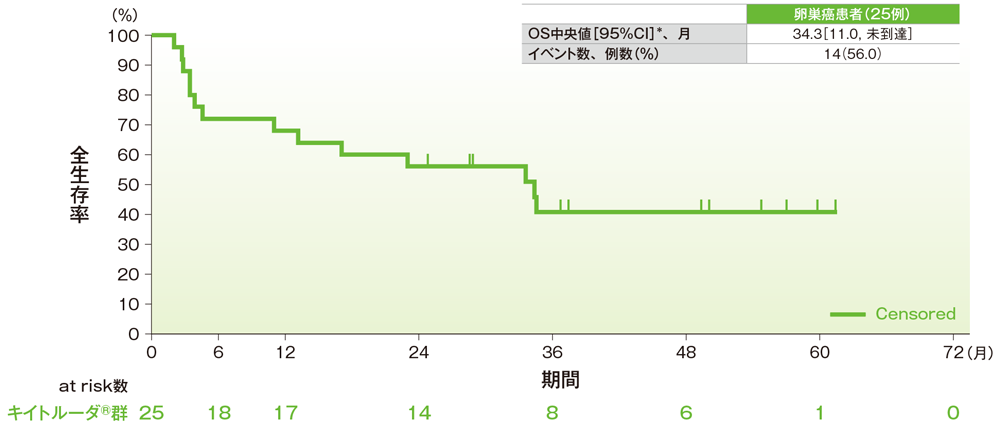
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 卵巣癌患者のOS中央値は34.3ヵ月(95%CI:11.0, 未到達)でした。
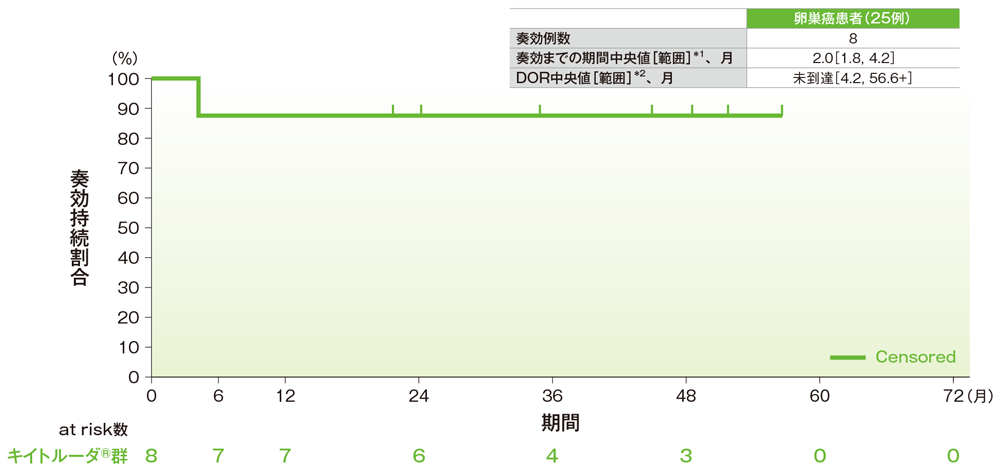
サブグループ解析 卵巣癌の奏効までの期間及び奏効期間(DOR)
奏効期間(DOR)のKaplan-Meier曲線(卵巣癌)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までにPDがみられないことを示す
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 卵巣癌患者の奏効期間は中央値に未到達(範囲:4.2, 56.6+)でした。
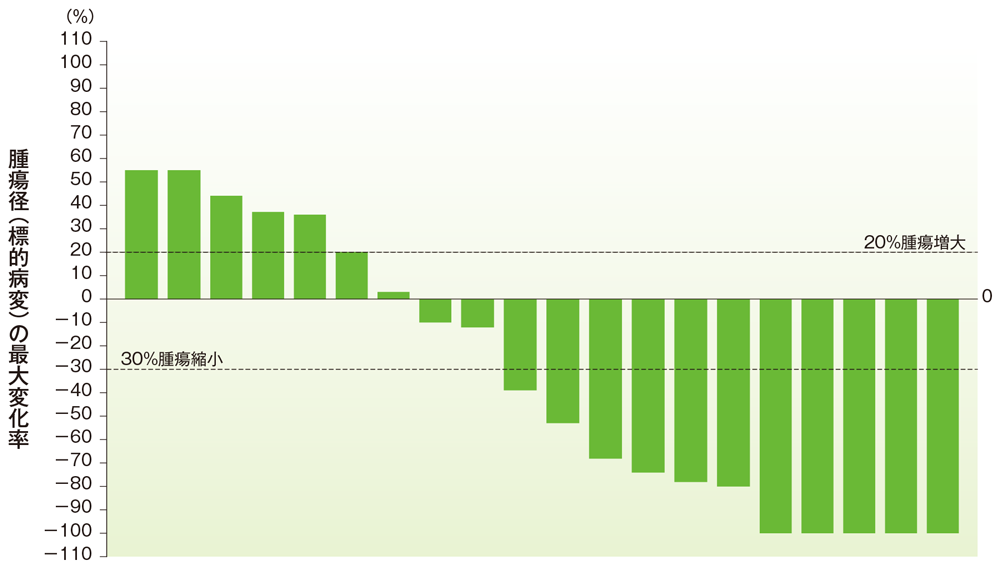
胆道癌のベースラインからの腫瘍径の最大変化率
ベースラインからの腫瘍径の最大変化率(胆道癌)
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 胆道癌患者の奏効率は40.9%(95%CI:20.7, 63.6)でした(ORR:サブグループ解析にて規定)。
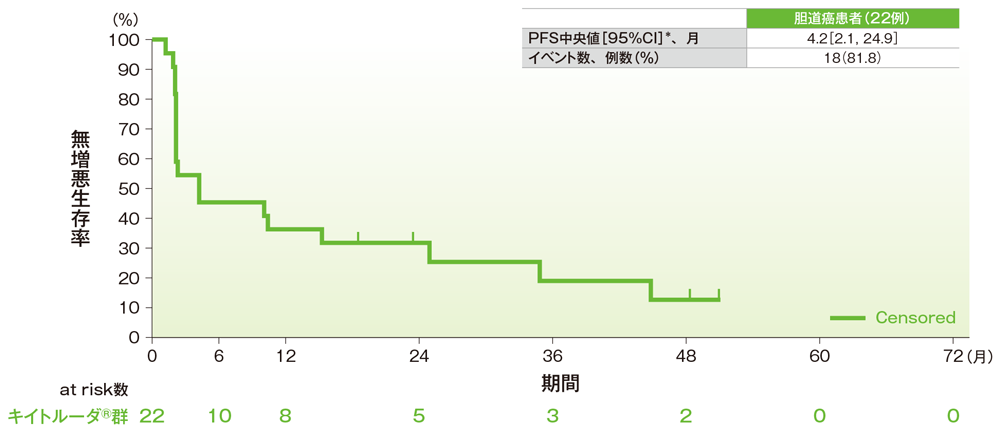
サブグループ解析 胆道癌の無増悪生存期間(PFS)
無増悪生存期間(PFS)のKaplan-Meier曲線(胆道癌)
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 胆道癌患者のPFS中央値は4.2ヵ月(95%CI:2.1, 24.9)でした。
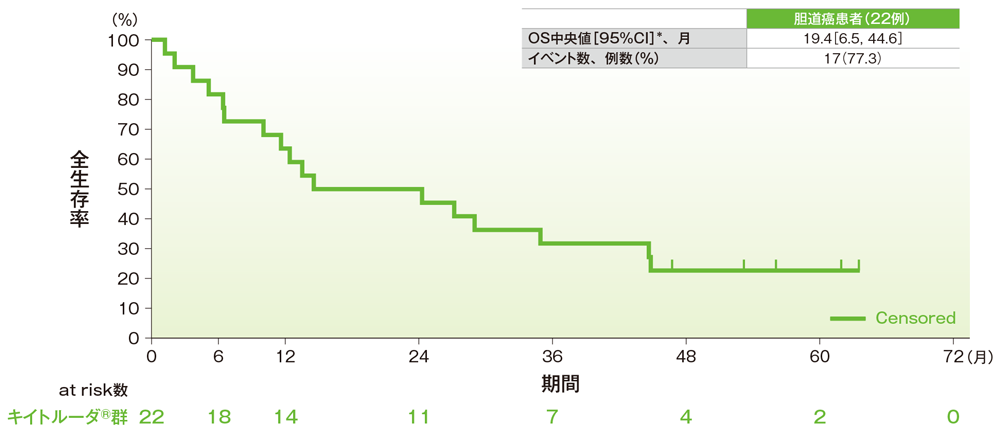
サブグループ解析 胆道癌の全生存期間(OS)
全生存期間(OS)のKaplan-Meier曲線(胆道癌)
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 胆道癌患者のOS中央値は19.4ヵ月(95%CI:6.5, 44.6)でした。
サブグループ解析 胆道癌の奏効までの期間及び奏効期間(DOR)
奏効期間(DOR)のKaplan-Meier曲線(胆道癌)
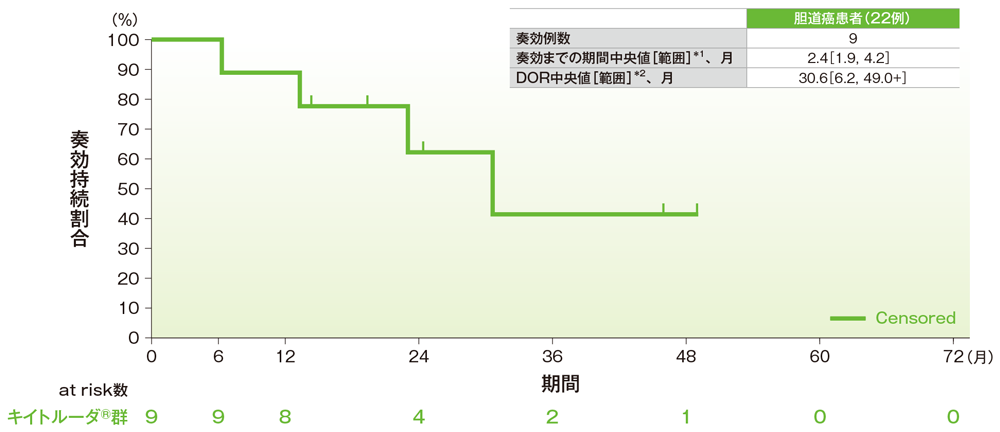
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までにPDがみられないことを示す
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 胆道癌患者の奏効期間中央値は30.6ヵ月(範囲:6.2, 49.0+)でした。
膵癌のベースラインからの腫瘍径の最大変化率
ベースラインからの腫瘍径の最大変化率(膵癌)
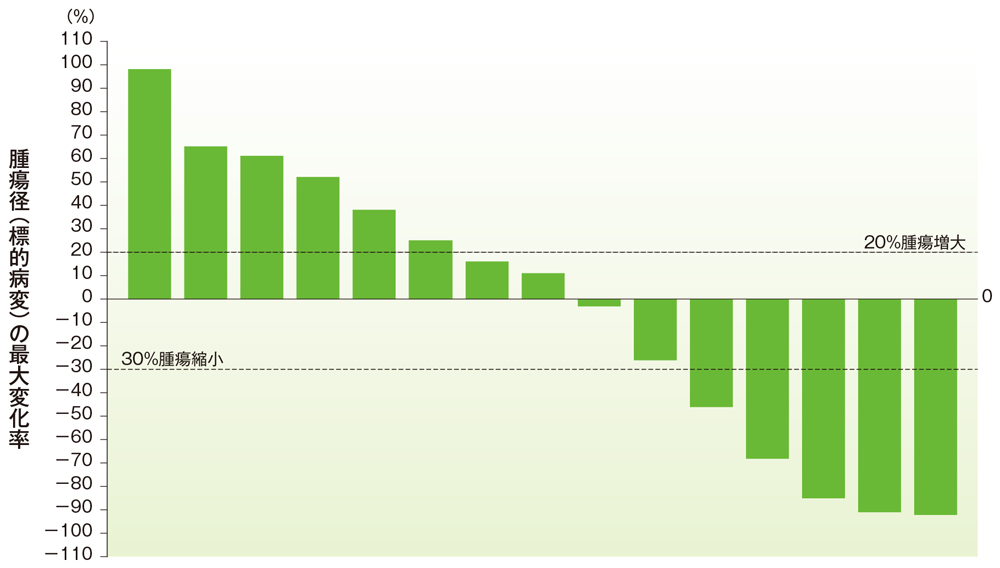
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 膵癌患者の奏効率は18.2%(95%CI:5.2, 40.3)でした(ORR:サブグループ解析にて規定)。
サブグループ解析 膵癌の無増悪生存期間(PFS)
無増悪生存期間(PFS)のKaplan-Meier曲線(膵癌)
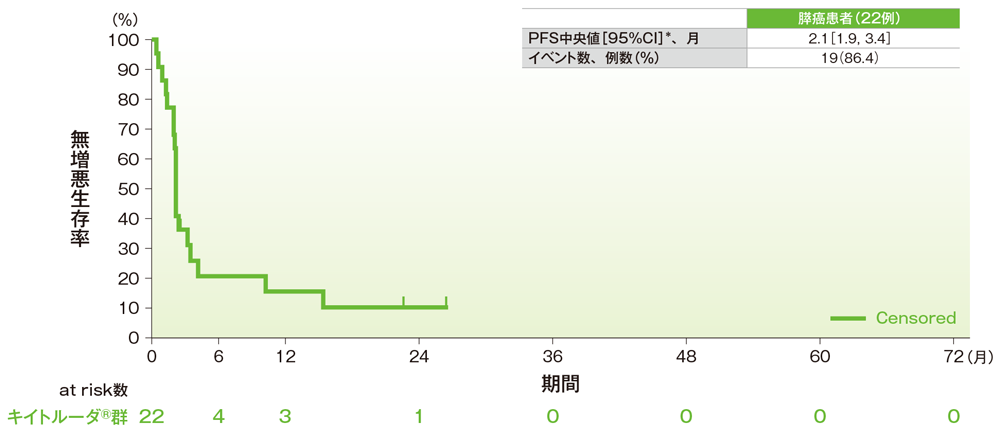
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 膵癌患者のPFS中央値は2.1ヵ月(95%CI:1.9, 3.4)でした。
サブグループ解析 膵癌の全生存期間(OS)
全生存期間(OS)のKaplan-Meier曲線(膵癌)
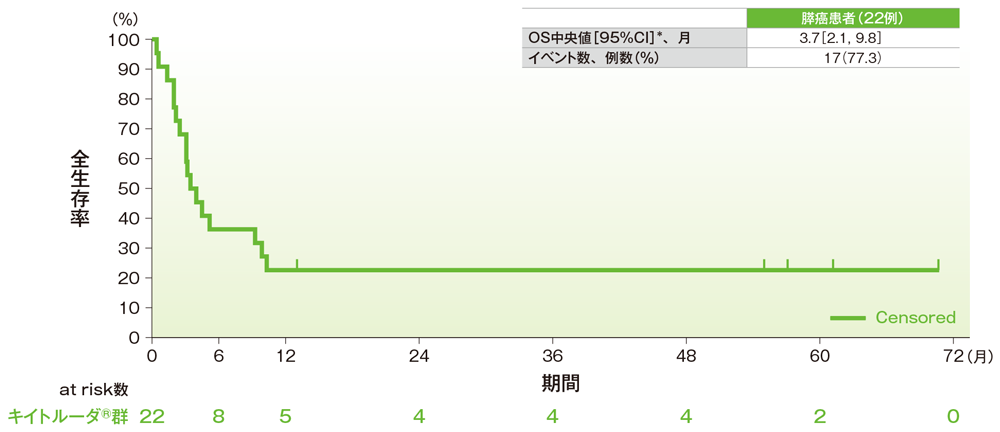
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 膵癌患者のOS中央値は3.7ヵ月(95%CI:2.1, 9.8)でした。
サブグループ解析 膵癌の奏効までの期間及び奏効期間(DOR)
奏効期間(DOR)のKaplan-Meier曲線(膵癌)
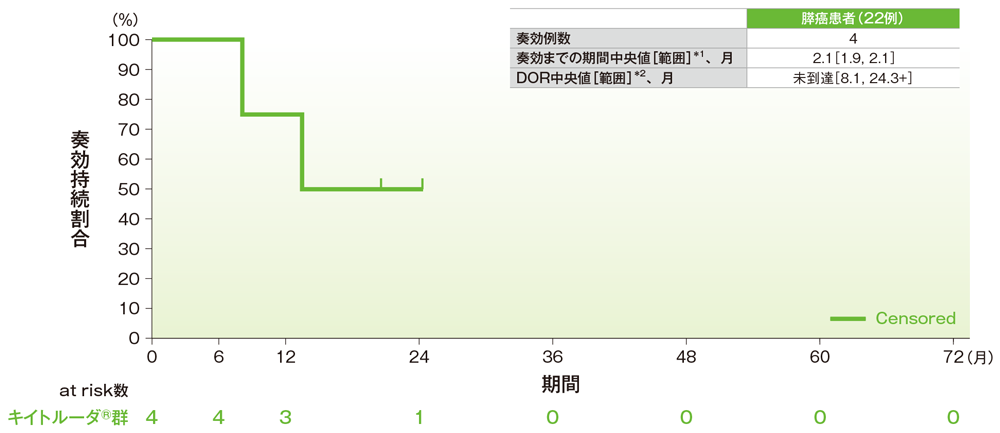
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2「 +」は最後の疾患評価までにPDがみられないことを示す
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 膵癌患者の奏効期間は中央値に未到達(範囲:8.1, 24.3+)でした。
脳腫瘍のベースラインからの腫瘍径の最大変化率
ベースラインからの腫瘍径の最大変化率(脳腫瘍)
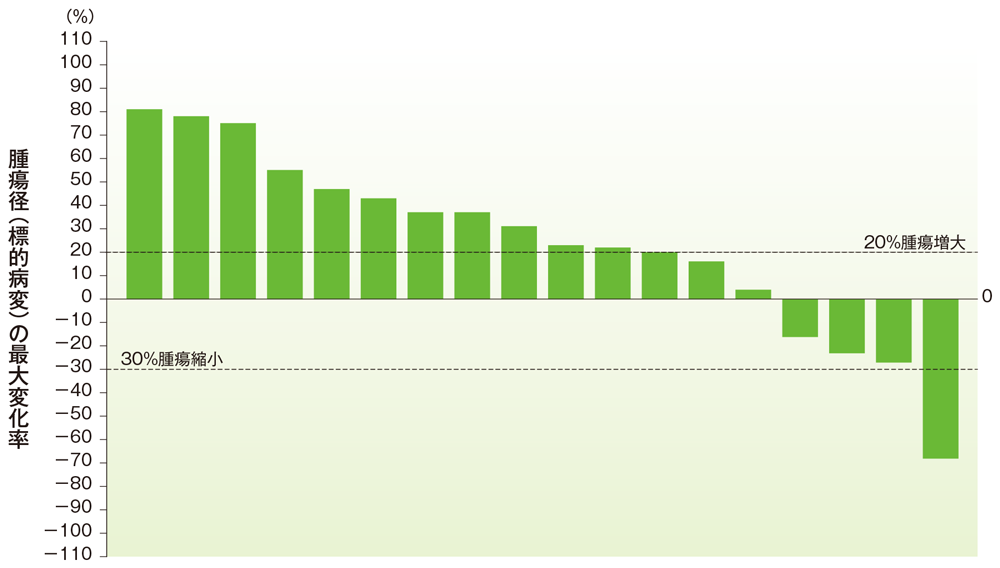
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 脳腫瘍患者の奏効率は4.8%(95%CI:0.1, 23.8)でした(ORR:サブグループ解析にて規定)。
サブグループ解析 脳腫瘍の無増悪生存期間(PFS)
無増悪生存期間(PFS)のKaplan-Meier曲線(脳腫瘍)
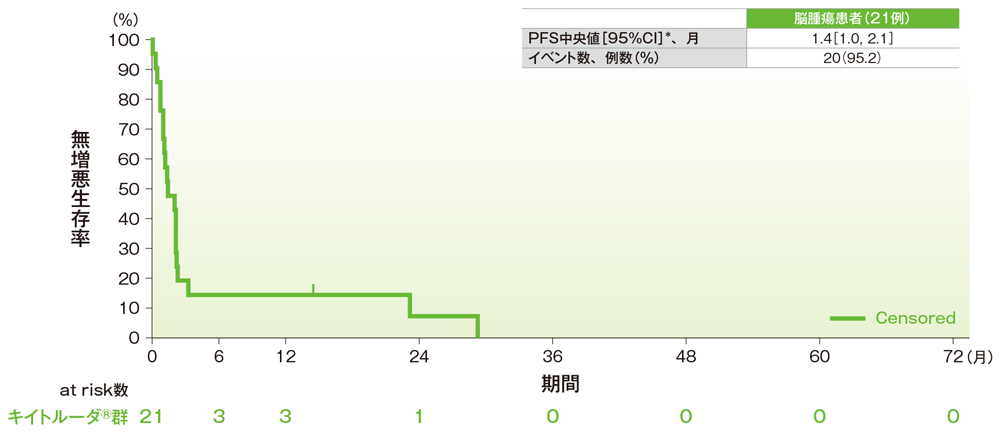
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 脳腫瘍患者のPFS中央値は1.4ヵ月(95%CI:1.0, 2.1)でした。
サブグループ解析 脳腫瘍の全生存期間(OS)
全生存期間(OS)のKaplan-Meier曲線(脳腫瘍)
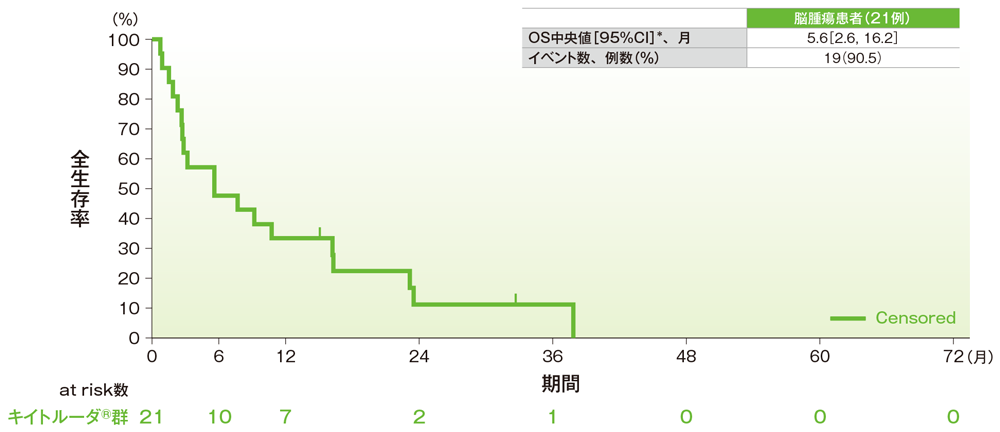
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 脳腫瘍患者のOS中央値は5.6ヵ月(95%CI:2.6, 16.2)でした。
サブグループ解析 脳腫瘍の奏効までの期間及び奏効期間(DOR)
奏効期間(DOR)のKaplan-Meier曲線(脳腫瘍)
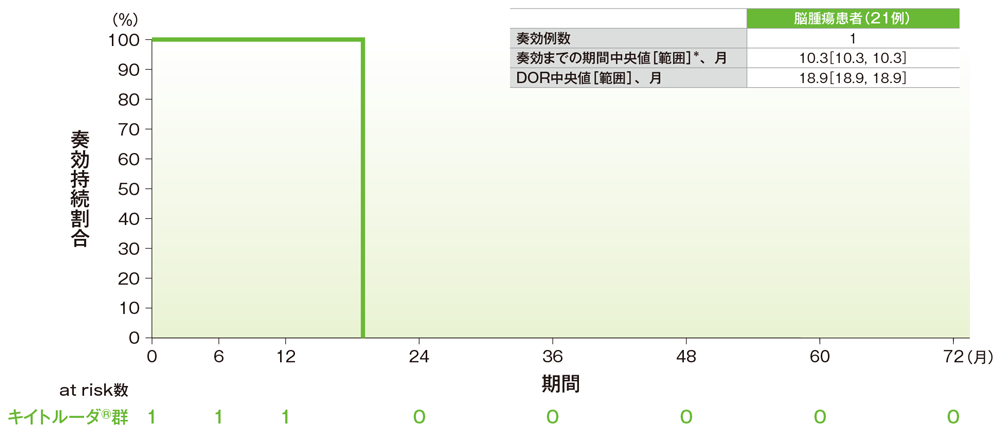
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)
- 脳腫瘍患者の奏効期間中央値は18.9ヵ月(範囲:18.9, 18.9)でした。
主な副作用(ASaT集団)
副作用(発現率10%以上)
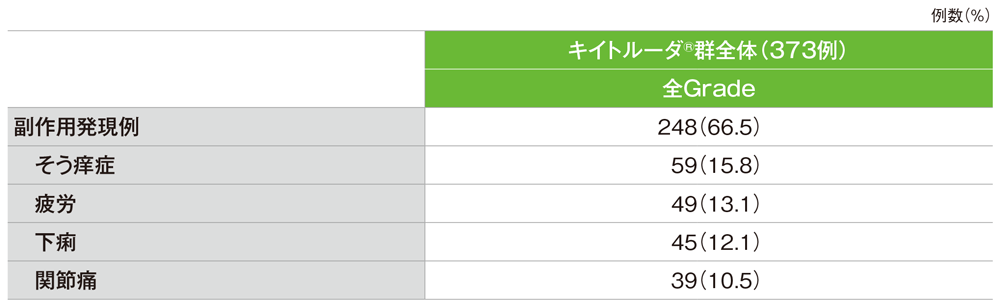
GradeはCTCAE v4.03
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)より作成
Grade 3以上の副作用(発現率1%以上)

GradeはCTCAE v4.03
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)より作成
- 副作用は248/373例(66.5%)に認められました。主な副作用(発現率10%以上)は、そう痒症59例(15.8%)、疲労49例(13.1%)、下痢45例(12.1%)、関節痛39例(10.5%)でした。
- 重篤な副作用は、28/373例(7.5%)に認められました。2例以上に認められた重篤な副作用は、肺臓炎4例(1.1%)、ギラン・バレー症候群及び肝炎各2例(0.5%)でした。
- 副作用による投与中止(3例以上)は、肝炎、アスパラギン酸アミノトランスフェラーゼ増加及び肺臓炎各3例(0.8%)でした。
- 副作用による死亡は心筋炎、肺炎及びギラン・バレー症候群各1例でした。
免疫関連など特に注目すべき有害事象(ASaT集団)
免疫関連など特に注目すべき有害事象(発現率2%以上)
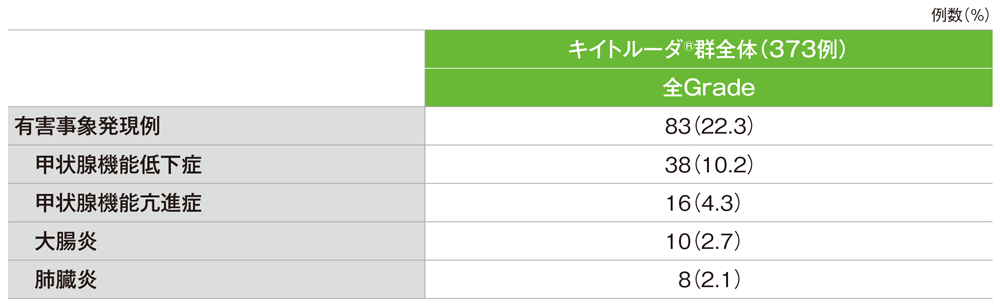
GradeはCTCAE v4.03
社内資料:国際共同第Ⅱ相試験(KEYNOTE-158試験)アップデート解析(2022年1月12日カットオフ)(承認条件に係る解析)より作成
- 免疫関連など特に注目すべき有害事象は83/373例(22.3%)に認められました。主な免疫関連など特に注目すべき有害事象(発現率2%以上)は、甲状腺機能低下症38例(10.2%)、甲状腺機能亢進症16例(4.3%)、大腸炎10例(2.7%)及び肺臓炎8例(2.1%)でした。