製品基本Q&A
製品基本Q&A
ジャヌビア®(シタグリプチンリン酸塩水和物)
2型糖尿病です。
<引用>
電子添文
インクレチンであるglucagon-like peptide1(GLP-1)及びglucose-dependent insulinotropic polypeptide(GIP)は、グルコース恒常性の維持にかかわるホルモンです。シタグリプチンは、DPP-4酵素を阻害し、インクレチンのDPP-4による分解を抑制します。活性型インクレチン濃度を上昇させることにより、血糖値依存的にインスリン分泌促進作用並びにグルカゴン濃度低下作用を増強し血糖コントロールを改善します。
<引用>
電子添文
次の2つの理由によりフィルムコーティングしています。
・原薬の苦味をマスクする
・錠剤を着色(*)する
(*)錠剤の識別のために、用量ごとに異なる色にしています。
使用方法
通常、成人にはシタグリプチンとして50mgを1日1回経口投与します。
なお、効果不十分な場合には、経過を十分に観察しながら100mg1日1回まで増量することができます。
<用法及び用量に関連する使用上の注意>
本剤は主に腎臓で排泄されるため、腎機能障害のある患者では、下表を目安に用量調節してください。
| 腎機能障害 | クレアチニンクリアランス (mL/min) 血清クレアチニン値(mg/dL)* | 通常投与量 | 最大投与量 |
| 中等度 | 30 ≦ CrCl < 50 男性: 1.5 < Cr ≦ 2.5 女性: 1.3 < Cr ≦ 2.0 | 25mg 1日1回 | 50mg 1日1回 |
| 重度、末期腎不全 | CrCl < 30 男性: Cr > 2.5 女性: Cr > 2.0 | 12.5mg 1日1回 | 25mg 1日1回 |
*クレアチニンクリアランスに概ね相当する値
末期腎不全患者については、血液透析との時間関係は問いません。
<引用>
電子添文
高齢者では腎機能が低下していることが多いため、腎機能に注意し、腎機能障害がある場合には適切な用量調節を行ってください。
<引用>
電子添文
本剤の電子添文には以下のとおり記載されています。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与を考慮すること。動物実験(ラット)において、1,000mg/kg/日(臨床での最大投与量100mg/日の約100倍の曝露量に相当する)経口投与により、胎児肋骨の欠損、形成不全及び波状肋骨の発現率の軽度増加が認められたとの報告がある。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている。
小児等に対する安全性は確立していません。〔臨床試験は実施していません。〕
<引用>
電子添文
他剤との対応量を比較検討した報告はありません。
患者の臨床的背景により異なりますので、他剤からの切り替えの際は、電子添文記載の【用法及び用量】に従って投与してください。
健康成人に12.5~100mgを単回投与した際の半減期は、9.6~12.3時間でした。また、1日1回投与24時間後のDPP-4阻害率は、50mgで92%、100mgで94%でした(1)。
2型糖尿病患者を対象とした国内第Ⅱ相試験において、シタグリプチン100mg1日1回又は50mg1日2回を4週間投与したところ、同程度の血糖降下作用と安全性が示されたため、1日1回投与となりました(2)。
<引用>
(1)片山泰之 他.;新薬と臨床 60(6):1139-1152,2011
(2)インタビューフォーム Ⅴ. 治療に関する項目 5. 臨床成績 (3) 用量反応探索試験
服用時間の規定はありません。
臨床薬理試験の結果から、本剤の薬物動態は食事の影響を受けにくいことから、食事のタイミングに関わらず投与可能です(1)。
電子添文
16.薬物動態
16.2.2. 食事の影響
健康成人に、シタグリプチン50mg を食後に単回経口投与した場合、空腹時に比べてCmaxは37%増加したが、AUC0-∞及びTmaxに差はなかった。
表:健康成人における空腹時及び食後投与時の薬物動態パラメータ
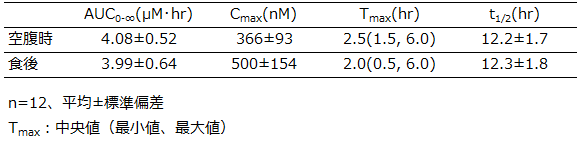
<引用>
(1)インタビューフォーム Ⅴ.治療に関する項目 3.用法及び用量 (2)用法及び用量の設定経緯・根拠
電子添文では、腎機能障害の程度はクレアチニンクリアランス及び血清クレアチニン値で記載しています。
腎機能障害患者のシタグリプチンの薬物動態は、クレアチニンクリアランス別に検討されました(1)。
医師の判断でGFR(eGFR:推算糸球体濾過量、mL/min/1.73m2)を参考にされることは問題ありません弊社ではeGFR(GFR)での目安は規定していません。
<引用>
(1)電子添文
電子添文には、禁忌に設定した理由として、「インスリン注射による血糖管理が望まれるので本剤の投与は適さない」と記載されています(1)。
日本糖尿病学会編・著 糖尿病専門医研修ガイドブックには、以下のように記載されています(2)。
(感染症)
感染症の発症に伴いのコントロールは悪化し、時にケトアシドーシスの原因となる。糖尿病のコントロールは感染症の予後にかかわるため、インスリンを中心とした厳格な血糖コントロールを行う必要がある。
(手術)
血糖値は、麻酔や感染症の合併、食事摂取量の変化、消化器症状などにより変動しやすい。術前からの周到な準備と周術期におけるこまやかな血糖コントロールが不可欠である。術前より、手術の大小、糖尿病の病型に関わらずインスリンを中心とした血糖コントロールへの切り換えが原則である。
<引用>
(1)電子添文
(2)日本糖尿病学会(編・著) 糖尿病専門医研修ガイドブック改訂第9版,2023.p.376、436-437.
【適応外】
本剤を粉砕して投与することは、承認外の用法となります。
粉砕して投与した際の薬物動態、有効性、安全性は検討していませんので、おすすめしていません。
【適応外】
本剤を簡易懸濁して投与することは、承認外の用法となります。
簡易懸濁して投与した際の薬物動態、有効性、安全性は検討していませんので、おすすめしていません。
本剤を分包または他剤と一包化した際の安定性について検討していませんので、おすすめしていません。
安全性
重大な副作用として、アナフィラキシー反応*、皮膚粘膜眼症候群(Stevens-Johnson症候群)*、剥脱性皮膚炎*、低血糖(4.2%)、肝機能障害*、黄疸*、急性腎障害*、急性膵炎*、間質性肺炎*、腸閉塞*、横紋筋融解症*、血小板減少*、類天疱瘡*が報告されています。
*頻度不明
その他の副作用(発現頻度0.1~2%未満)として、浮動性めまい、感覚鈍麻、糖尿病網膜症の悪化、回転性めまい、上室性期外収縮、心室性期外収縮、動悸、鼻咽頭炎、腹部不快感(胃不快感を含む)、腹部膨満、腹痛、上腹部痛、悪心、便秘、下痢、鼓腸、胃ポリープ、胃炎、萎縮性胃炎、びらん性胃炎、歯周炎、胃食道逆流性疾患、口内炎、肝機能異常、発疹、湿疹、冷汗、多汗症、空腹、浮腫、倦怠感、心電図T波振幅減少、体重増加、赤血球数減少、ヘモグロビン減少、ヘマトクリット減少、白血球数増加、ALT増加、AST増加、γ- GTP増加、血中ビリルビン増加、血中LDH増加、CK増加、血中コレステロール増加、血中尿酸増加、血中尿素増加、血中クレアチニン増加、血中ブドウ糖減少、低比重リポ蛋白増加、血中トリグリセリド増加、尿中蛋白陽性が報告されています。
安全性情報については電子添文の副作用及び臨床成績の安全性の結果をご参照ください。
<引用>
電子添文