製品基本Q&A キュビシン®
製品基本Q&A
キュビシン®
製品情報
本剤の電子添文には、以下のとおり記載されています。
4. 効能又は効果
〈適応菌種〉
ダプトマイシンに感性のメチシリン耐性黄色ブドウ球菌(MRSA)
〈適応症〉
敗血症、感染性心内膜炎、深在性皮膚感染症、外傷・熱傷及び手術創等の二次感染、びらん・潰瘍の二次感染
5. 効能又は効果に関連する注意
〈効能共通〉
5.1 本剤の使用にあたっては、耐性菌の出現等を防ぐため、原則として他の抗菌薬及びダプトマイシンに対する感受性を確認すること。[18.2参照]
5.2 本剤は肺炎に使用しないこと。本剤は肺サーファクタントに結合し、不活性化される。
〈感染性心内膜炎〉
5.3 成人の右心系感染性心内膜炎にのみ使用すること。左心系感染性心内膜炎に対して、国内での使用経験はなく、海外でも有効性は認められていない。また、小児の感染性心内膜炎に対する有効性及び安全性は確認されていない。
<引用>
電子添文
ダプトマイシンは菌の細胞膜と結合し、速やかに膜電位を脱分極させます。また、ダプトマイシンにより、DNA、RNA 及び蛋白質の合成阻害が生じることが示されています。これら膜電位の消失、並びにDNA、RNA 及び蛋白質の合成阻害により細菌が死滅します。
<引用>
電子添文
使用方法
本剤の電子添文には、以下のとおり記載されています。
6.用法及び用量
〈成人〉
敗血症、感染性心内膜炎
通常、成人にはダプトマイシンとして1日1回6 mg/kgを24時間ごとに30分かけて点滴静注又は緩徐に静脈内注射する。
深在性皮膚感染症、外傷・熱傷及び手術創等の二次感染、びらん・潰瘍の二次感染
通常、成人にはダプトマイシンとして1日1回4 mg/kgを24時間ごとに30分かけて点滴静注又は緩徐に静脈内注射する。
〈小児〉
敗血症
通常、ダプトマイシンとして以下の用法及び用量に従い投与する。
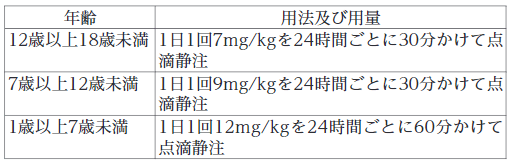
深在性皮膚感染症、外傷・熱傷及び手術創等の二次感染、びらん・潰瘍の二次感染
通常、ダプトマイシンとして以下の用法及び用量に従い投与する。
7. 用法及び用量に関連する注意
7.1 ダプトマイシンは主に腎臓で排泄されるため、血液透析又は連続携行式腹膜透析(CAPD)を受けている患者を含む腎機能障害の成人患者では、下表を目安に本剤の投与間隔を調節すること。小児の腎機能障害患者に対する検討は行われていない。[9.2.1、9.2.2、16.6.1参照]
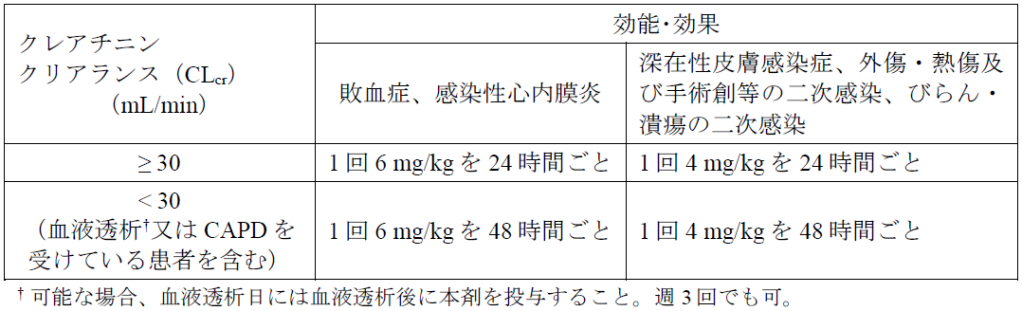
7.2 本剤は、1日2回以上投与しないこと。海外第Ⅰ相及び第Ⅱ相試験において1日2回以上投与した場合、血中CK値が上昇した。
7.3 グラム陰性菌等を含む混合感染と診断された場合、又は混合感染が疑われる場合は本剤と適切な薬剤を併用して治療を行うこと。ダプトマイシンはグラム陽性菌に対してのみ抗菌活性を有する。
<引用>
電子添文
本剤の電子添文には、以下のとおり記載されています。
9.8 高齢者
一般的に生理機能が低下している。CLcr ≥ 30mL/minの高齢者では用量調節は必要ない。
<引用>
電子添文
本剤の電子添文には、以下のとおり記載されています。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
妊娠ラットにおいて、ダプトマイシンは胎盤を通過することが認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中へダプトマイシンが低濃度(0.045μg/mL、乳汁中濃度/血漿中濃度比:0.12%)で移行することが報告された。
<引用>
電子添文
本剤の電子添文には、以下のとおり記載されています。
6.用法及び用量
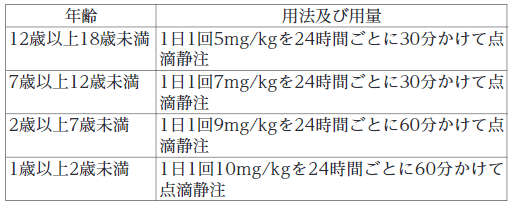
〈小児〉
敗血症
通常、ダプトマイシンとして以下の用法及び用量に従い投与する。

深在性皮膚感染症、外傷・熱傷及び手術創等の二次感染、びらん・潰瘍の二次感染
通常、ダプトマイシンとして以下の用法及び用量に従い投与する。

9. 特定の背景を有する患者に関する注意
9.7 小児等
1歳未満の小児患者への投与は推奨されない。1歳未満の小児患者を対象とした有効性及び安全性を指標とした臨床試験は実施していない。1歳未満の小児に相当する日齢の新生児イヌを用いた試験では、1歳未満の小児において予想される血中濃度の範囲内で回復性のある筋攣縮及び筋硬直がみられた。[15.2 参照]
<引用>
電子添文
本剤の電子添文には、以下のとおり記載されています。
13. 過量投与
13.1 処置
本剤は、血液透析(4時間で投与量の約15%除去)又は腹膜透析(48時間で約11%除去)により体内から緩やかに除去される。
<引用>
電子添文
血液透析(HD)及び持続腹膜透析(CAPD)実施中の外国人末期腎不全患者(HD:7例、CAPD:9例)を対象に、週3回透析後(48時間-48時間-72時間)キュビシン®6mg/kgを反復静脈内投与し、投与1日目及び投与5日目の薬物動態がほぼ同程度であったことから、48時間投与の妥当性が確認されました。
肥満患者にキュビシン®を投与する際に投与量を補正(調整)する必要はないと考えています。肥満被験者でのキュビシン®の薬物動態パラメータ(Cmax及びAUC)は、非肥満被験者と比べて増加しました。しかしながら、増加の程度は臨床的に問題となるとは考えがたく、肥満患者にキュビシン®を投与する際に用量調整の必要はないと考えます(1)。
キュビシン®の開発治験はすべて、患者の実体重に基づき投与量を決定しました。
<引用>
(1)申請資料概要(2011年07月01日) 2.5 臨床に関する概括評価 2.5.3 臨床薬理に関する概括評価 2.5.3.3 薬物動態における内因性因子 p.27
〈成人〉
電子添文上、特に規定はありません。
臨床薬理試験での投与時間(10秒間)及び静脈内注射可能な他の抗菌薬の用法・用量を考慮して、「緩徐に静脈内注射する」と記載し、PMDAより承認されました(1)。
〈小児〉
小児における承認された用法は、年齢に応じて30分又は60分かけて点滴静注です。
静脈内注射(ボーラス投与)は行わないでください。
成人において、国内及び海外での臨床試験では点滴時間が30分で実施されており、それ以外の点滴時間での検討データはありません。
濃度依存的薬剤とされていますので、点滴時間が長くなり、Cmaxが下がれば理論上、効果が下がる可能性が考えられます。
電子添文上、CLcr、効能・効果に応じて投与量、投与時間の調整が規定されています。
成人においては、年齢ではなく腎機能のCLcrが30mL/min以上か30mL/min未満かで投与量調節の判断をしてください。
安全性
成人を対象とした国内試験(001試験及び002試験)及び小児(1歳以上18歳未満)を対象とした国内試験(029試験)を併合して算出した「1%以上の副作用」として、下痢、湿疹、発熱、肝機能検査異常(AST上昇、ALT上昇、Al-P上昇)、血小板数減少、CK上昇、好酸球数増加が報告されています。
重大な副作用として、ショック、アナフィラキシー、急性汎発性発疹性膿疱症、横紋筋融解症、好酸球性肺炎、末梢性ニューロパチー、腎不全、偽膜性大腸炎が報告されています。
<引用>
インタビューフォーム Ⅰ.概要に関する項目
その他
本剤の電子添文には、以下のとおり記載されています。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤1バイアルにつき7mLの生理食塩液をゆっくりと加えて溶解し、50mg/mLの溶液とする。なお、泡立ちを抑えるため、溶解時又は溶解後のバイアルは激しく振とうせずに、以下の手順に従って調製する。
・ゴム栓の中央部に針を刺す。
・生理食塩液7mLをバイアルの内壁をつたわらせながらゆっくりと注入する。
・バイアルをゆっくりと回しながら塊又は粉末を十分に湿らせる。
・溶解するまで約10分間静置する。
・数分間ゆっくりとバイアルを回す。
・完全に溶解したことを確認する。
14.1.2 成人に静脈内注射する場合、14.1.1の溶液をそのまま使用する。
14.1.3 点滴静注する場合、14.1.1の溶液をさらに生理食塩液で希釈し使用する。
14.1.4 調製後は速やかに使用すること。なお、やむを得ず保存を必要とする場合でも、調製開始後、室温(25℃)では12時間以内、冷所(2~8℃)では48時間以内に使用すること。
14.2 薬剤投与前の注意
不溶物がないことを目視で確認すること。
14.3 薬剤投与時の注意
小児には、年齢に応じて30分又は60分かけて点滴静注し、静脈内注射しないこと。
14.4 配合適性
14.4.1 本剤は生理食塩液及び乳酸リンゲル液とは配合可能である。
14.4.2 ブドウ糖を含む希釈液とは配合不適である。
14.4.3 配合適性については限られたデータしかないため、他の薬剤を同一の輸液ラインを通して同時に注入しないこと。他の薬剤を同一の輸液ラインから連続注入する場合には、配合変化を起こさない輸液(生理食塩液又は乳酸リンゲル液)を本剤の投与前後に輸液ライン内に流すこと。
<引用>
電子添文
貯法は、2~8℃です。
<引用>
電子添文
7mLでの溶解をおすすめします(*)。
社内での溶解時のデータは7mLで行われており、他の容量で溶解したデータはありません。
<生食キットでの溶解>
生食キットに連結して溶解した場合のデータはありません。
注射針付き生食キットでは、キュビシン®の調製方法である「本剤1バイアルにつき7mLの生食をゆっくり加えて溶解し、10分静置する。」ことはできないと考えられます。
(*)キュビシン®静注用350mg 1バイアルにつき7mLの生理食塩液をゆっくりと加えて溶解し、50mg/mLの溶液とするよう、電子添文「14.1 薬剤調製時の注意」に記載しています。
電子添文上、特に制限はありません。
点滴静注のための希釈は、成人の場合は30分、小児においては年齢に応じて30分又は60分で点滴できる容量で希釈してください。
なお、成人においては「緩徐に静脈内投与」の投与法も認められています。
泡が残っているままの状態では、正確な用量を投与できない可能性があります。泡が消えるまでしばらく静置してください。点滴用のボトルなどに注入する場合も、泡立ちを防ぐため激しく振とうしないでください。