KEYNOTE-868試験
子宮体癌:国際共同臨床試験成績
国際共同第Ⅲ相試験<NRG-GY018/KEYNOTE-868試験>
承認時評価資料: 国際共同第Ⅲ相試験(NRG-GY018/KEYNOTE-868試験)
試験概要
【目的】
化学療法歴のない(術後補助療法を除く)進行・再発の子宮体癌患者を対象に、キイトルーダ®と化学療法との併用療法及びその後のキイトルーダ®継続投与の有効性及び安全性を検討する。
【デザイン】
無作為化二重盲検プラセボ対照国際共同第Ⅲ相試験 [優越性試験]
〔中間解析結果(データカットオフ日:2022年12月6日[pMMR集団]、2022年12月16日[dMMR集団])〕
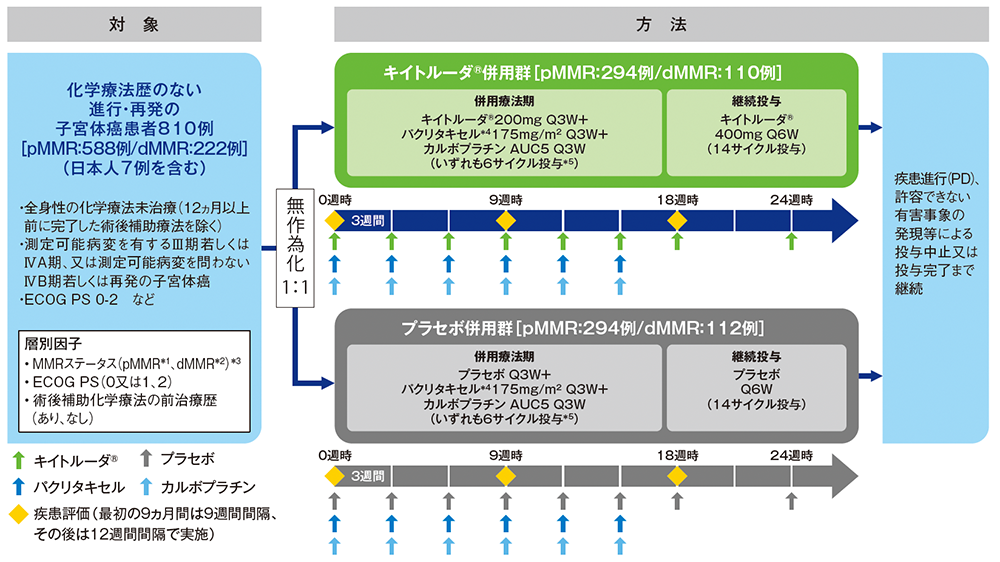
【対象】
化学療法歴のない(術後補助療法を除く)進行・再発の子宮体癌患者810例(日本人7例を含む)
なお、MMRステータス別の患者数はpMMR集団が588例、dMMR集団が222例であった。
【方法】
対象をキイトルーダ®併用群又はプラセボ併用群のいずれかに1:1の割合で無作為に割り付けた。本試験はキイトルーダ®又はプラセボと化学療法を併用する併用療法期と、その後にキイトルーダ®又はプラセボを継続投与する2つの投与期で構成される。キイトルーダ®併用群では、併用療法期としてキイトルーダ®200mg、パクリタキセル*4175mg/m2及びカルボプラチンAUC5に相当する量を、3週間間隔[Q3W]で点滴静注により6サイクル*5投与し、その後にキイトルーダ®400mgを6週間間隔[Q6W]で14サイクル継続投与した。プラセボ併用群では、キイトルーダ®の代わりにプラセボを投与した。画像診断を、最初の9ヵ月間は9週間間隔、その後は12週間間隔で実施し、疾患進行(PD)、許容できない有害事象の発現等による投与中止又は投与完了まで継続した。
【評価項目】
主要評価項目:無増悪生存期間(progression free survival: PFS)※
副次評価項目:全生存期間(overall survival: OS)、奏効率(overall response rate: ORR)、奏効期間(duration of response: DOR)、安全性など
※検証的解析項目
【判定基準】
PFSは治験担当医師がRECISTガイドライン1.1版に基づき評価した。ORR、DORは中央画像判定機関又は治験担当医師がRECISTガイドライン1.1版に基づき評価した。
【解析計画】
解析対象集団:有効性はITT集団*6、ORR、DORはITT集団のうち、組み入れ時に測定可能病変を有する集団、安全性はAPaT集団*7を解析対象とした。
有効性評価の統計手法:PFSはKaplan-Meier法を用いて生存曲線を推定した。PFSの群間比較は層別ログランク検定を用いて評価し、投与群を共変量とした層別Cox比例ハザードモデルを用いて、ハザード比及びその95%信頼区間(CI)を算出した。層別ログランク検定及び層別Cox比例ハザードモデルの層別因子には術後補助化学療法の前治療歴(あり、なし)を用いた。OSは、中間解析時点では多重性を調整した正式な検定は計画していなかった。ORRの群間比較には層別Miettinen and Nurminen法を用いた。DORはKaplan-Meier法を用いて生存曲線を推定した。PFS、OS、ORR、DORの解析はMMRステータスに基づき、pMMR又はdMMRの集団別に評価した。
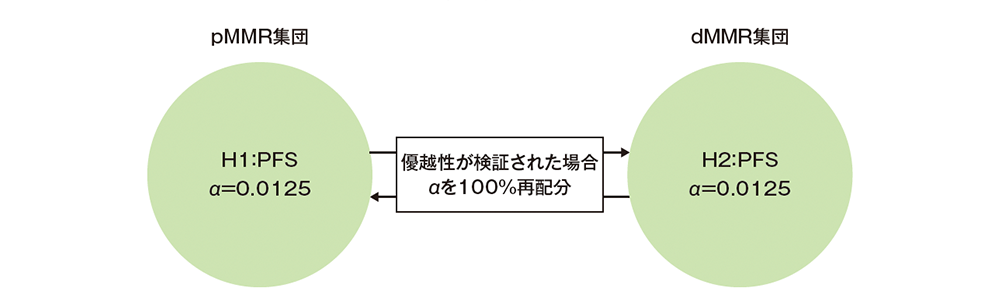
多重性の調整:本試験では有効性の1回の中間解析を事前に計画し、試験全体の第一種の過誤の確率を有意水準片側2.5%となるように厳密に制御した。PFSの解析では、各MMR集団に対してLan-DeMetsによるO’Brien-Fleming型の消費関数による境界値を用いた。中間解析は両MMR集団の登録が完了し、各MMR集団でPFSの目標イベント数の50%以上の情報量が観察された時点で実施することとした。本試験では2つの仮説(H1:pMMR集団のPFS、H2:dMMR集団のPFS)を設定し、多重性の調整は、Maurer and Bretzのgraphical approachを用いた。最初にH1、H2にそれぞれ有意水準片側1.25%を割り当て、一方のMMR集団の帰無仮説が棄却された場合もう一方のMMR集団に再配分できることとした。両方の仮説を同時に検定する場合、H2を最初に検定し、H2が統計学的に有意であった場合、有意水準片側1.25%をH1に再配分する。それ以外の場合では、PFSの目標イベント数の50%以上の情報量が先に観察されたMMR集団から先に検定を実施することとした。
多重性の調整
*1 pMMR(mismatch repair proficient):ミスマッチ修復機構を有する
*2 dMMR(mismatch repair deficient):ミスマッチ修復機構欠損を有する
*3 中央検査機関又は治験実施医療機関のMMRに対する免疫組織化学(IHC)検査結果に基づき患者を割り付けた。ただし、無作為割り付けされた患者のMMRステータスについて、中央検査機関の確認を必須とした
*4 過敏症反応のためパクリタキセルの継続ができない患者に対しては、ドセタキセル(日本では60-70mg/m2)の投与が可能とされた。プロトコールではアルブミン懸濁型パクリタキセルへの変更も可能であったが、アルブミン懸濁型パクリタキセルの子宮体癌への投与は国内未承認である
※アルブミン懸濁型パクリタキセルの効能又は効果は以下のとおりである
4.効能又は効果
〇乳癌、の先頭を効能の効に合わせる ○乳癌 ○胃癌 ○非小細胞肺癌 ○治癒切除不能な膵癌
*5 安定(SD)又は部分奏効(PR)が認められ、サイクル6終了時点で測定可能病変が残存していた患者は併用療法期の投与を最大サイクル10まで継続できるものとした(治験担当医師が必要と判断した場合)。サイクル7-10を継続した患者は、サイクル1-6と同様にすべての評価を継続した
*6 ITT(intention to treat)集団:無作為化されたすべての患者
*7 APaT(all participants as treated)集団:無作為化され治験薬を1回以上投与されたすべての患者
pMMR集団の患者背景(ITT集団)
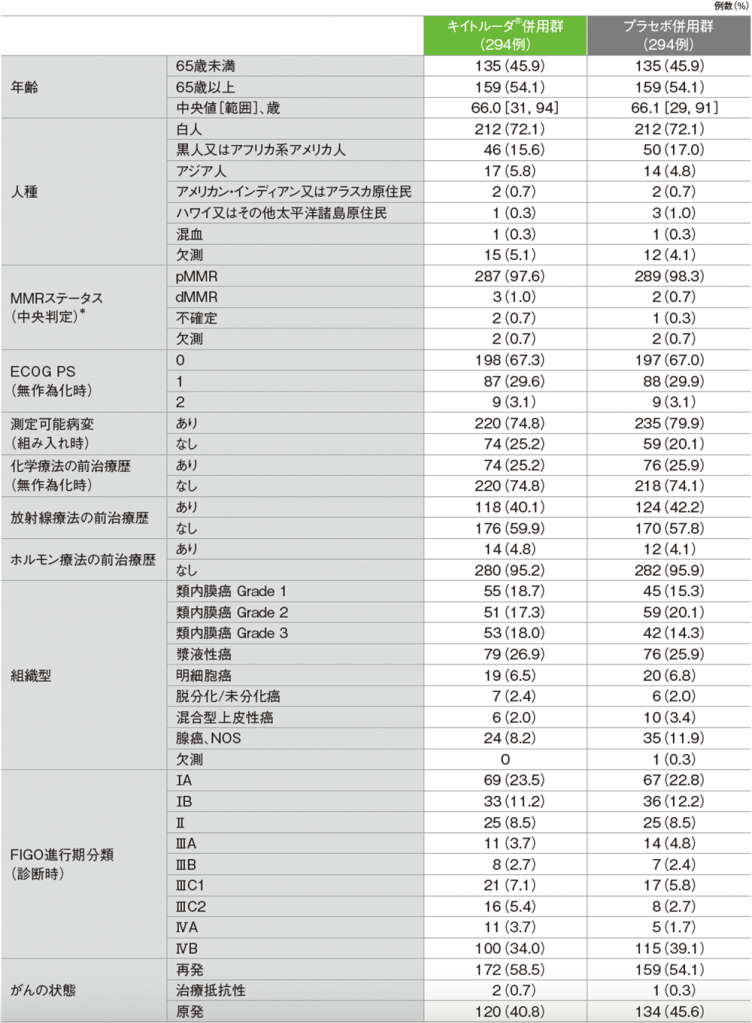
NOS:Not Otherwise Specified(他に分類されない)
*中央検査機関又は治験実施医療機関のMMRに対する免疫組織化学(IHC)検査結果に基づき患者を割り付けた。ただし、無作為割り付けされた患者のMMRステータスについて、中央検査機関の確認を必須とした
主要評価項目:pMMR集団における無増悪生存期間(PFS)[検証的解析結果]

キイトルーダ®併用群では、プラセボ併用群と比較して、PFSの有意な延長が認められ(p<0.0001、層別ログランク検定[片側]、有意水準α=0.001162、検証的解析結果)、ハザード比は0.57(95%CI: 0.44, 0.74)でした。PFS中央値は、キイトルーダ®併用群で13.1ヵ月(95%CI: 10.6, 19.5)、プラセボ併用群で8.7ヵ月(95%CI: 8.4, 11.0)でした。12ヵ月時点の無増悪生存率はキイトルーダ®併用群で52.0%(95%CI: 43.8, 59.5)、プラセボ併用群で29.5%(95%CI: 22.4, 37.0)でした。24ヵ月時点では、それぞれ38.3%(95%CI: 28.8, 47.7)、13.5%(95%CI: 6.9, 22.2)でした。
■pMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)


治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Cox比例ハザードモデルに基づく
*3 術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別ログランク検定[片側]、有意水準α=0.001162(検証的解析結果)
(データカットオフ日:2022年12月6日[pMMR集団])
副次評価項目:pMMR集団における全生存期間(OS)

■pMMR集団におけるOSのKaplan-Meier曲線(ITT集団)

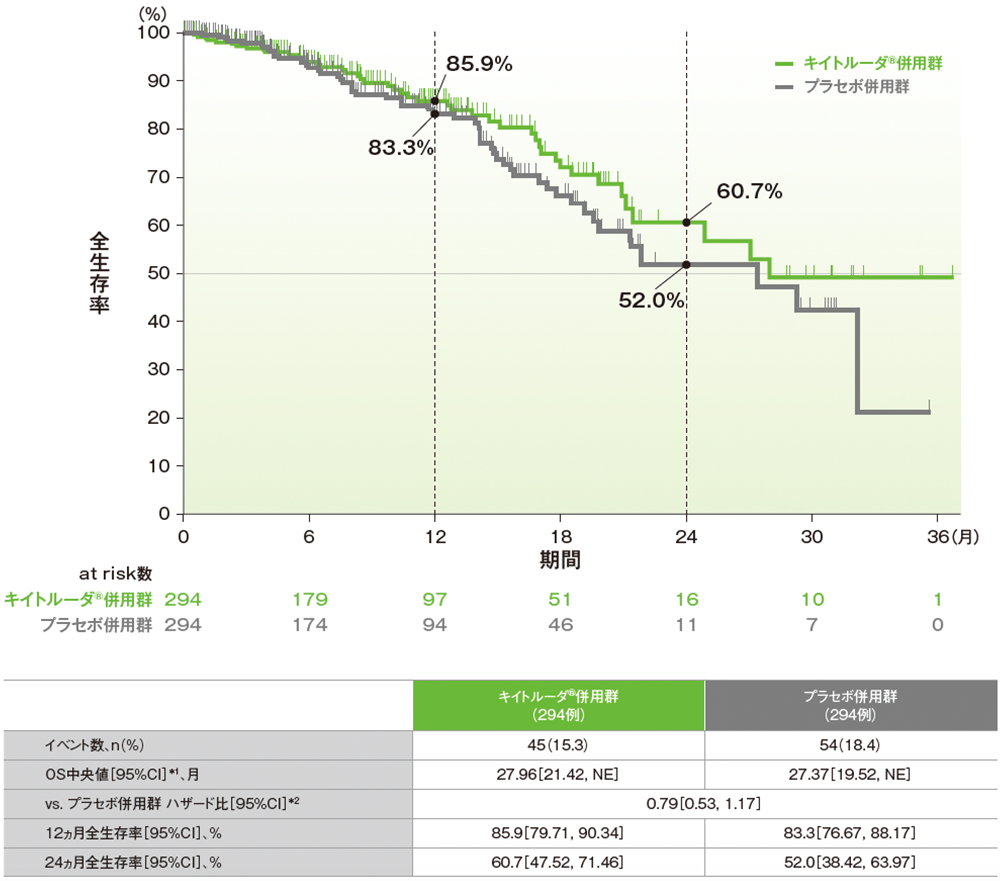
NE:Not Estimated
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Cox比例ハザードモデルに基づく
(データカットオフ日:2022年12月6日[pMMR集団])
副次評価項目:pMMR集団における奏効率(ORR)

■pMMR集団におけるORR(ITT集団のうち、組み入れ時に測定可能病変を有する集団)

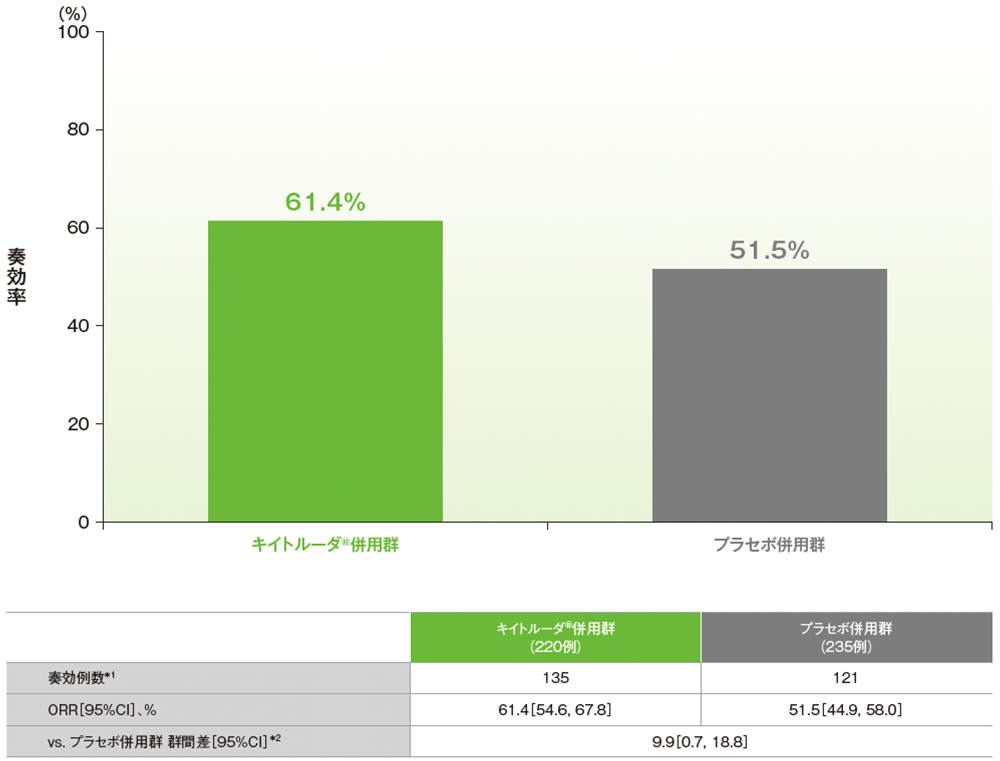
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 CR又はPRが認められた患者数
*2 術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Miettinen and Nurminen法に基づく
(データカットオフ日:2022年12月6日[pMMR集団])
副次評価項目:pMMR集団における奏効期間(DOR)

■pMMR集団で奏効が認められた患者におけるDORのKaplan-Meier曲線(ITT集団のうち、組み入れ時に測定可能病変を有する集団)

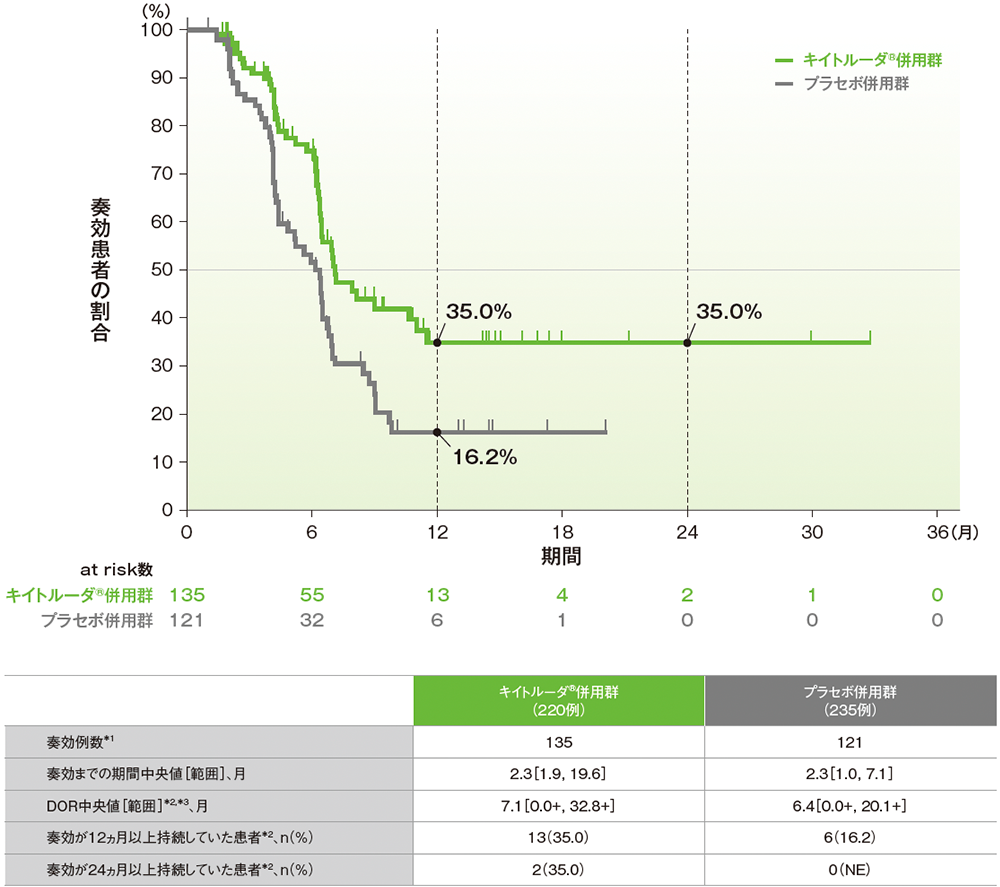
治験担当医師によるRECISTガイドライン1.1版に基づく評価
NE:Not Estimated
*1 CR又はPRが認められた患者数
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 「+」は最後の疾患評価までPDがみられなかったことを示す
(データカットオフ日:2022年12月6日[pMMR集団])
dMMR集団の患者背景(ITT集団)
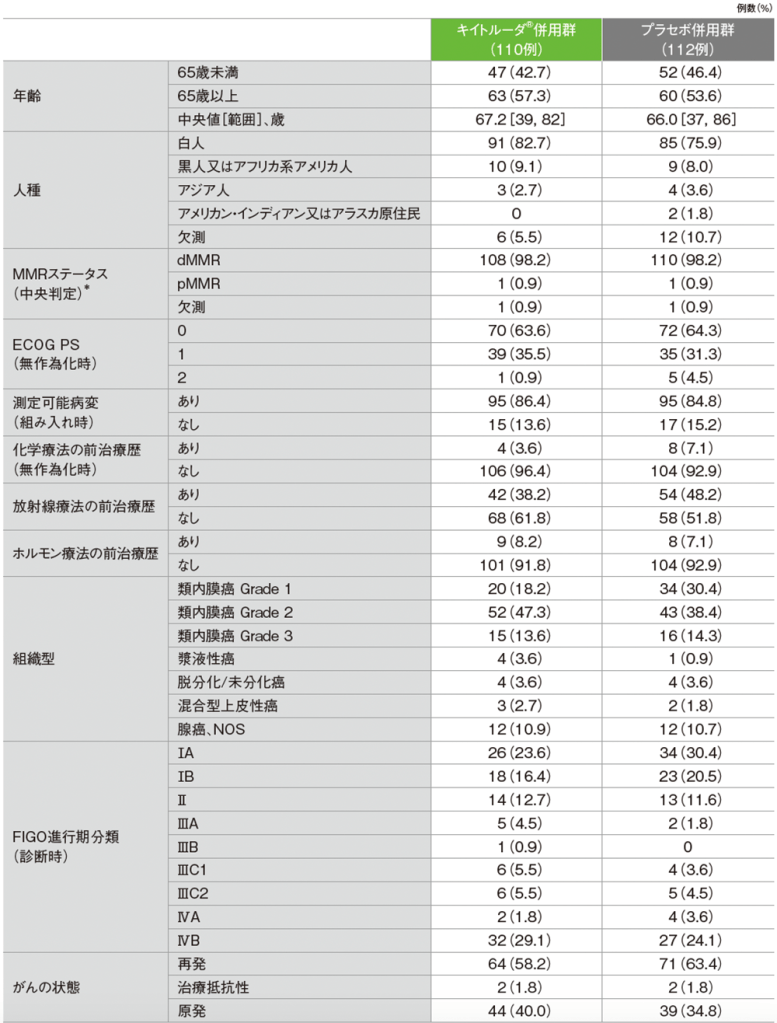
NOS:Not Otherwise Specified(他に分類されない)
*中央検査機関又は治験実施医療機関のMMRに対する免疫組織化学(IHC)検査結果に基づき患者を割り付けた。ただし、無作為割り付けされた患者のMMRステータスについて、中央検査機関の確認を必須とした
主要評価項目:dMMR集団における無増悪生存期間(PFS)[検証的解析結果]

キイトルーダ®併用群では、プラセボ併用群と比較して、PFSの有意な延長が認められ(p<0.0001、層別ログランク検定[片側]、有意水準α=0.002074、検証的解析結果)、ハザード比は0.34(95%CI: 0.22, 0.53)でした。PFS中央値は、キイトルーダ®併用群で未到達(95%CI: 30.7, NE)、プラセボ併用群で8.3ヵ月(95%CI: 6.5, 12.3)でした。12ヵ月時点の無増悪生存率はキイトルーダ®併用群で73.0%(95%CI: 62.0, 81.3)、プラセボ併用群で40.0%(95%CI: 29.3, 50.4)でした。24ヵ月時点では、それぞれ65.2%(95%CI: 52.7, 75.2)、27.4%(95%CI: 15.2, 41.1)でした。
■dMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)

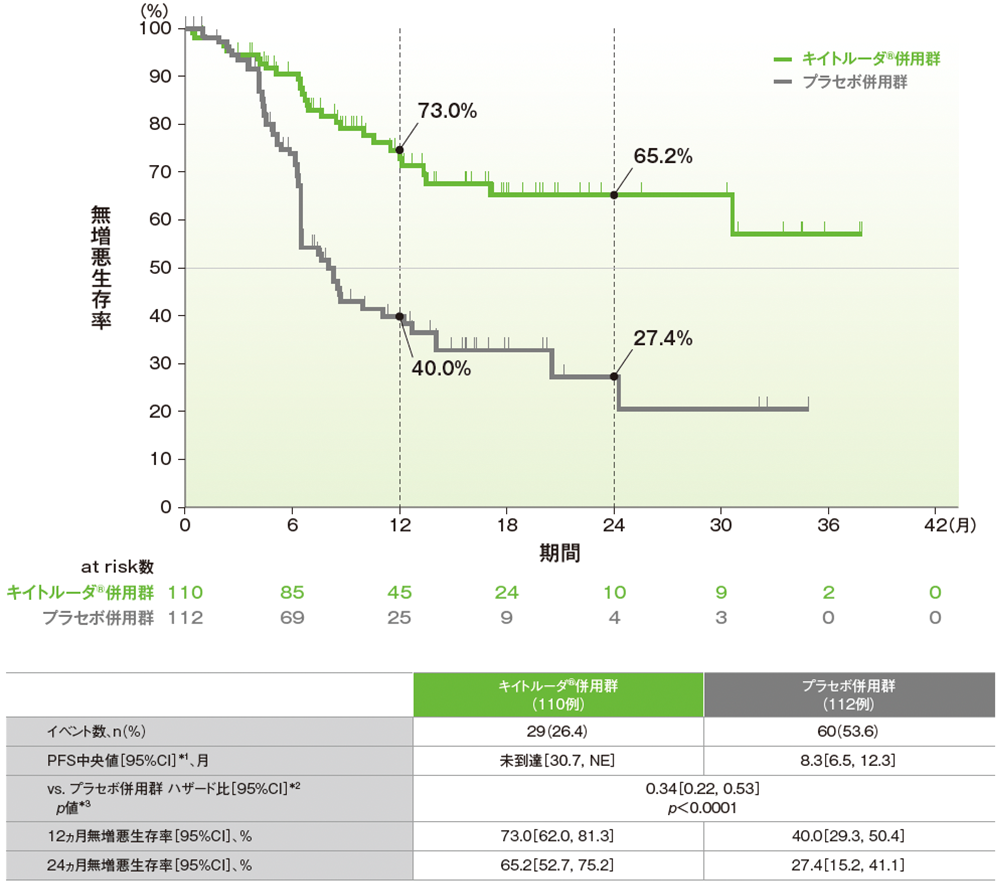
治験担当医師によるRECISTガイドライン1.1版に基づく評価
NE:Not Estimated
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Cox比例ハザードモデルに基づく
*3 術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別ログランク検定[片側]、有意水準α=0.002074(検証的解析結果)
(データカットオフ日:2022年12月16日[dMMR集団])
副次評価項目:dMMR集団における全生存期間(OS)

■dMMR集団におけるOSのKaplan-Meier曲線(ITT集団)

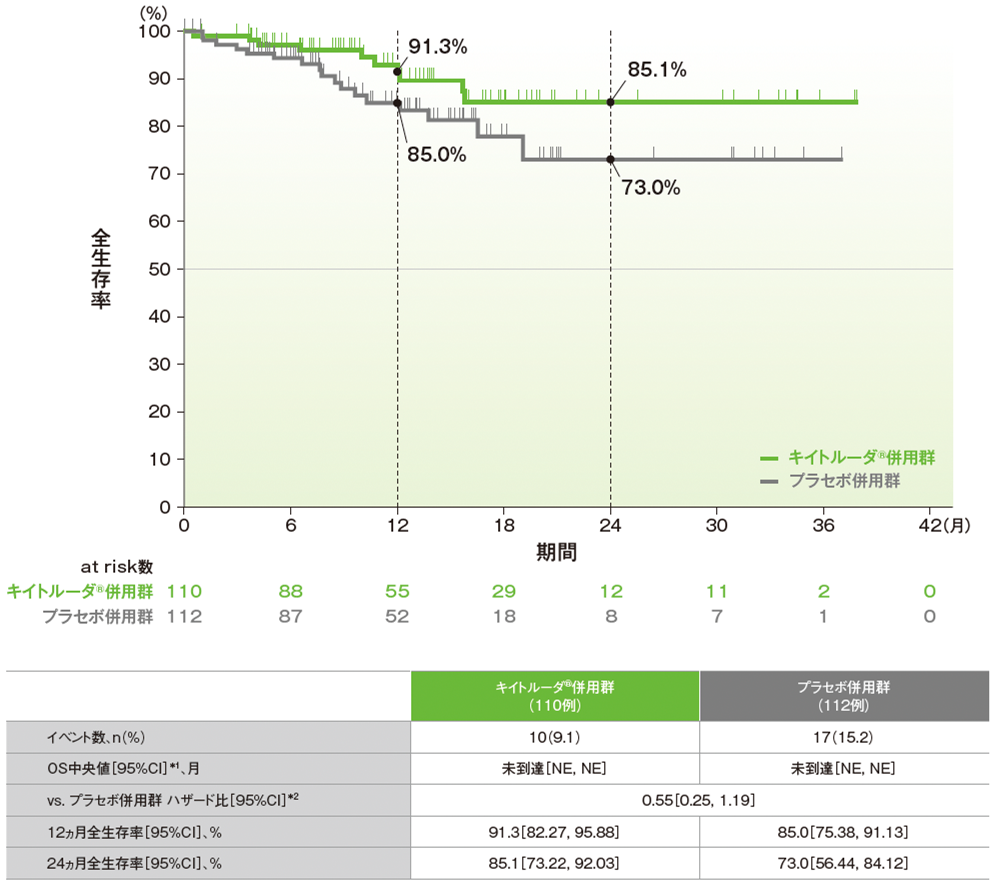
NE:Not Estimated
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Cox比例ハザードモデルに基づく
(データカットオフ日:2022年12月16日[dMMR集団])
副次評価項目:dMMR集団における奏効率(ORR)

■dMMR集団におけるORR(ITT集団のうち、組み入れ時に測定可能病変を有する集団)

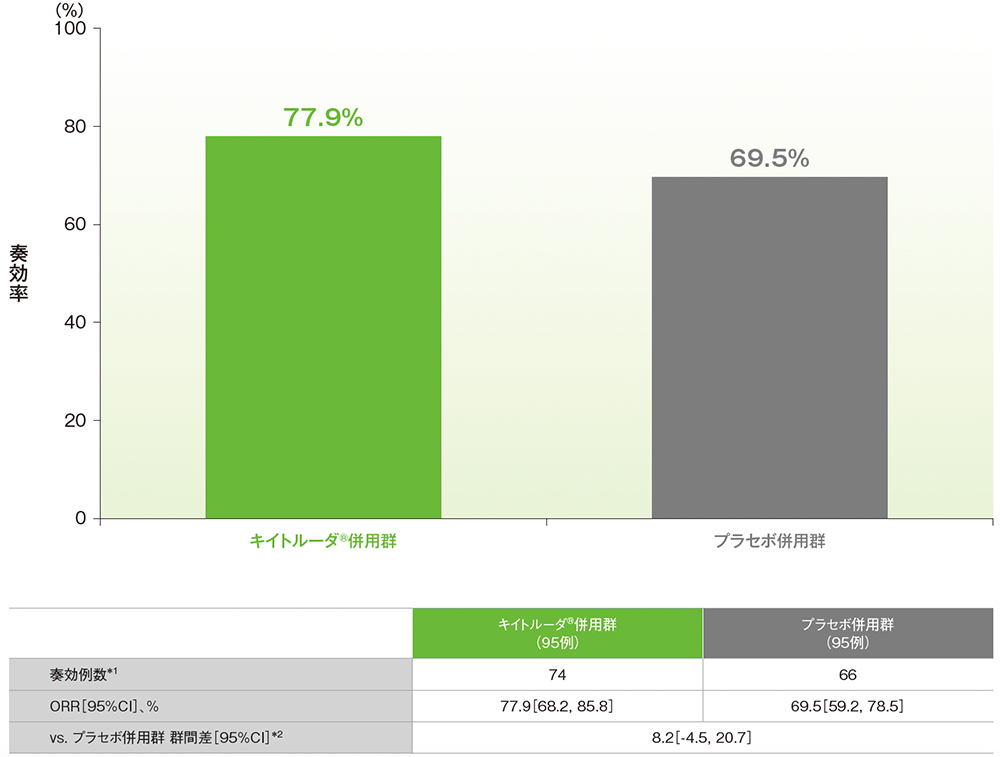
治験担当医師によるRECISTガイドライン1.1版に基づいた評価
*1 CR又はPRが認められた患者数
*2 術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Miettinen and Nurminen法に基づく
(データカットオフ日:2022年12月16日[dMMR集団])
副次評価項目:dMMR集団における奏効期間(DOR)

■dMMR集団で奏効が認められた患者におけるDORのKaplan-Meier曲線(ITT集団のうち、組み入れ時に測定可能病変を有する集団)

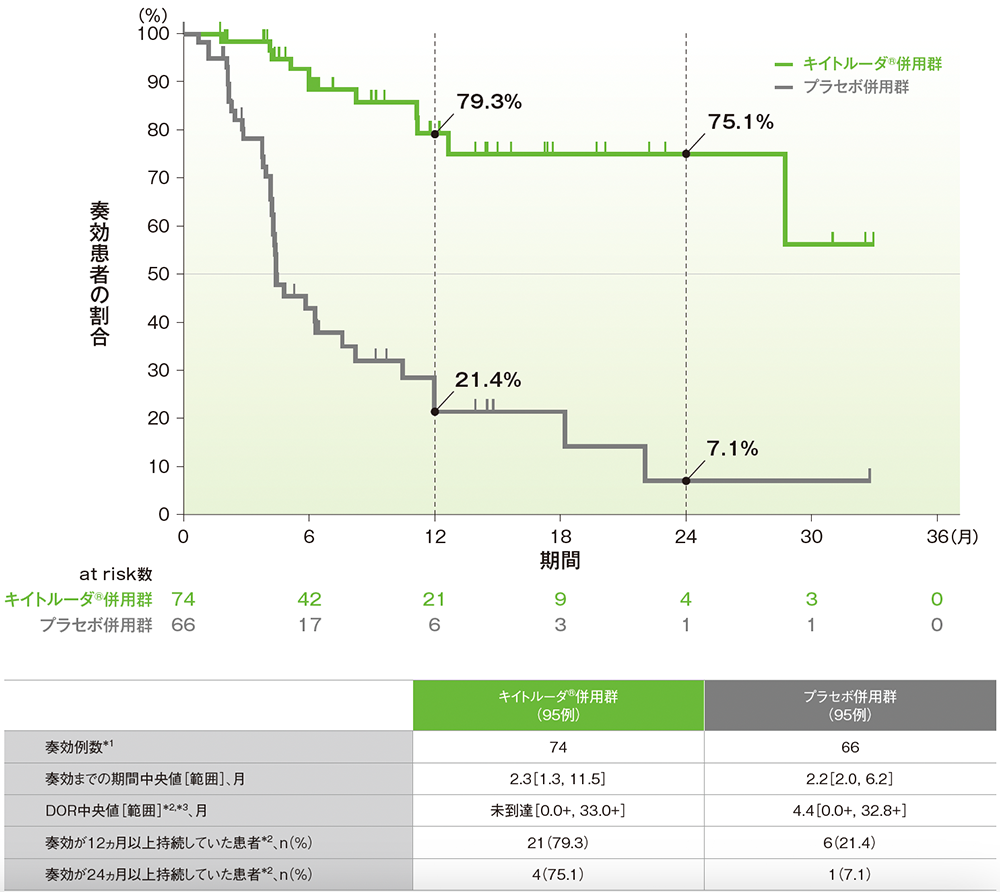
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 CR又はPRが認められた患者数
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 「+」は最後の疾患評価までPDがみられなかったことを示す
(データカットオフ日:2022年12月16日[dMMR集団])
安全性
全体集団における主な副作用(APaT集団)
■キイトルーダ®併用群(382例)
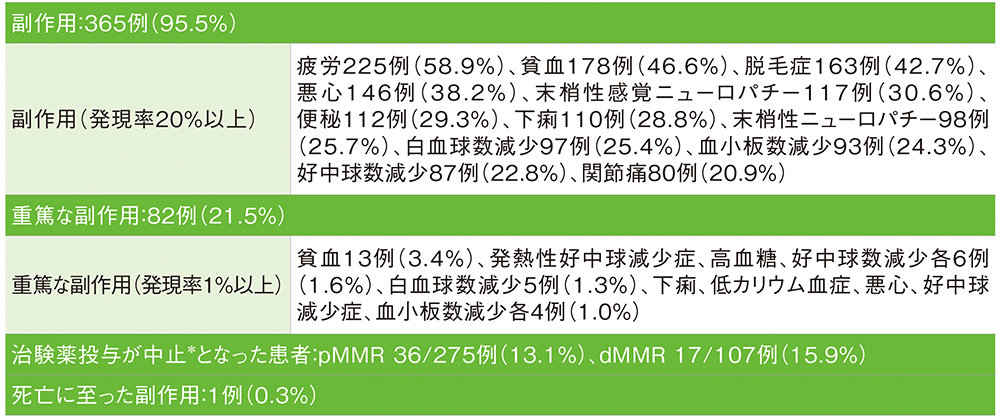
MedDRA/J v26.0(データカットオフ日:2022年12月6日[pMMR集団]、2022年12月16日[dMMR集団])
■プラセボ併用群(377例)

MedDRA/J v26.0(データカットオフ日:2022年12月6日[pMMR集団]、2022年12月16日[dMMR集団])
*有害事象/副作用/合併症により投与中止となった患者数
本試験では、治験薬の投与中止に至った有害事象を特定することを規定していなかったため、社内資料に治験薬の投与中止に至った有害事象の割合及び内訳はなし
全体集団における主な副作用(いずれかの投与群で発現率5%以上)(APaT集団)
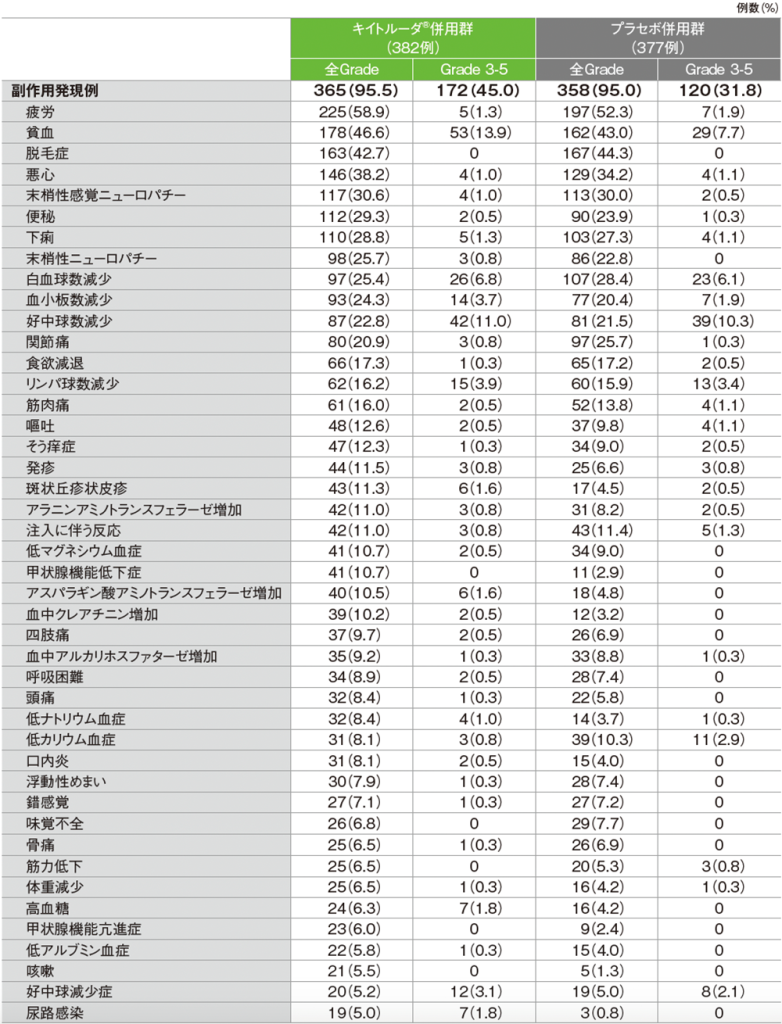
MedDRA/J v26.0、GradeはCTCAE v5.0
(データカットオフ日:2022年12月6日[pMMR集団]、2022年12月16日[dMMR集団])
全体集団における免疫関連など特に注目すべき有害事象(APaT集団)※
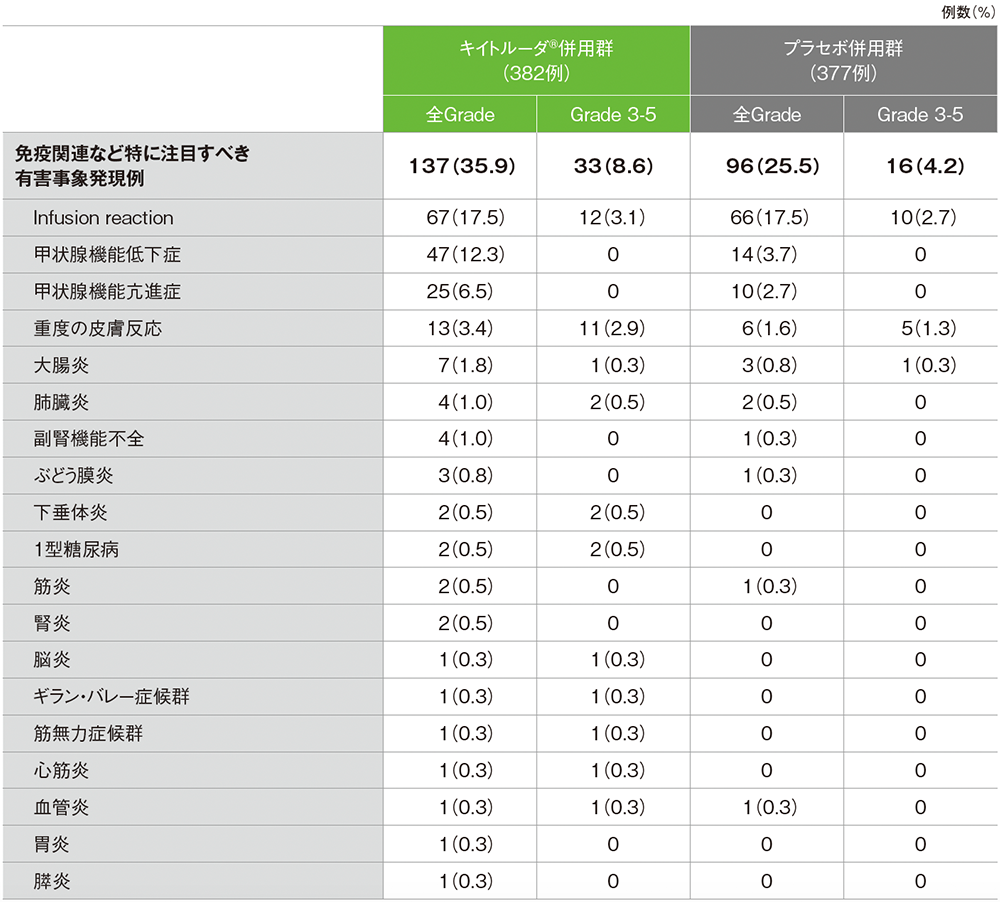
MedDRA/J v26.0、GradeはCTCAE v5.0
(データカットオフ日:2022年12月6日[pMMR集団]、2022年12月16日[dMMR集団])