PIONEER 3:シタグリプチンとの比較検討試験
本邦におけるシタグリプチンの開始用量は通常1日1回50mgであり、効果不十分な場合に1日1回100mgまで増量することができる。本試験では開始用量が1日1回100mgとなっているが、承認時評価資料として評価されたため掲載する。
日本人を含む国際共同第3相臨床試験:PIONEER 3
2型糖尿病患者を対象とした、シタグリプチンとの比較検討試験
社内資料:リベルサス®錠 第3相臨床試験(NN9924-4222)(承認時評価資料)
Rosenstock J et al.:JAMA 321(15):1466-1480, 2019
本試験はノボ ノルディスク社のスポンサーシップにより実施された。
■試験概要

■HbA1cの変化量と推移
HbA1cのベースラインから投与後26週までの変化量のリベルサス®3mg群、7mg群、14mg群とシタグリプチン100mg群のETDはそれぞれ、0.2%(95%CI[ 0.0;0.3]、p=0.0080)、–0.3%(95%CI[–0.4;–0.1]、p<0.0001)、–0.5%(95%CI[–0.6;–0.4]、p<0.0001)であり、リベルサス®7mg及び14mgのシタグリプチン100mgに対する優越性が検証された。一方、リベルサス®3mgのシタグリプチン100mgに対する非劣性は検証されなかった。
ベースラインのHbA1cは、リベルサス®3mg群、7mg群、14mg群でそれぞれ8.3%、8.4%、8.3%、シタグリプチン100mg群で8.3%であった。投与後26週までのHbA1cの変化量はリベルサス®3mg群、7mg群、14mg群でそれぞれ–0.6%、–1.0%、–1.3%、シタグリプチン100mg群で–0.8%であった。
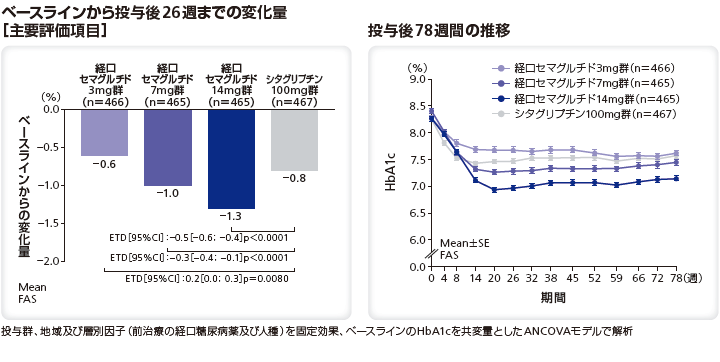
■日本人患者におけるHbA1cの変化量と推移[サブグループ解析]
日本人患者におけるHbA1cのベースラインから投与後26週までの変化量のリベルサス®3mg群、7mg群、14mg群とシタグリプチン100mg群のETDはそれぞれ0.4%(95%CI[0.1;0.7])、–0.1%(95%CI[–0.4;0.2])、–0.5%(95%CI[–0.8;–0.2])であった。
なお、ベースラインのHbA1cは、リベルサス®3mg群、7mg群、14mg群でそれぞれ8.1%、8.3%、8.3%、シタグリプチン100mg群で8.1%であった。投与後26週までのHbA1cの変化量はリベルサス®3mg群、7mg群、14mg群でそれぞれ–0.5%、–1.0%、–1.4%、シタグリプチン100mg群で–0.9%であった。
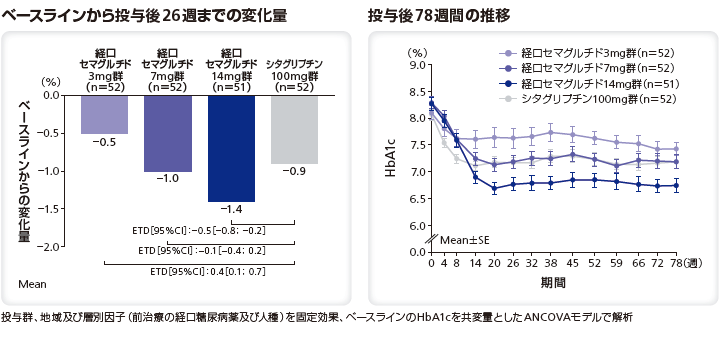
■HbA1c目標達成率
投与後26週にHbA1c目標値(7.0%未満)を達成した患者の割合は、シタグリプチン100mg群と比較してリベルサス®7mg群及び14mg群で有意に高く(共にp<0.0001)、3mg群では有意差はなかった(p=0.0648)。
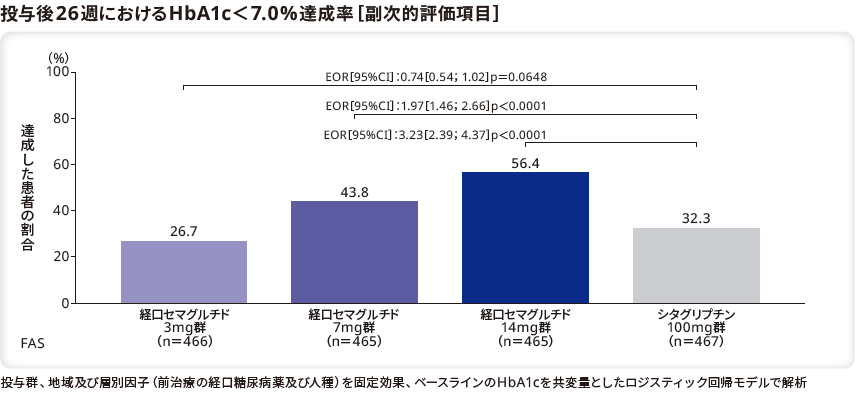
■空腹時血糖値の変化量と推移
空腹時血糖値のベースラインから投与後26週までのリベルサス®3mg群、7mg群、14mg群とシタグリプチン100mg群のETDはそれぞれ1.9mg/dL(95%CI[–3.6;7.3]、p=0.4994)、–5.9mg/dL(95%CI[–11.4;–0.3]、p=0.0385)、–15.1mg/dL(95%CI[–20.6;–9.7]、p<0.0001)であり、シタグリプチン100mg群と比較してリベルサス®7mg群及び14mg群で有意な低下を示し、3mg群では有意差はなかった。
なお、ベースラインの空腹時血糖値は、リベルサス®3mg群、7mg群、14mg群でそれぞれ、174.2mg/dL、170.3mg/dL、167.9mg/dL、シタグリプチン100mg群で、171.8mg/dLであった。投与後26週までの空腹時血糖値の変化量はリベルサス®3mg群、7mg群、14mg群でそれぞれ–13.6mg/dL、–21.3mg/dL、–30.5mg/dL、シタグリプチン100mg群で–15.4mg/dLであった。
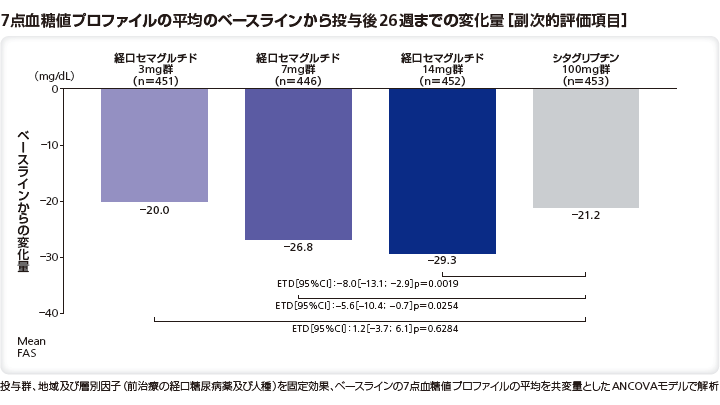
■7点血糖値プロファイル(SMBG)
7点血糖値プロファイルの平均のベースラインから投与後26週までの変化量のリベルサス®3mg群、7mg群、14mg群とシタグリプチン100mg群のETDはそれぞれ1.2mg/dL(95%CI[–3.7;6.1]、p=0.6284)、–5.6mg/dL(95%CI[–10.4;–0.7]、p=0.0254)、–8.0mg/dL(95%CI[–13.1;–2.9]、p=0.0019)であり、シタグリプチン100mg群と比較してリベルサス®7mg群及び14mg群で有意な低下を示し、3mg群では有意差はなかった。
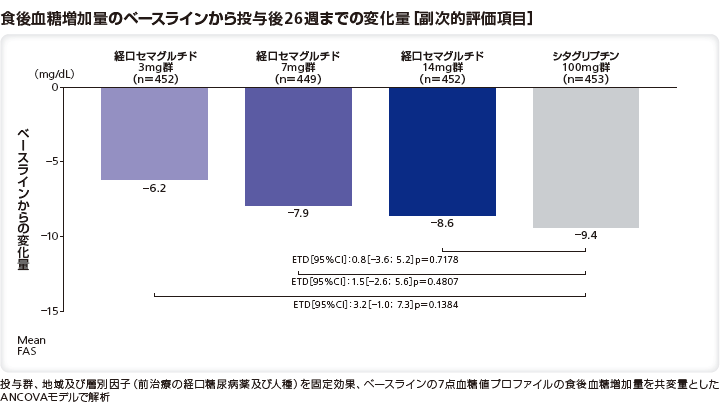
食後血糖増加量のベースラインから投与後26週までの変化量は、シタグリプチン100mg群と比較してリベルサス®3mg群、7mg群、14mg群で有意差はなかった(それぞれ、p=0.1384、p=0.4807、p=0.7178)。
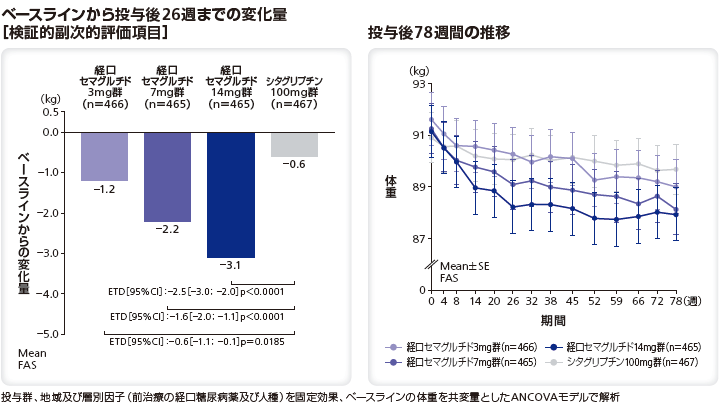
■<参考情報> 体重への影響
体重のベースラインから投与後26週までの変化量のリベルサス®3mg群、7mg群、14mg群とシタグリプチン100mg群のETDはそれぞれ–0.6kg(95%CI[–1.1;–0.1]、p=0.0185)、–1.6kg(95%CI[–2.0;–1.1]、p<0.0001)、–2.5kg(95%CI[–3.0;–2.0]、p<0.0001)であり、リベルサス®7mg及び14mgのシタグリプチン100mgに対する優越性が検証された。リベルサス®3mgについては、シタグリプチン100mgに対するHbA1cの変化量の非劣性が検証されなかったため、優越性検定を行っていない。
■低血糖
本試験において重大な又は血糖値確定症候性低血糖を発現した患者の割合は、リベルサス®3mg群、7mg群、14mg群でそれぞれ4.9%(23/466例)、5.2%(24/464例)、7.7%(36/465例)、シタグリプチン100mg群で8.4%(39/466例)であった。

■安全性
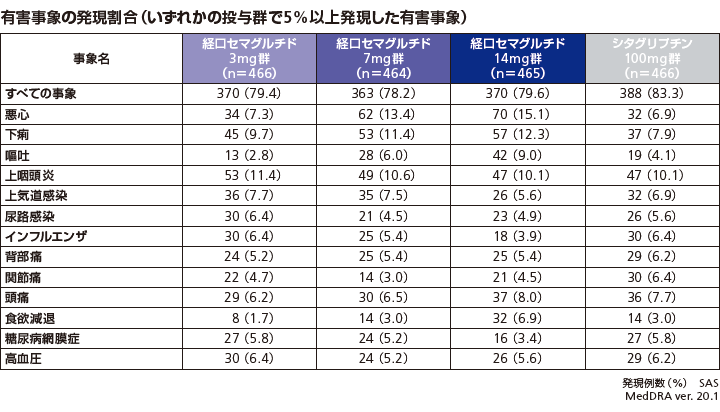
有害事象の発現割合は、リベルサス®3mg群、7mg群、14mg群でそれぞれ79.4%(370/466例)、78.2%(363/464例)、79.6%(370/465例)、シタグリプチン100mg群で83.3%(388/466例)であり、最も高頻度で報告された有害事象はリベルサス®3mg群、7mg群、14mg群ではそれぞれ上咽頭炎11.4%(53/466例)、悪心13.4%(62/464例)、悪心15.1%(70/465例)、シタグリプチン100mg群では上咽頭炎10.1%(47/466例)であった。
重篤な有害事象としてリベルサス®3mg群で64例99件(変形性関節症、肺炎、蜂巣炎、うっ血性心不全、心房細動、不安定狭心症、虚血性脳卒中、各3件、椎間板突出、骨髄炎、細菌性腹膜炎、心筋梗塞、慢性心不全、出血性卒中、子宮平滑筋腫、発熱、白内障手術、各2件、急性膵炎、腹痛、下痢、腹水、関節痛、筋骨格系胸痛、ウイルス感染、敗血症、インフルエンザ、ブドウ球菌性創感染、急性腎盂腎炎、骨盤膿瘍、前庭神経炎、尿路感染、冠動脈疾患、狭心症、急性心筋梗塞、高血圧性心疾患、心停止、心不全、転倒、くも膜下出血、頚椎骨折、尺骨骨折、上肢骨折、失神、一過性脳虚血発作、頭蓋内出血、脳幹卒中、脳症、急性腎障害、腎結石症、遠隔転移を伴う卵巣癌、甲状腺癌、前立腺癌、鼻腔癌、非心臓性胸痛、末梢性浮腫、慢性胆嚢炎、肝硬変、胆管結石、高血圧、静脈瘤、本態性高血圧症、末梢動脈閉塞性疾患、急性呼吸不全、急性呼吸窮迫症候群、前立腺炎、子宮ポリープ、子宮内膜増殖症、良性前立腺肥大症、高血糖、コントロール不良の糖尿病、甲状腺腫、臍ヘルニア修復、結膜刺激、糖尿病性白内障、白内障、鉄欠乏性貧血、血管浮腫、各1件)、7mg群で47例57件(不安定狭心症3件、変形性関節症、皮下組織膿瘍、冠動脈疾患、心房細動、硬膜下血腫、各2件、マロリー・ワイス症候群、大腸ポリープ、嘔吐、関節痛、骨端症、変形性脊椎症、肺炎、インフルエンザ、神経梅毒、腎盂腎炎、腹壁膿瘍、うっ血性心不全、狭心症、冠動脈狭窄、冠動脈不全、急性心筋梗塞、上室性頻脈、心肺停止、心房粗動、くも膜下出血、頭蓋底骨折、頚腕症候群、坐骨神経痛、視床梗塞、認知障害発作、B細胞性リンパ腫、遠隔転移を伴う乳癌、浸潤性乳管癌、前立腺癌、直腸腺癌、非心臓性胸痛、医療機器関連合併症、肝炎、急性胆嚢炎、血栓症、高血圧、静脈瘤、睡眠時無呼吸症候群、子宮ポリープ、コントロール不良の糖尿病、入院、貧血、陰嚢水瘤、サルコイドーシス、各1件)、14mg群で44例80件(急性膵炎、変形性関節症、失神、急性腎障害、各3件、腹痛、関節痛、肺炎、蜂巣炎、うっ血性心不全、肩甲骨骨折、虚血性脳卒中、非心臓性胸痛、慢性胆嚢炎、感音性難聴、末梢動脈閉塞、各2件、バレット食道、胃炎、下痢、変色便、滑膜炎、筋骨格系胸痛、腰部脊柱管狭窄症、骨端症、糖尿病性筋萎縮、背部痛、ウイルス感染、虫垂炎、敗血症、敗血症性静脈炎、冠動脈疾患、狭心症、心筋梗塞、心筋線維症、心房細動、不安定狭心症、血管偽動脈瘤、鎖骨骨折、転倒、閉塞性瘢痕ヘルニア、瘢痕ヘルニア、頭痛、慢性炎症性脱髄性多発根ニューロパチー、血尿、尿管結石症、形質細胞性骨髄腫、結腸癌、腎細胞癌、膵神経内分泌腫瘍、ポリープ、疲労、胆石症、回転性めまい、深部静脈血栓症、急性呼吸不全、急性肺水腫、慢性閉塞性肺疾患、前立腺炎、医療機器位置異常、高血糖、下垂体機能低下症、前立腺特異性抗原増加、各1件)が、シタグリプチン100mg群では58例83件(肺炎、心房細動、各4件、慢性心不全、急性胆嚢炎、各3件、変形性関節症、腎盂腎炎、冠動脈疾患、不安定狭心症、乳癌、胆石症、各2件、腹痛、悪心、胃潰瘍、膵嚢胞、鼡径ヘルニア、関節痛、頚部痛、肩回旋筋腱板症候群、椎間板突出、蜂巣炎、クレブシエラ菌性肺炎、感染性胆嚢炎、急性腎盂腎炎、精巣膿瘍、尿路性敗血症、腹膜炎、心筋梗塞、うっ血性心筋症、急性冠動脈症候群、急性左室不全、急性心筋梗塞、急性心不全、軟部組織損傷、虚血性脳卒中、失神、一過性脳虚血発作、顔面麻痺、末梢性ニューロパチー、腎結石症、腎嚢胞、末期腎疾患、胃腺癌、遠隔転移を伴う膵癌、結腸腺癌、脳の悪性新生物、非心臓性胸痛、アルコール性肝硬変、肝硬変、胆管結石、胆嚢炎、非アルコール性脂肪性肝炎、慢性肝不全、外耳道の外骨腫、低血圧、急性呼吸不全、鼻出血、喘息、子宮脱、コントロール不良の糖尿病、低血糖、糖尿病性代謝代償不全、肝機能検査異常、腹腔鏡下手術、増殖性網膜症、糖尿病網膜症、網膜出血、網膜剥離、各1件)が認められた。また、投与中止に至った有害事象としてリベルサス®3mg群で26例38件(下痢、消化不良、各3件、悪心、心房細動、各2件、急性膵炎、上腹部痛、腹痛、腹部膨満、麻痺性イレウス、食欲減退、発熱、無力症、虚血性脳卒中、体重減少、リパーゼ増加、血管浮腫、多汗症、感音性聴力低下、急性前庭症候群、耳鳴、くも膜下出血、慢性心不全、インフルエンザ、胃腸炎、急性腎盂腎炎、細菌性腹膜炎、尿路感染、急性腎障害、肝硬変、霧視、血小板減少症、高血圧、各1件)、7mg群で27例41件(悪心、嘔吐、各7件、下痢、上腹部痛、食欲減退、各2件、急性膵炎、胃食道逆流性疾患、胃炎、腹部不快感、マロリー・ワイス症候群、消化不良、心窩部不快感、疲労、胸部不快感、無力症、肝酵素上昇、腎機能検査異常、脱毛症、うっ血性心不全、直腸腺癌、皮下組織膿瘍、リビドー減退、肝炎、喀血、サルコイドーシス、過敏症、各1件)、14mg群で54例85件(悪心13件、下痢、嘔吐、各8件、食欲減退6件、急性膵炎、上腹部痛、腹痛、疲労、各3件、胃食道逆流性疾患、鼓腸、体重減少、回転性めまい、肩甲骨骨折、うっ血性心不全、各2件、おくび、胃炎、口内乾燥、腹部圧痛、腹部不快感、腹部膨満、倦怠感、疼痛、虚血性脳卒中、頭痛、浮動性めまい、慢性炎症性脱髄性多発根ニューロパチー、リパーゼ増加、膵酵素増加、そう痒症、発疹、皮膚症、鎖骨骨折、投薬過誤、形質細胞性骨髄腫、結腸癌、ヘリコバクター性胃炎、筋肉痛、尿閉、前立腺炎、リビドー減退、各1件)が、シタグリプチン100mg群では24例28件(悪心5件、嘔吐、腹痛、リパーゼ増加、各2件、下痢、急性膵炎、胃炎、腹部不快感、膵嚢胞、コントロール不良の糖尿病、胸痛、頭痛、アレルギー性皮膚炎、急性冠動脈症候群、乳癌、脳の悪性新生物、関節痛、変形性関節症、末期腎疾患、慢性肝不全、甲状腺腫、各1件)が認められた。
死亡はリベルサス®3mg群、7mg群、14mg群でそれぞれ5例(細菌性腹膜炎、心肺停止、出血性卒中、急性腎障害、急性呼吸窮迫症候群)、3例(心肺停止、心房細動、脳炎)、1例(心筋梗塞)、シタグリプチン100mg群で3例(遠隔転移を伴う膵癌、肺炎、慢性肝不全)、また治験薬投与前に1例認められたが、リベルサス®3mg群の急性腎障害を除き治験薬との因果関係は否定された。
【リベルサス®錠の用法及び用量/用法及び用量に関連する注意】
6. 用法及び用量
通常、成人には、セマグルチド(遺伝子組換え)として1日1回7mgを維持用量とし経口投与する。ただし、1日1回3mgから開始し、4週間以上投与した後、1日1回7mgに増量する。なお、患者の状態に応じて適宜増減するが、1日1回7mgを4週間以上投与しても効果不十分な場合には、1日1回14mgに増量することができる。
7. 用法及び用量に関連する注意
7.1 本剤の吸収は胃の内容物により低下することから、本剤は、1日のうちの最初の食事又は飲水の前に、空腹の状態でコップ約半分の水(約120mL 以下)とともに3mg錠、7mg錠又は14mg錠を1錠服用すること。また、服用時及び服用後少なくとも30分は、飲食及び他の薬剤の経口摂取を避けること。分割・粉砕及びかみ砕いて服用してはならない。[電子添文16.2.1-16.2.3参照]
【シタグリプチンの国内の用法及び用量】
通常、成人にはシタグリプチンとして50mgを1日1回経口投与する。なお、効果不十分な場合には、経過を十分に観察しながら100mg1日1回まで増量することができる。
ADA:米国糖尿病学会 CI:信頼区間 ETD:群間差の推定値 EOR:群間比の推定値 FAS:最大の解析対象集団 SAS:安全性解析対象集団 SMBG:血糖自己測定値 SU:スルホニルウレア薬
【禁忌を含む使用上の注意】等はこちらをご参照ください。