レカルブリオ®に関する過去のお知らせ一覧
過去のお知らせ一覧
1. 警告
本剤の耐性菌の発現を防ぐため、「5. 効能又は効果に関連する注意」及び「8. 重要な基本的注意」の項を熟読の上、適正使用に努めること。
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 他のβ-ラクタム系抗生物質に対し重篤な過敏症(アナフィラキシー等の重度の全身性アレルギー反応)の既往歴のある患者
2.3 バルプロ酸ナトリウム投与中の患者[10.1参照]
8.1 本剤の使用は、感染症の治療に十分な知識と経験を持つ医師又はその指導の下で行うこと。
8.2 本剤によるショック、アナフィラキシーの発生を確実に予知できる方法がないので、次の措置をとること。[11.1.2参照]
8.2.1 事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。[9.1.1、9.1.2参照]
8.2.2 投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
8.2.3 投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に、投与開始直後は注意深く観察すること。
8.3 本剤の使用にあたっては、耐性菌の発現を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.4 重篤な肝障害があらわれることがあるので、定期的に検査を実施するなど観察を十分に行うこと。[11.1.4参照]
8.5 重篤な血液障害があらわれることがあるので、定期的に検査を実施するなど観察を十分に行うこと。[11.1.6参照]
8.6 重篤な腎障害があらわれることがあるので、定期的に検査を実施するなど観察を十分に行うこと。[11.1.7参照]
9.1.1 他のβ-ラクタム系抗生物質に対し過敏症の既往歴のある患者 [8.2.1参照]
9.1.2 本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者 [8.2.1参照]
9.1.3 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
観察を十分に行うこと。ビタミンK欠乏症状があらわれることがある。
9.1.4 てんかんの既往歴あるいは中枢神経系障害を有する患者
痙攣、呼吸停止、意識障害、呼吸抑制等の中枢神経症状が起こりやすい。 [11.1.1参照]
減量等を考慮すること。痙攣、呼吸停止、意識障害、呼吸抑制等の中枢神経症状が起こりやすい。 [7.1、11.1.1参照]
肝障害が悪化するおそれがある。[11.1.4、16.6.2参照]
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。イミペネム及びシラスタチンはヒト母乳中へ移行することがある。レレバクタムはラットの母乳中へ移行することが報告されているが、ヒト母乳中へ移行するかどうかは不明である。
小児等を対象とした臨床試験は実施していない。
腎機能等、患者の状態を観察しながら慎重に投与すること。生理機能が低下している高齢者では副作用があらわれやすい。本剤は腎排泄型の薬剤である。なお、他の抗生物質(セフェム系、アミノグリコシド系等)を投与した高齢者において、ビタミンK欠乏による出血傾向があらわれたとの報告がある。[16.6.3参照]


1)金井 靖, et al., Jpn Pharmacol Ther. 1997;25(9):2343-2346.
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 中枢神経症状
痙攣、呼吸停止、意識障害、意識喪失、呼吸抑制、錯乱、不穏(いずれも頻度不明注1))等の中枢神経症状があらわれることがある。[9.1.4、9.2参照]
11.1.2 ショック、アナフィラキシー(いずれも頻度不明注1))
初期症状として、不快感、口内異常感、喘鳴、眩暈、便意、耳鳴、発汗又は呼吸困難、全身潮紅、浮腫等があらわれることがある。[8.2参照]
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明注1))
11.1.4 重篤な肝障害
劇症肝炎、肝炎、肝不全、黄疸(いずれも頻度不明注1))等の重篤な肝障害があらわれることがある。
11.1.5 気管支痙攣、間質性肺炎、PIE症候群(いずれも頻度不明注1))
喘息発作及び誘発等の気管支痙攣、また発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、PIE症候群等があらわれることがある。このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.6 重篤な血液障害
汎血球減少症、骨髄抑制、無顆粒球症、溶血性貧血(いずれも頻度不明注1))等の重篤な血液障害があらわれることがある。[8.5参照]
11.1.7 重篤な腎障害
急性腎障害、尿崩症(いずれも頻度不明注1))等の重篤な腎障害があらわれることがある。[8.6参照]
11.1.8 偽膜性大腸炎(頻度不明注1))
血便を伴う重篤な大腸炎があらわれることがある。腹痛、頻回の下痢があらわれた場合には直ちに投与を中止するなど適切な処置を行うこと。
11.1.9 血栓性静脈炎(頻度不明注1))
注1)配合成分である注射用イミペネム水和物・シラスタチンナトリウムで報告されている副作用
11.1.10 その他の副作用
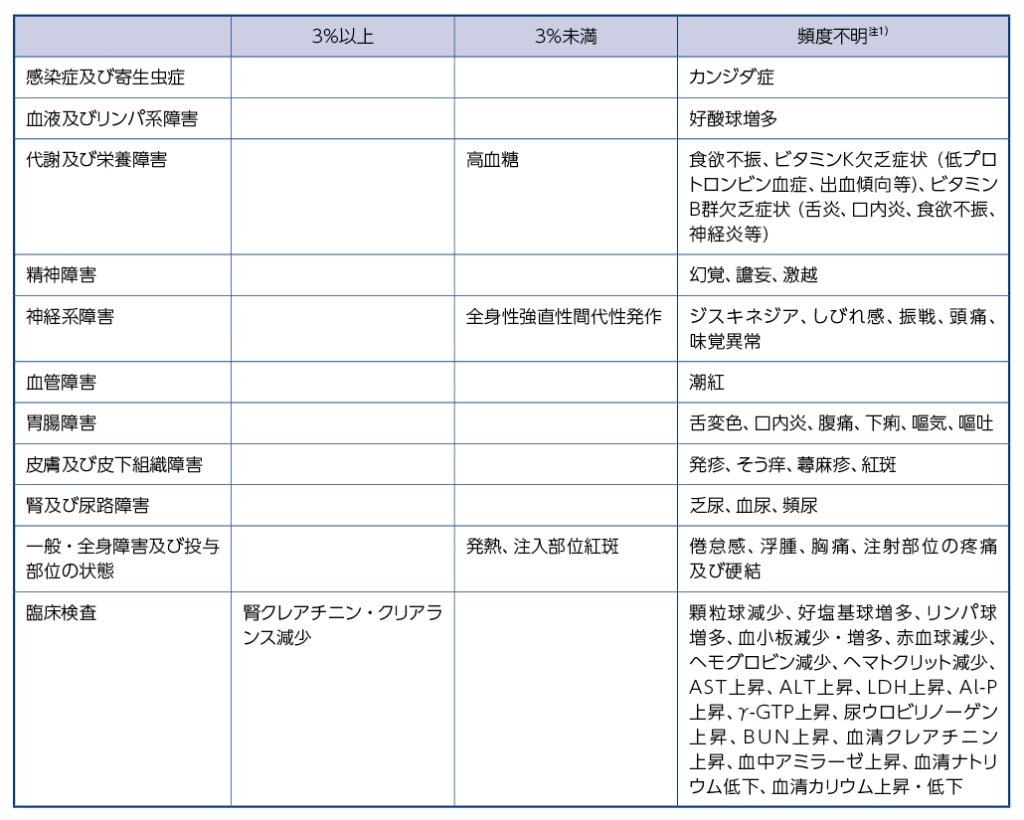
注1)配合成分である注射用イミペネム水和物・シラスタチンナトリウムで報告されている副作用
直接クームス試験陽性を呈することがある。
レレバクタム、イミペネム及びシラスタチンは血液透析で除去されるが、過量投与に対する血液透析の有用性は不明である。[16.6.1参照]
14.1.1 本剤は静脈内投与の前に希釈すること。
14.1.2 本剤は水溶性が低いため、以下の希釈手順に従うこと。
(1)本剤1バイアルにつき、生理食塩液又は5%ブドウ糖注射液100mLの点滴バッグから注射筒2本にそれぞれ約10mL抜き取り溶解用液とする。本剤は、乳酸塩とは化学的に不安定であるので、乳酸塩を含んだ溶液に溶解しないこと。
(2)1本目の溶解用液約10mLをバイアルに加えて溶解する。この溶解液を直接投与しないこと。
(3)溶解液をよく振り混ぜた後、溶解液入りバイアルから全量を抜き取り、残量約80mLの点滴バッグに注入し、希釈する。
(4)空のバイアルに2本目の溶解用液約10mLを加えてよく振り混ぜ、バイアル内に薬剤が溶け残っていないことを確認した後全量を抜き取り、点滴バッグに注入し、希釈液が澄明となるまで振り混ぜる。
14.1.3 腎機能障害のある患者(CLCRが90mL/min未満)に対して用量調節を行う場合は、手順に従い希釈液を調製した後、点滴バッグから下表を参考に余剰分を抜き取り、廃棄すること。
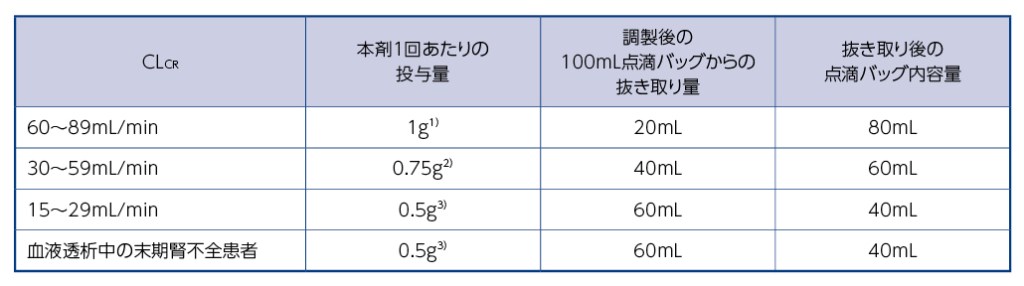
1)本剤1g(レレバクタム200mg、イミペネム400mg、シラスタチン400mg)
2)本剤0.75g(レレバクタム150mg、イミペネム300mg、シラスタチン300mg)
3)本剤0.5g(レレバクタム100mg、イミペネム200mg、シラスタチン200mg)
14.1.4 配合変化を起こすので、プロポフォールとの混合は避けること。
14.1.5 調製後は30℃以下では4時間以内、2~8℃では24時間以内に使用し、凍結させないこと。
14.1.6 本剤の使用前には目視で粒子状物質及び色調の変化がないか確認すること。希釈後の液は無色から黄色を呈するが、色の濃淡は本剤の効力には影響しない。溶液に粒子状物質や変色があった場合は使用しないこと。
14.1.7 寒冷期には希釈後の液を体温程度に温めて使用すること。
本剤投与患者において、イミペネムが分解され、尿が赤褐色を呈することがある。
妊娠ザルに、臨床推奨用量と同程度(体表面積換算値)のイミペネム・シラスタチンを器官形成期に静脈内投与した結果、催奇形性は認められなかったが、胚損失が増加したとの報告がある。
WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?