侵襲性真菌症の治療:侵襲性アスペルギルス症
ノクサフィル®の侵襲性アスペルギルス症の治療効果に関するエビデンスは、国内で実施した臨床試験成績及び承認時評価資料である海外臨床試験データに基づいて承認されており、国内の承認内容とは異なる用法及び用量による成績が含まれています。
臨床成績
侵襲性真菌症の治療:侵襲性アスペルギルス症
海外第Ⅲ相臨床試験(P069試験)1),2)
侵襲性アスペルギルス症に対する治療効果(検証試験、海外データ)
1)承認時評価資料(海外第Ⅲ相試験:P069試験)
2)Maertens JA et al. Lancet . 2021;397(10273):499-509
利益相反:本研究はMSDの資金により行われた
試験概要
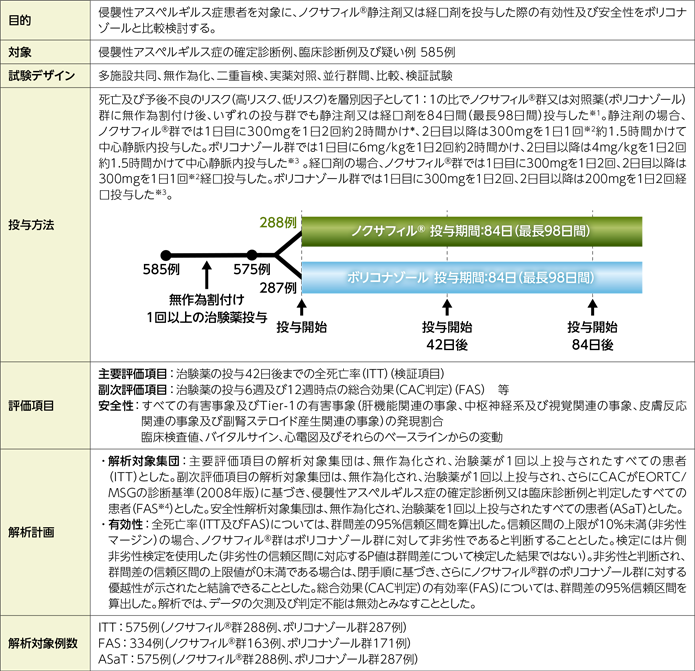
ITT:Intent-to-Treat、CAC:臨床判定委員会、EORTC/MSG:European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group、FAS:Full Analysis Set、ASaT:All subjects as treated
※1:いずれの投与群においても、治験担当医師の判断により、患者の状態に応じて投与開始時の製剤(静注剤又は経口剤)が選択された。また、静注剤で投与開始された患者のうち、患者の状態が安定しており、経口投与が可能になった患者は、経口剤に切り替えることとした。
※2:盲検性維持のため、2日目以降は毎日1回目の投与(静脈内投与又は経口投与)はノクサフィル®、2回目はプラセボを投与することとした。
※3:軽度又は中等度肝硬変(Child-PughスコアA又はB)の患者では、負荷用量は標準のままとするが、維持用量は減量することとした(静脈内投与:2mg/kg 1日2回、経口投与:100mg 1日2回)。
※4:侵襲性アスペルギルス症の疑い例として試験に組み入れられた患者は、無作為化後に侵襲性アスペルギルス症の確定診断例又は臨床診断例であることを確認するために追加の診断検査を受け、CACが基準に合致すると判定すれば、FAS集団に含まれた。
*:国内未承認の用法及び用量
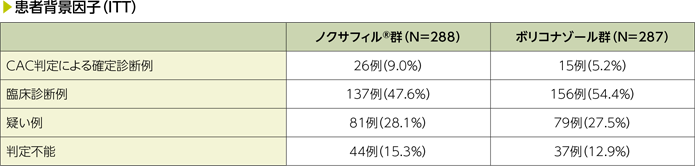
CAC:臨床判定委員会
有効性
1)治験薬の投与42日後までの全死亡率(主要評価項目、非劣性試験、検証的解析結果)
ITTにおける投与42日後までの全死亡率(主要評価項目、非劣性試験)は、ノクサフィル®群15.3%(44/288例)、ボリコナゾール群20.6%(59/287例)、群間差の点推定値は-5.3%で、その95%信頼区間は-11.6~1.0でした。群間差の95%信頼区間の上限が事前に規定した非劣性マージンである10%を下回ったことから、ボリコナゾールに対するノクサフィル®の非劣性が検証されましたが、群間差の95%信頼区間の上限値が0を下回らなかったため、優越性は示されませんでした。
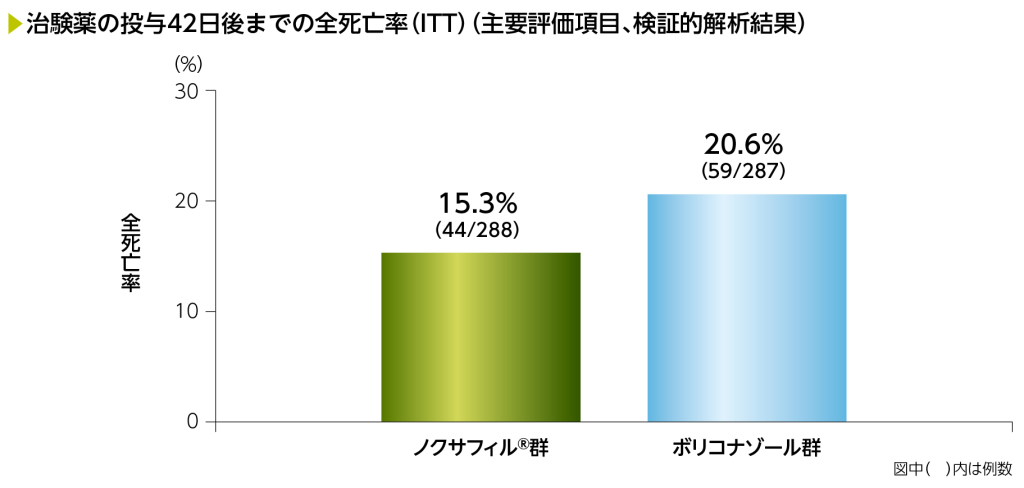
*:死亡及び予後不良のリスク(高リスク、低リスク)によって層別したMiettinen and Nurminen法。Cochran-Mantel-Haenszelの重み付けスキームを使用
主要評価項目である全死亡率の群間差の点推定値は-5.3%(95%CI:-11.6, 1.0)であり、群間差の95%CIの上限が事前に規定した非劣性マージンである10%を下回ったことから、ボリコナゾールに対するノクサフィル®の非劣性が示された。群間差の95%CIの上限が0を下回らなかったことから、優越性基準は満たさなかった。
†:片側非劣性検定 非劣性の信頼区間に対応するP値であり、群間差について検定した結果ではない。
2)治験薬の投与6週及び12週時点の総合効果(CAC判定)(副次評価項目)
FASにおける投与6週時点の総合効果(CAC判定)の有効率は、ノクサフィル®群44.8%(73/163例)、ボリコナゾール群45.6%(78/171例)、群間差の点推定値は-0.6%でその95%信頼区間は-11.2~10.1であり、投与12週時点の総合効果(CAC判定)の有効率は、ノクサフィル®群42.3%(69/163例)、ボリコナゾール群46.2%(79/171例)、群間差の点推定値は-3.4%でその95%信頼区間は-13.9~7.1でした。
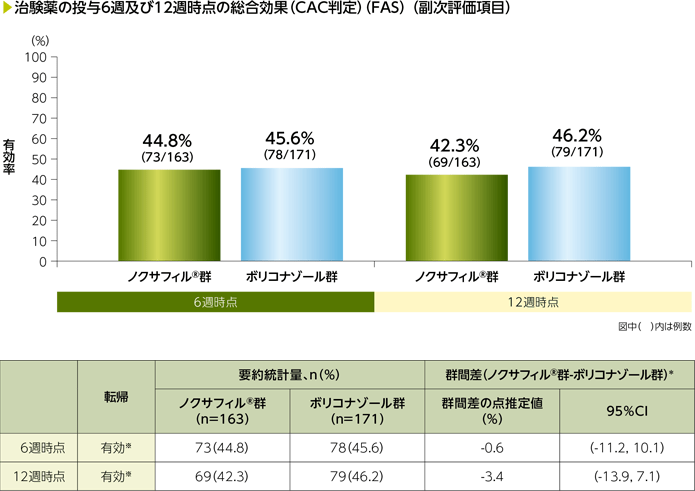
*:死亡及び予後不良のリスク(高リスク、低リスク)によって層別したMiettinen and Nurminen法。Cochran-Mantel-Haenszelの重み付けスキームを使用
※:2008年EORTC/MSGの定義に基づく完全奏効又は一部奏効を有効とした。
データの欠測及び判定不能は無効とみなした。
CAC:臨床判定委員会
侵襲性アスペルギルス症の総合効果判定基準(2008年EORTC/MSGの定義に基づく)

† 画像所見における改善:画像所見上の病変の長径が25%以上縮小
‡ 画像所見における不変:画像所見上の病変の長径が0%~25%減少
安全性
副作用は、ノクサフィル®群288例中86例(29.9%)、ボリコナゾール群287例中115例(40.1%)に認められました。
主な副作用は、ノクサフィル®群でアラニンアミノトランスフェラーゼ増加22例(7.6%)、アスパラギン酸アミノトランスフェラーゼ増加18例(6.3%)、ボリコナゾール群でアラニンアミノトランスフェラーゼ増加18例(6.3%)、アスパラギン酸アミノトランスフェラーゼ増加16例(5.6%)、血中アルカリホスファターゼ増加16例(5.6%)などでした。
重篤な副作用はノクサフィル®群16例、ボリコナゾール群20例であり、主な重篤な副作用は、ノクサフィル®群でアラニンアミノトランスフェラーゼ増加3例、肝機能異常、アスパラギン酸アミノトランスフェラーゼ増加、γ-GTP増加及び幻覚各2例、ボリコナゾール群で脳症3例などでした。
投与中止に至った副作用はノクサフィル®群18例、ボリコナゾール群28例であり、主な投与中止に至った副作用は、ノクサフィル®群で幻覚3例、肝機能異常、アラニンアミノトランスフェラーゼ増加、アスパラギン酸アミノトランスフェラーゼ増加及び痙攣発作各2例、ボリコナゾール群で幻覚3例、アラニンアミノトランスフェラーゼ増加及び脳症各2例などでした。
死亡に至った副作用は、ノクサフィル®群では認められず、ボリコナゾール群で膵炎、大脳障害及び脳症各1例でした。
- ボリコナゾールの用法及び用量(抜粋)は、「錠:成人(体重40kg以上) 通常、ボリコナゾールとして初日は1回300mgを1日2回、2日目以降は1回150mg又は1回200mgを1日2回食間に経口投与する。なお、患者の状態に応じて、又は効果不十分の場合には、増量できるが、初日投与量の上限は1回400mg1日2回、2日目以降投与量の上限は1回300mg1日2回までとする。成人(体重40kg未満)通常、ボリコナゾールとして初日は1回150mgを1日2回、2日目以降は1回100mgを1日2回食間に経口投与する。なお、患者の状態に応じて、又は効果不十分の場合には2日目以降の投与量を1回150mg1日2回まで増量できる。静注:成人 通常、ボリコナゾールとして初日は1回6mg/kgを1日2回、2日目以降は1回3mg/kg又は1回4mg/kgを1日2回点滴静注する。」です。
詳細は製品電子添文をご参照ください。
6. 用法及び用量
錠100mg
通常、成人にはポサコナゾールとして初日は1回300mgを1日2回、2日目以降は300mgを1日1回経口投与する。
点滴静注300mg
通常、成人にはポサコナゾールとして初日は1回300mgを1日2回、2日目以降は300mgを1日1回、中心静脈ラインから約90分間かけて緩徐に点滴静注する。
7. 用法及び用量に関連する注意 ―抜粋―
〈真菌症(侵襲性アスペルギルス症、フサリウム症、ムーコル症、コクシジオイデス症、クロモブラストミコーシス、菌腫)の治療〉
7.3 投与期間は基礎疾患の状態、免疫抑制からの回復及び臨床効果に基づき設定すること。
【禁忌を含む注意事項等情報】 等はこちらをご参照ください。