臨床成績
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
臨床成績
※本剤は第II相までの臨床試験の結果から、海外での第III相試験成績をもとに承認されたため、国内での第III相試験は実施されておりません。また、一部承認外の試験成績が含まれますが、承認時の審査・評価に用いられた成績のためご紹介します。
1. 通常時の筋弛緩状態からの回復における有効性及び安全性
【1】浅い筋弛緩状態(T2再出現を確認した後)での有効性及び安全性[海外データ]1)
1)社内資料:T2再出現時投与における海外第Ⅲ相臨床試験(301試験、承認時評価資料)
[試験概要]
目的:エスラックス®による浅い筋弛緩状態から、ブリディオン®とネオスチグミンによる回復を評価する
試験デザイン:第Ⅲ相、多施設、無作為化、並行群間比較、実薬対照、安全性評価者盲検、ピボタル試験
対象:ASA分類Class1〜4、18歳以上、全身麻酔下(プロポフォールで導入、セボフルランで維持)で仰臥位での手術を受ける外国人患者(エスラックス®+ブリディオン®群:48例、エスラックス®+ネオスチグミン群:48例)
投与方法:エスラックス®0.6mg/kg投与後、又は維持用量投与後T2再出現時にブリディオン®2mg/kg又はネオスチグミンメチル硫酸塩50μg/kg+glycopyrrolate※10μg/kgを単回静脈内投与した
評価項目:【主要評価項目】T2再出現時におけるブリディオン®又はネオスチグミンメチル硫酸塩投与からTOF比0.9に回復するまでの時間(検証的評価項目)
解析計画:回復時間の対数を応答変数、施設及び治療群をモデルの要因とした、二元配置分散分析モデルを用いて解析した
※:本邦未承認薬
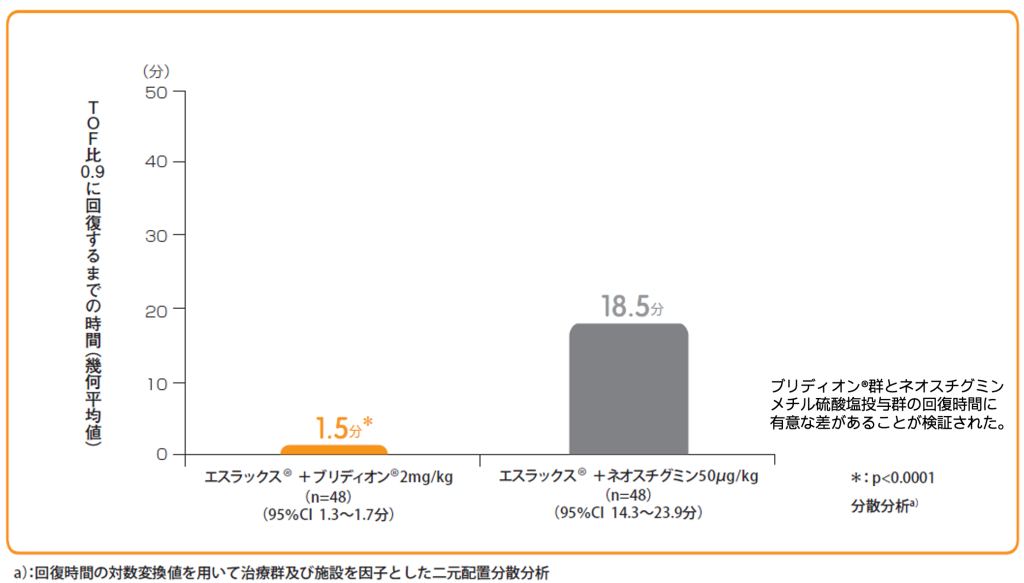
エスラックス®0.6mg/kg投与後T2再出現時にブリディオン®2mg/kg又はネオスチグミンメチル硫酸塩50μg/kg+glycopyrrolate※10μg/kgを単回静脈内投与し、投与開始からTOF比0.9に回復するまでの時間(幾何平均値)をみたところ、ブリディオン®投与群は1.5分であり、ネオスチグミンメチル硫酸塩投与群の18.5分と比較して有意に早かった(p<0.0001)。なお、ブリディオン®投与群において、主要項目で評価された患者(承認用量)でTOF比0.9以上に回復した。
※:本邦未承認薬
T2再出現時におけるブリディオン®又はネオスチグミンメチル硫酸塩投与から
TOF比0.9に回復するまでの時間(分)【主要評価項目(検証的評価項目)】
安全性
本試験において因果関係が否定されなかった有害事象(臨床検査値異常を含む)は、エスラックス®+ブリディオン®群14.6%(7/48例)、エスラックス®+ネオスチグミン群20.8%(10/48例)に認められた。エスラックス®+ブリディオン®群の主な事象は、口内乾燥3例(6.3%)、悪心2例(4.2%)、嘔吐2例(4.2%)、処置による高血圧2例(4.2%)等であり、エスラックス®+ネオスチグミン群では、口内乾燥3例(6.3%)、悪心2例(4.2%)等であった。因果関係が否定されない死亡及び重篤な有害事象、中止に至った有害事象は報告されなかった。
【2】深い筋弛緩状態(PTCが1-2の場合)での有効性及び安全性[海外データ]1,2)
1)社内資料:1-2PTC出現時投与における海外第Ⅲ相臨床試験(302試験、承認時評価資料)
2)Jones RK et al. Anesthesiology 2008;109(5):816-824.
[利益相反:本研究にシェリング・プラウ(現MSD)は資金提供を行った。本研究の統計解析はシェリング・プラウ(現MSD)の社員が行い、シェリング・プラウ(現MSD)は論文の編集に携わった。]
[試験概要]
目的:エスラックス®による深い筋弛緩状態から、ブリディオン®とネオスチグミンによる回復を評価する
試験デザイン:第Ⅲ相、多施設、無作為化、並行群間比較、安全性評価者盲検、実薬対照、ピボタル試験
対象:ASA分類Class1〜4、18歳以上、全身麻酔下(プロポフォールで導入、セボフルランで維持)で仰臥位での手術を受ける外国人患者(エスラックス®+ブリディオン®群:37例、エスラックス®+ネオスチグミン群:38例)
投与方法:エスラックス®0.6mg/kg投与後、又は維持用量投与後1-2PTCの出現時にブリディオン®4mg/kg又はネオスチグミンメチル硫酸塩70μg/kg+glycopyrrolate※14μg/kgを単回静脈内投与した
評価項目:【主要評価項目】1-2PTCの出現時におけるブリディオン®又はネオスチグミンメチル硫酸塩投与からTOF比0.9に回復するまでの時間(検証的評価項目)
解析計画:回復時間の対数変換値を用いて治療群及び施設を因子とした二元配置分散分析モデルで解析した
※:本邦未承認薬
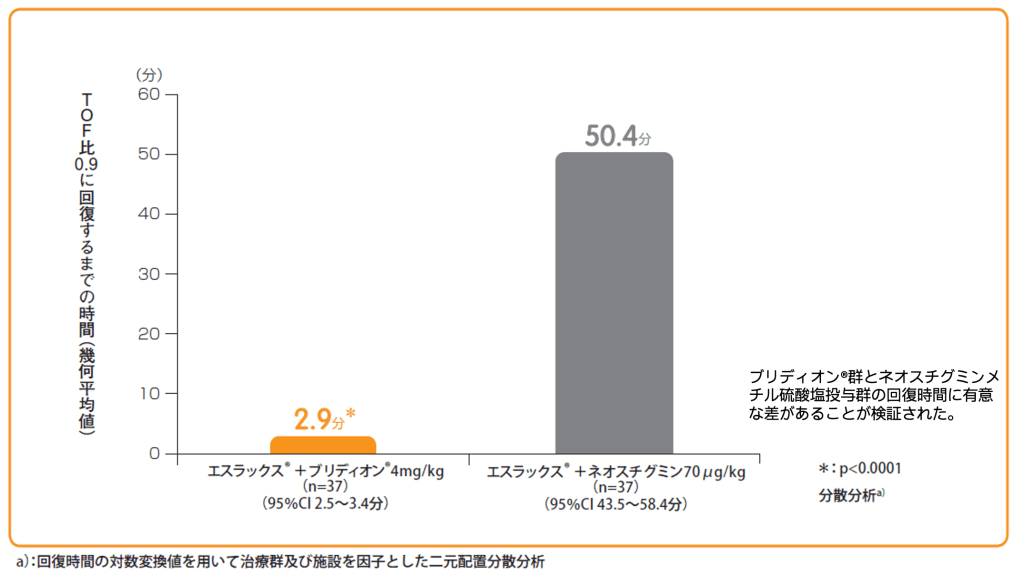
エスラックス®0.6mg/kg投与後、1-2PTCの出現時にブリディオン®4mg/kg又はネオスチグミンメチル硫酸塩70μg/kg+glycopyrrolate※14μg/kgを単回静脈内投与し、投与開始からTOF比0.9に回復するまでの時間(幾何平均値)をみたところ、ブリディオン®投与群は2.9分であり、ネオスチグミンメチル硫酸塩投与群の50.4分と比較して有意に早かった(p<0.0001)。なお、ブリディオン®投与群において、主要項目で評価された患者(承認用量)でTOF比0.9以上に回復した。
※:本邦未承認薬
1-2PTCの出現時におけるブリディオン®又はネオスチグミンメチル硫酸塩投与から
TOF比0.9に回復するまでの時間(分)【主要評価項目(検証的評価項目)】
注)ネオスチグミンの非脱分極性筋弛緩剤の作用の拮抗における用法及び用量
通常、成人にはネオスチグミンメチル硫酸塩として1回0.5~2.0mgを緩徐に静脈内注射する。なお、年齢、症状により適宜増減する。ただし、アトロピン硫酸塩水和物を静脈内注射により併用すること。
安全性
本試験において因果関係が否定されなかった有害事象(臨床検査値異常を含む)は、エスラックス®+ブリディオン®群27.0%(10/37例)、エスラックス®+ネオスチグミン群31.6%(12/38例)に認められた。エスラックス®+ブリディオン®群の主な事象は、筋力低下3例(8.1%)、悪心2例(5.4%)、嘔吐2例(5.4%)、処置後悪心2例(5.4%)等であり、エスラックス®+ネオスチグミン群では、悪心5例(13.2%)、筋力低下3例(7.9%)、処置合併症3例(7.9%)、嘔吐2例(5.3%)、処置後悪心2例(5.3%)等であった。因果関係が否定されない死亡及び重篤な有害事象、中止に至った有害事象は報告されなかった。
2. 緊急時の筋弛緩状態からの回復における有効性及び安全性[海外データ]1,2)
1)社内資料:緊急時投与における海外第Ⅲ相臨床試験(303試験、承認時評価資料)
2)Lee C et al. Anesthesiology 2009;110(5):1020-1025.
[利益相反:本研究にシェリング・プラウ(現MSD)は資金提供を行った。本研究の統計解析はシェリング・プラウ(現MSD)の社員が行った。]
[試験概要]
目的:エスラックス®投与3分後の緊急時でのブリディオン®による回復と、スキサメトニウムの自然回復を評価する
対象:ASA分類Class1〜2、18〜64歳、BMIが30kg/m2未満、全身麻酔下(プロポフォール)で仰臥位での手術を受ける外国人患者(エスラックス®+ブリディオン®群:55例、スキサメトニウム群:55例)
試験デザイン:第Ⅲ相、多施設、無作為化、並行群間比較、実薬対照、安全性評価者盲検試験
投与方法:エスラックス®1.2mg/kg注)投与後3分にブリディオン®16mg/kgを投与して回復を行った群と、スキサメトニウム塩化物水和物1.0mg/kgを投与して自然回復を待った群とで比較した
評価項目:
【主要評価項目】エスラックス®又はスキサメトニウム塩化物水和物投与開始からT1が10%に回復するまでの時間
【副次評価項目】エスラックス®又はスキサメトニウム塩化物水和物投与開始からT1が90%に回復するまでの時間
解析計画:【副次評価項目】回復時間の対数変換値を用いて治療群及び施設を因子とした二元配置分散分析モデルで解析した
注)本邦で承認されたエスラックス®の用法及び用量は、「通常、成人には挿管用量としてロクロニウム臭化物0.6mg/kgを静脈内投与し、術中必要に応じて0.1〜0.2mg/kgを追加投与する。持続注入により投与する場合は、7μg/kg/分の投与速度で持続注入を開始する。
なお、年齢、症状に応じて適宜増減するが、挿管用量の上限は0.9mg/kgまでとする。」です。
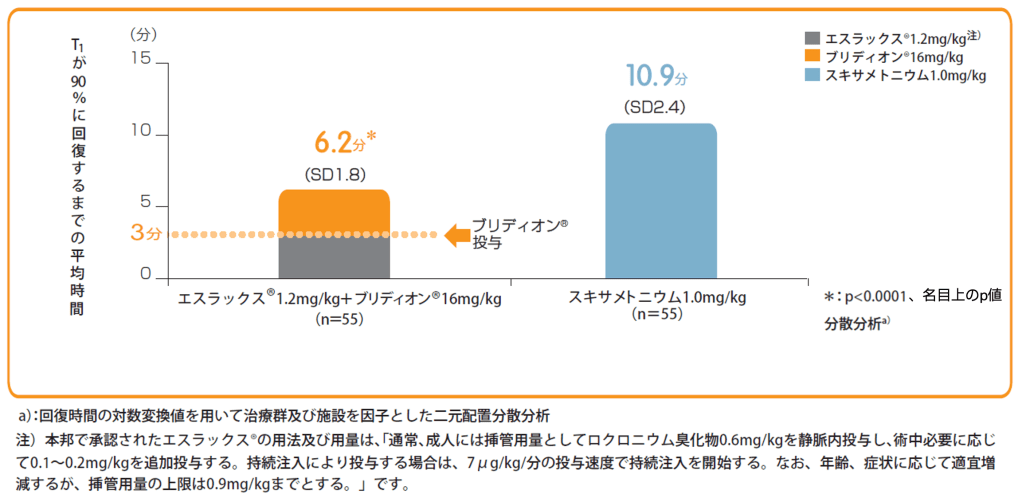
エスラックス®1.2mg/kg注)投与後3分にブリディオン®16mg/kgを単回静脈内投与した群と、スキサメトニウム塩化物水和物1.0㎎/kgを単回静脈内投与して自然回復を待った群とでT1が10%に回復するまでの時間(平均値)をみたところ、ブリディオン®投与群は4.4分であり、スキサメトニウム塩化物水和物投与群の自然回復の7.1分と比較して有意に早かった(p<0.0001、名目上のp値、二元配置分散分析)。なお、ブリディオン®投与群において、主要項目で評価された患者(承認用量)でTOF比0.9以上に回復した。
エスラックス®又はスキサメトニウム塩化物水和物投与開始から
T1が10%に回復するまでの時間(分)【主要評価項目】

また、T1が90%にまで回復するまでの時間は、ブリディオン®投与群で平均6.2分、スキサメトニウム塩化物水和物投与群の自然回復群は平均10.9分であった。
エスラックス®又はスキサメトニウム塩化物水和物投与開始から
T1が90%に回復するまでの時間(分)【副次評価項目】
注)本邦で承認されたエスラックス®の用法及び用量は、「通常、成人には挿管用量としてロクロニウム臭化物0.6mg/kgを静脈内投与し、術中必要に応じて0.1〜0.2mg/kgを追加投与する。持続注入により投与する場合は、7μg/kg/分の投与速度で持続注入を開始する。
なお、年齢、症状に応じて適宜増減するが、挿管用量の上限は0.9mg/kgまでとする。」です。
安全性
本試験において因果関係が否定されなかった有害事象(臨床検査値異常を含む)は、エスラックス®+ブリディオン®群14.3%(8/56例)、スキサメトニウム群14.8%(8/54例)に認められた。エスラックス®+ブリディオン®群の主な事象は、処置合併症4例(7.1%)、悪心2例(3.6%)、処置による高血圧2例(3.6%)等であり、スキサメトニウム群では、処置による高血圧2例(3.7%)、悪心1例(1.9%)等であった。因果関係が否定されない死亡及び重篤な有害事象、中止に至った有害事象は報告されなかった。