安全性
安全性
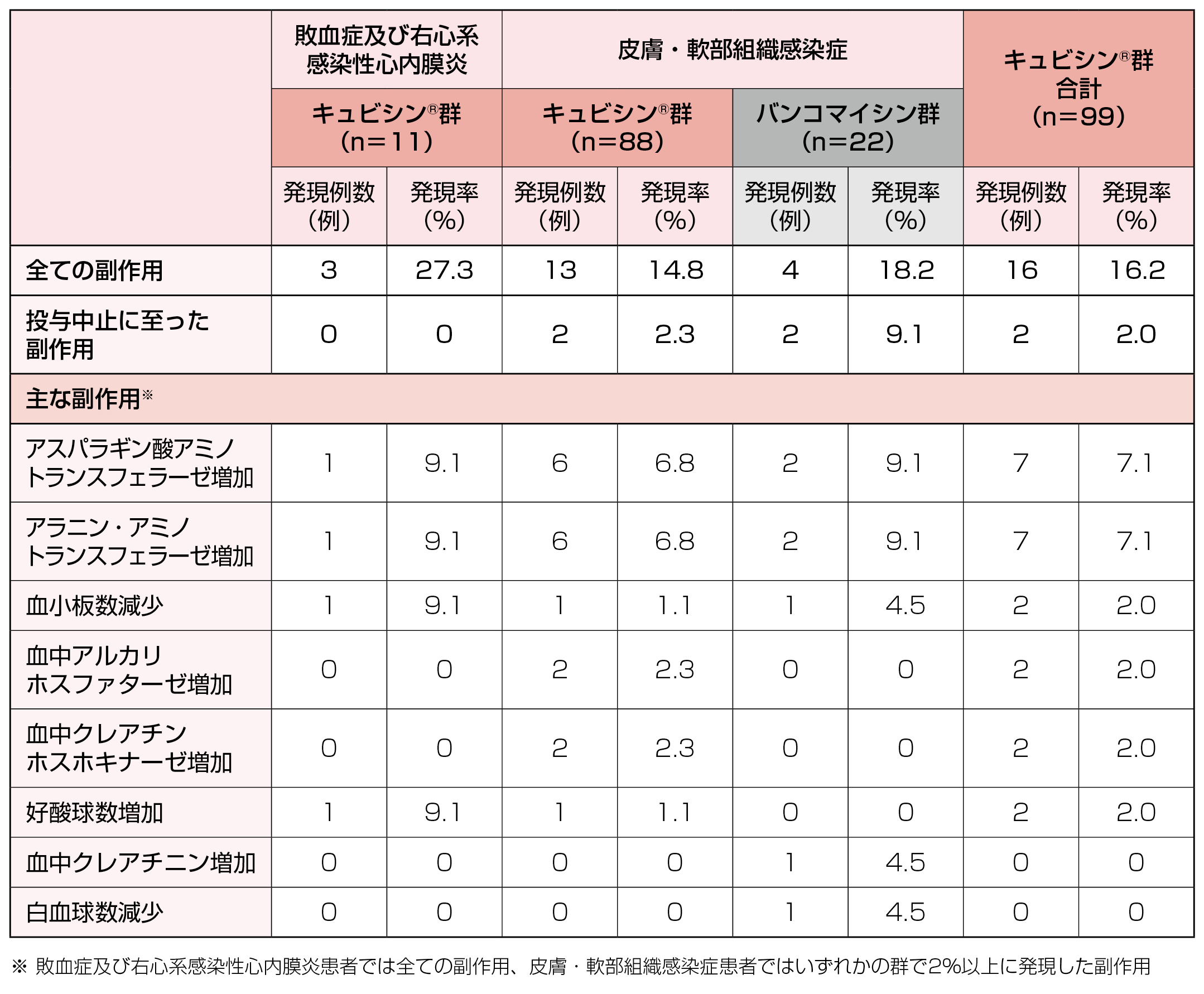
<成人>国内第Ⅲ相試験でのキュビシン®の副作用(敗血症及び右心系感染性心内膜炎、皮膚・軟部組織感染症)
<成人>国内第Ⅲ相試験でのキュビシン®の副作用(敗血症及び右心系感染性心内膜炎、皮膚・軟部組織感染症)
承認時評価資料:成人を対象とした国内第Ⅲ相試験(002試験)
Aikawa N,et al.,J Infect Chemother.2013;19(3):447-455.
[利益相反:Aikawa N、Kusachi S、Mikamo H、Takesue Y、Watanabe Sは、本試験の有効性判定委員会に参加し、
MSDから参加報酬を受領した。Tanaka Y、Moritz A、Tsumori K、Kato Y、Yoshinari T は、MSDの社員。]
本試験の対象には一部国内承認外の適応菌種が含まれるデータで評価され承認されたため、国内で承認されている効能又は効果と異なるデータも紹介しています。
1)臨床症状の副作用
敗血症及び右心系感染性心内膜炎患者における臨床症状の副作用は、キュビシン®群11例中2例[湿疹、薬疹、下痢が各1例(各9.1%)](18.2%)に認められました。
皮膚・軟部組織感染症患者における臨床症状の副作用は、キュビシン®群88例中9例(10.2%)、バンコマイシン群22例中4例(18.2%)に認められ、主な副作用(発現率2%以上)は、キュビシン®群で発熱(2例、2.3%)、バンコマイシン群でそう痒症、レッドマン症候群、発熱、熱感、耳不快感(各1例、各4.5%)でした。
臨床症状の重篤な副作用は、皮膚・軟部組織感染症患者におけるキュビシン®群でアナフィラキシーショックが1例(1.1%)に認められ、皮膚・軟部組織感染症患者におけるバンコマイシン群、敗血症及び右心系感染性心内膜炎患者におけるキュビシン®群では認められませんでした。臨床症状の副作用による死亡例は、いずれの群においても認められませんでした。
投与中止に至った臨床症状の副作用は、皮膚・軟部組織感染症患者におけるキュビシン®群でアナフィラキシーショックが1例(1.1%)に認められ、皮膚・軟部組織感染症患者におけるバンコマイシン群、敗血症及び右心系感染性心内膜炎患者におけるキュビシン®群では認められませんでした。
■臨床症状の副作用の概要(安全性解析対象例)
2)臨床検査値の副作用
敗血症及び右心系感染性心内膜炎患者における臨床検査値の副作用は、キュビシン®群11例中3例[アスパラギン酸アミノトランスフェラーゼ増加、アラニン・アミノトランスフェラーゼ増加、血小板数減少、好酸球数増加が各1例(各9.1%)](27.3%)に認められました。
皮膚・軟部組織感染症患者における臨床検査値の副作用は、キュビシン®群88例中13例(14.8%)、バンコマイシン群22例中4例(18.2%)に認められ、主な副作用(発現率2%以上)は、キュビシン®群でアスパラギン酸アミノトランスフェラーゼ増加、アラニン・アミノトランスフェラーゼ増加(各6例、各6.8%)、血中アルカリホスファターゼ増加、血中クレアチンホスホキナーゼ増加(各2例、各2.3%)、バンコマイシン群でアスパラギン酸アミノトランスフェラーゼ増加、アラニン・アミノトランスフェラーゼ増加(各2例、各9.1%)、血小板数減少、血中クレアチニン増加、白血球数減少(各1例、各4.5%)でした。
臨床検査値の重篤な副作用及び副作用による死亡例は、いずれの群においても認められませんでした。
投与中止に至った臨床検査値の副作用は、皮膚・軟部組織感染症患者におけるキュビシン®群で2例[アスパラギン酸アミノトランスフェラーゼ増加及びアラニン・アミノトランスフェラーゼ増加が各2件](2.3%)、バンコマイシン群で2例[白血球数減少及び血小板数減少、血中クレアチニン増加が各1件](9.1%)に認められ、敗血症及び右心系感染性心内膜炎患者におけるキュビシン®群では認められませんでした。
■臨床検査値の副作用の概要(安全性解析対象例)