成人
臨床成績(成人)
ヘプタバックス®-Ⅱの国内第Ⅲ相臨床試験結果(成人)
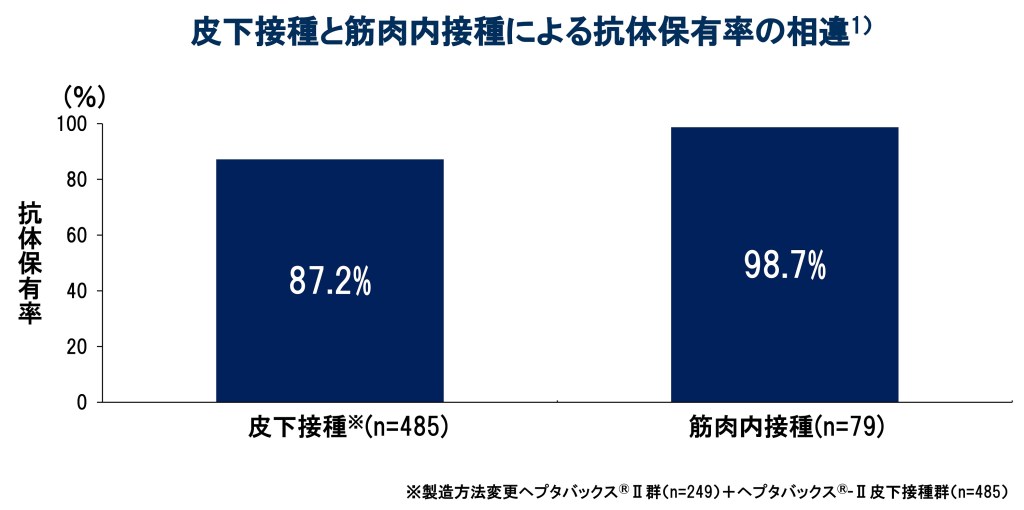
3回接種後の抗HBs抗体価が10mIU/mL以上の被験者の割合は、皮下接種で87.2%(423/485例)、筋肉内接種で98.7%(78/79例)でした1)。
ヘプタバックス®ーⅡ皮下接種において、製造変更前後の免疫原性は群間推定差8.9%(95%CI:3.0, 15.1)で非劣性が検証されました。(Miettinen and Nurminen法、主目的)2)
- ワクチン日誌も用いて収集した安全性情報に基づき、製造方法変更ヘプタバックス®-Ⅱおよびヘプタバックス®-Ⅱ接種後1~15日目の安全性を評価した。副反応の発現率は、製造方法変更ヘプタバックス®-Ⅱ皮下接種群(以下、変更皮下接種群)217/279例(77.8%)、ヘプタバックス®-Ⅱ皮下接種群(以下、皮下接種群)201/278例(72.3%)、製造方法変更ヘプタバックス®-Ⅱ筋肉内接種群(以下、変更筋肉内接種群)62/94例(66.0%)であった。
- 変更皮下接種群の注射部位の副反応は213例(76.3%)、疼痛は194例(69.5%)、紅斑は159例(57.0%)、腫脹は151例(54.1%)、そう痒感は45例(16.1%)、全身性の有害事象は34例(12.2%)、頭痛は10例(3.6%)、発熱は7例(2.5%)、倦怠は3例(1.1%)に発現した。
- 皮下接種群の注射部位の副反応は198例(71.2%)、疼痛は173例(62.2%)、紅斑は134例(48.2%)、腫脹は132例(47.5%)、そう痒感は47例(16.9%)、全身性の有害事象は35例(12.6%)、頭痛は10例(3.6%)、発熱は7例(2.5%)、倦怠は6例(2.2%)に発現した。
- 変更筋肉内接種群の注射部位の副反応は60例(63.8%)、疼痛は54例(57.4%)、紅斑は21例(22.3%)、腫脹は22例(23.4%)、そう痒感は5例(5.3%)、全身性の有害事象は10例(10.6%)、頭痛は5例(5.3%)、発熱および倦怠はそれぞれ1例(1.1%)に発現した。
- 変更皮下接種群の1例に、接種1日後に全身性の副反応(1日後:下痢、疲労、頭痛、発熱)、2日後に注射部位の副反応(紅斑、腫脹)が発現したため試験を中止した。いずれの群においても重篤な副反応および死亡例は認められなかった。
【目 的】
主目的は、製造方法変更ヘプタバックス®-Ⅱ皮下接種7カ月後(3回目接種1カ月後)の免疫原性におけるヘプタバックス®-Ⅱ皮下接種に対する非劣性の検証とした。安全性評価の目的は、製造方法変更ヘプタバックス®-Ⅱの安全性評価の検討とした。
【対 象】
20~35歳の日本人成人722例(製造方法変更ヘプタバックス®-Ⅱ皮下接種:279例、ヘプタバックス®-Ⅱ皮下接種:279例、製造方法変更ヘプタバックス®-Ⅱ筋肉内接種:94例)
【方 法】
対象を製造方法変更ヘプタバックス®-Ⅱ皮下接種群、ヘプタバックス®-Ⅱ皮下接種群、製造方法変更ヘプタバックス®-Ⅱ筋肉内接種群に3:3:1に無作為割付し、試験開始時、1カ月後、6カ月後にそれぞれを接種した。試験開始前、7カ月後に、VITROS anti-HBs assayを用いて抗HBs抗体価を測定した。
【評価項目】
主目的 初回投与7カ月後の抗体保有率、安全性 有害事象の発現頻度と割合
【解析計画】
per-protocol集団を対象に、7カ月後の皮下接種による抗体保有率はMiettinen and Nurminen法を用い、群間差については両側95%CIを算出した。接種7カ月後の抗体保有率の差(製造方法変更ヘプタバックス®-Ⅱ皮下接種群-ヘプタバックス®-Ⅱ皮下接種群)の両側95%CIの下限値が-10%を下回らない場合を非劣性とした。安全性解析には、少なくとも1回のワクチン接種を受け、安全性の追跡調査を受けた全無作為割付け患者を対象とし、有害事象の頻度と割合を集計した。
1)ヘプタバックス®-Ⅱ電子添文より
2) Kishino H, et al. Hum Vaccin Immunother. 2018 ; 14(7) : 1773-1778
利益相反:全著者はMSDの社員であり、同社の株式、ストックオプションを保有している可能性がある。