製品基本Q&A 400mg
製品基本Q&A
アイセントレス®錠400mg(ラルテグラビルカリウム)
製品情報
本剤の電子添文には、以下のとおり記載されています。
4. 効能又は効果
HIV感染症
5. 効能又は効果に関連する注意
本剤による治療にあたっては、患者の治療歴及び薬剤耐性検査結果を参考にすること。
HIVインテグラーゼは、HIV遺伝子にコードされたウイルス複製に必要な酵素であり、ラルテグラビルは、HIVインテグラーゼの触媒活性を阻害します。HIVインテグラーゼの阻害により、HIV感染初期において、HIVゲノムの宿主細胞ゲノムへの共有結合的挿入又は組込みが阻害されます。組み込まれなかったHIVゲノムは、感染性ウイルス粒子を新たに産生することができないため、ウイルスの感染拡大が阻止されます。なお、ラルテグラビルは、DNAポリメラーゼα、β、γを含むヒトホスホリルトランスフェラーゼに対し、顕著な阻害作用を示しませんでした。
<引用>
電子添文
健康成人における5日間の空腹時反復投与試験(291試験)において、ラルテグラビルは投与後速やかに吸収され、投与5日目におけるTmaxは、アイセントレス®1,200mg(600mg錠×2)1日1回投与群で2.00h及びアイセントレス®400mg 1日2回投与群で1.50hでした。
また、アイセントレス®400mg 1日2回投与群よりアイセントレス®1,200mg(600mg錠×2)1日1回投与群でAUCの幾何平均値が2.3倍(>処方量比:1200/800=1.5)、Cmaxの幾何平均値が6.0倍(>処方量比:1200/400=3)高く、トラフ濃度はアイセントレス®1,200mg(600mg錠×2)1日1回投与群の方がアイセントレス®400mg 1日2回投与群より低い値でした(1)。
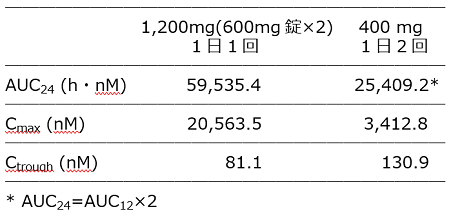
両群でラルテグラビルの血中濃度に違いは認められていますが、ONCEMRK試験の結果では、有効性及び安全性に違いはありませんでした(2)。
<引用>
(1)Krishna R et al. Clin Pharmacol Drug Dev. 2018;7(2):196-206.
(2)Cahn P et al. Lancet HIV. 2017;4(11):e486-e494,
使用方法
本剤の電子添文には、以下のとおり記載されています。
6. 用法及び用量
通常、成人にはラルテグラビルとして400mgを1日2回経口投与する。本剤は、食事の有無にかかわらず投与できる。なお、投与に際しては、必ず他の抗HIV薬と併用すること。
一般に高齢者では、肝、腎又は心機能が低下し、合併症を有している又は他の薬剤を併用している場合が多いので、注意して投与して下さい。
<引用>
電子添文
本剤の電子添文には、以下のとおり記載されています。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
ラット及びウサギにおける高用量投与で、胎盤移行が認められている。また、ラットにおける高用量投与で、過剰肋骨が報告されている。
9.6 授乳婦
授乳を避けさせること。
動物実験(ラット)で乳汁中へ移行することが報告されている。ラルテグラビルがヒトの乳汁中に移行するか否かは不明である。乳汁を介してHIV母児感染の可能性がある。
小児等を対象とした臨床試験は実施していません。
<引用>
電子添文
過量投与によるデータは限られています。
本剤1,600mg の単回投与及び本剤800mg 1日2回の反復投与の高用量について検討しましたが、毒性は認められていません。また、1,800mg の偶発的投与がありましたが、毒性は認められていません。過量投与の場合には、標準的な支持処置(消化管からの未吸収物質の除去、心電図測定を含む臨床的モニタリング、必要に応じた支持療法など)を実施するのが適切です。血液透析による本剤除去の程度は不明です。
<引用>
インタビューフォーム
気がついた時、すぐに1回分を飲んでください。ただし、次の通常服用する時間が近い場合には飲まずに、次の通常の服用時間に1回分を飲んでください。絶対に、2回分を一度に飲んではいけません。
<引用>
くすりのしおり
電子添文には、「血液透析によるラルテグラビル除去の程度は不明のため、透析実施前には本剤の投与を避けること。」と記載されています。
血液透析を施行しているHIV患者におけるアイセントレス®400mg 1日2回の薬物動態を検討した2例の症例報告では、血中濃度は投与後の時間に依存し、血液透析の影響を受けず、血液透析がラルテグラビルの有効性及び安全性に影響を及ぼさないことが報告されています(1)。
また、血液透析によるラルテグラビル除去の程度を検討した2例の症例報告においては、症例1で5.5%、9.1 mL/min、症例2で9.5%、19.1 mL/minと除去の程度はわずかであり、血液透析を施行しているHIV患者におけるラルテグラビルの用量調節は不要と述べています(2)。
<引用>
(1) Yanagisawa K et al. AIDS. 2016;30(6):970-972.
(2) Moltó J et al. Antimicrob Agents Chemother. 2010;54(7):3047-3048.
アイセントレス®錠400mgを分包、又は他剤と一包化した際の安定性について検討していませんので、本剤を分包、又は他剤と一包化することはおすすめしていません。
【適応外】
本剤を簡易懸濁して投与することは、承認外の用法となります。
簡易懸濁にて投与した際の薬物動態、有効性、安全性は検討していませんので、おすすめしていません。
簡易懸濁後の安定性データはありません。
【適応外】
本剤を粉砕して投与することは、承認外の用法となります。
粉砕して投与した際の薬物動態、有効性、安全性は検討していませんので、おすすめしていません。
粉砕後の安定性データはありません。
【適応外】
本剤を分割して投与することは、承認外の用法となります。
錠剤分割後の安定性について検討していませんので、おすすめしていません。
錠剤に割線はありません。
安全性
主な副作用として、下痢、悪心、疲労、体脂肪の再分布/蓄積、頭痛、浮動性めまい、不眠症、異常な夢、AST上昇、ALT上昇、総ビリルビン上昇、CK上昇などが報告されています。
<引用>
電子添文
電子添文の併用禁忌、併用注意には記載がありません。
マグネシウム、アルミニウム、鉄剤、亜鉛、サプリメント等とそれぞれ併用した際の影響についてはデータがなく不明です。
しかしながら、国内外のガイドライン(1)(2)において、アイセントレス®などインテグラーゼ阻害剤(INSTI)は、2価金属などの多価陽イオンを含む薬物、食品、又はサプリメントと相互作用を引き起こしてINSTIの吸収が低下する可能性が指摘されており、INSTIの食後服用の確認や服用間隔をあけるなど、併用には注意したほうがよいと考えられます。
電子添文では「水酸化マグネシウム及び水酸化アルミニウム含有制酸剤」が併用注意となっていますので、念のためウイルス量の推移にご注意ください。
<引用>
(1)厚生労働省研究班発行.抗HIV治療ガイドライン
(2)米国保健福祉省(DHHS)発行. HIVを保有する成人及び青少年における抗レトロウイルス薬の使用に関するガイドライン
電子添文の併用禁忌、併用注意には記載がありません。
酸化マグネシウムと併用した際の影響についてはデータがなく不明です。
しかしながら、国内外のガイドライン(1)(2)において、アイセントレス®などインテグラーゼ阻害剤(INSTI)は、2価金属などの多価陽イオンを含む薬物、食品、又はサプリメントと相互作用を引き起こしてINSTIの吸収が低下する可能性が指摘されており、INSTIの食後服用の確認や服用間隔をあけるなど、併用には注意したほうがよいと考えられます。
電子添文では「水酸化マグネシウム及び水酸化アルミニウム含有制酸剤」が併用注意となっていますので、念のためウイルス量の推移にご注意ください。
<引用>
(1)厚生労働省研究班発行.抗HIV治療ガイドライン
(2)米国保健福祉省(DHHS)発行. HIVを保有する成人及び青少年における抗レトロウイルス薬の使用に関するガイドライン
アイセントレス®では薬物動態変化に対し、臨床的に意味のある変化であるかどうかを判断するための、Clinical boundが定められています。HIV RNA量との相関解析の結果、有効性の判断に最も適切であるとされたのがトラフ濃度であり、有効性の面からはCminを維持できるかどうかで判断されます。
アイセントレス®錠400 mg 1日2回投与では、Cminの90%信頼区間の下限 >0.4(すなわち60%未満の減少)までが有効性に対し臨床的に意味のある影響を及ぼさない曝露量変化として許容しています(1)。
アイセントレス®錠400 mg 1日2回と炭酸カルシウムの併用時では、本剤のCmax、AUCの変動は水酸化アルミニウム/水酸化マグネシウム併用時よりも影響が大きいように見えるものの、Cmin>0.4 を維持(2)できたことから、用量調整の必要なく併用可能とされました。
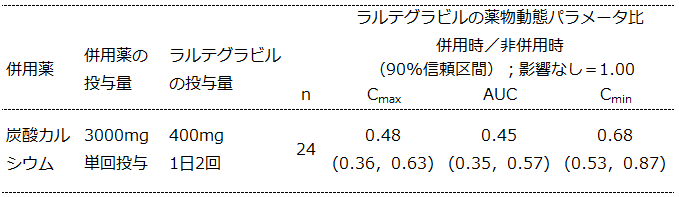
<引用>
(1)アイセントレス錠400mg 申請資料概要 2.7.2.1.3
(2)電子添文
[リファンピシン-併用注意]
リファンピシンとの併用により本剤の血漿中濃度が低下する可能性があり、有効性が減弱するおそれがあります。
併用する際は、注意してご使用ください。
アイセントレス®400mg 1日2回 (及び800mg 1日2回※)とUGT1A1の誘導作用を有するリファンピシンとの臨床薬物相互作用試験の結果、臨床的に意味のあるラルテグラビルの血漿中濃度低下が認められました(1)。
<ガイドライン>
厚生労働科学研究の研究班による抗HIV治療ガイドラインでは、アイセントレス®400mg 1日2回投与に対し、『リファンピシンと併用する場合、ラルテグラビルを倍量すなわち800mg 1日2回※投与にするとAUC、Cmaxは維持されるので併用禁忌とはならないが、トラフ値が低値となる可能性があることを知っておかなければならない。リファブチンとラルテグラビルの併用は可能であり、ラルテグラビルは常用量でよい。』とされています(2)。
※800mg 1日2回:承認された用法・用量ではありません。
<引用>
(1)Wenning LA et al. Antimicrob Agents Chemother. 2009;53(7):2852-2856.
(2)厚生労働科学研究班発行. 抗HIV治療ガイドライン.
[併用注意]
アイセントレス®では薬物動態変化に対し、臨床的に意味のある変化であるかどうかを判断するための、Clinical boundが定められています。HIV RNA量との相関解析の結果、有効性の判断に最も適切であるとされたのがトラフ濃度であり、有効性の面からはCminを維持できるかどうかで判断されます。
アイセントレス®錠400mg 1日2回投与では、Cminの90%信頼区間の下限 >0.4(すなわち60%未満の減少)までが有効性に対し臨床的に意味のある影響を及ぼさない曝露量変化として許容しています(1)。
アイセントレス®錠400mg 1日2回投与では、内服前後6時間以内でのマグネシウム/アルミニウム含有制酸剤の併用においてラルテグラビルのCminの90%信頼区間の下限が0.4より低かったことから、当該用法用量での本剤の有効性が減弱するおそれがあるため、投与前後6時間以内の水酸化アルミニウム/水酸化マグネシウムとの併用を併用注意に設定しました。
<ラルテグラビルの薬物動態に及ぼす水酸化アルミニウム/水酸化マグネシウムの影響(2)>
薬剤の投与量:
ラルテグラビル:400mg1日2回
併用薬(水酸化アルミニウム/水酸化マグネシウム):1600mg/1600mg
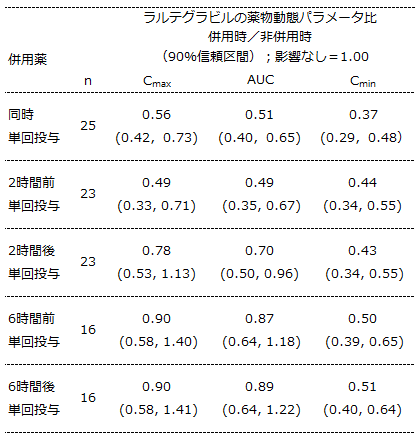
<引用>
(1)アイセントレス錠400mg 申請資料概要 2.7.2.1.3
(2)電子添文