長期投与試験
[臨床試験] 国内第Ⅲ相非盲検非対照長期投与試験
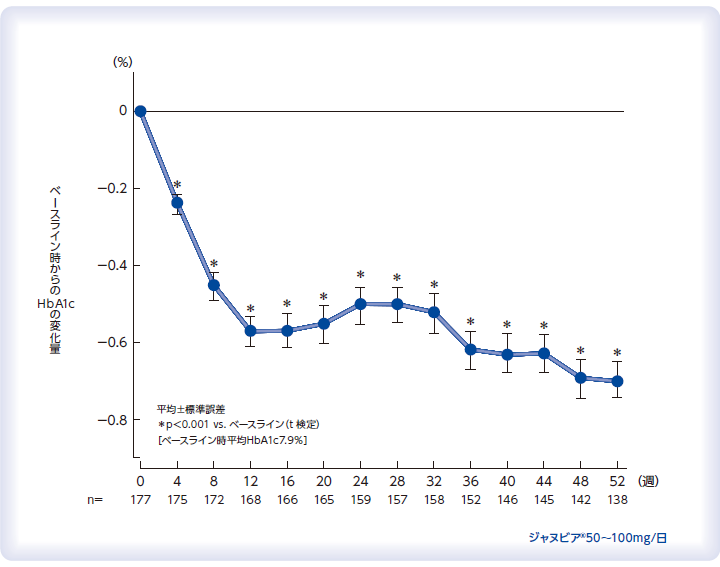
ジャヌビア®の52週間投与によるHbA1cの推移
国内第Ⅲ相非盲検非対照長期投与試験(投与52週時まで)
【使用上の注意(抜粋)】
8. 重要な基本的注意
8.2 本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、常に投与継続の必要性について注意を払うこと。本剤を3ヵ月投与しても効果が不十分な場合、より適切と考えられる治療への変更を考慮すること。
本剤のご使用にあたり、【禁忌】等その他項目は電子添文をご参照ください。
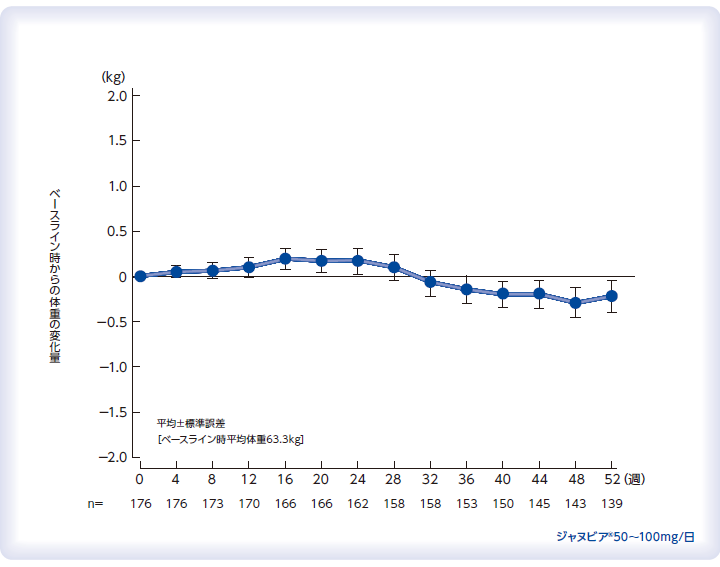
体重に対する影響(参考情報)
国内第Ⅲ相非盲検非対照長期投与試験(投与52週時まで)
Odawara M et al. Diabetol Int 2011; 2(2): 94-105.
本試験はMSDの資金提供により行われた。著者にMSD社員を含む。
【目的】
ジャヌビア®50mg又は100mg(増量時)を1日1回経口投与した際の治療期52週後までの安全性を検討する。
【試験】
非盲検非対照長期投与試験
【対象】
食事/運動療法の実施のみでは血糖コントロール不十分な2型糖尿病患者[HbA1c6.9%以上10.5%未満、空腹時血糖値270mg/dL以下]177例[有効性FAS解析対象175例(LOCFなし)]
【方法】
ジャヌビア®50mgを1日1回朝食前に52週間経口投与した。来院日の検査においてHbA1c 7.4%以上、又は空腹時血糖値140mg/dL以上であった患者に対し、次回来院時にジャヌビア®を100mgに増量した。ただし、増量は16~40週までの来院日に実施した(52週時までに100mgに増量した患者112例)。
【評価項目】
<主要評価項目>治療期52週後までのHbA1c、食後2時間血糖値、空腹時血糖値の変化量
<安全性>バイタルサイン(体重、血圧、脈拍数)、心電図、臨床検査値、有害事象
【解析計画】
有効性の解析は、治療期28週及び52週後までのデータそれぞれに対し、HbA1c、食後2時間血糖値、空腹時血糖値の実測値及び変化量について評価時期ごとに要約統計量を算出し、経時的推移について検討した。投与前後の比較については対応のある t 検定を用いた。
安全性
本試験において臨床症状の副作用は18/177例(10.2%)に認められ、主なものは腹痛2件(1.1%)、腹部不快感、便秘、胃ポリープ、萎縮性胃炎、逆流性食道炎、胃不快感、口内炎、浮動性めまい、感覚鈍麻、意識消失などが各1件(0.6%)であった。臨床検査値の副作用は4/176例(2.3%)に認められ、主なものはヘマトクリット減少、ヘモグロビン減少、血小板減少、赤血球減少が各1件(0.6%)であった。重篤な副作用は1例1件(意識消失)、投与中止に至った副作用は2例2件(意識消失、鉄欠乏性貧血)で認められた。死亡は1例(急性心不全)に認められた。
本剤のご使用にあたり、【禁忌】等その他項目は電子添文をご参照ください。