国際共同第Ⅲ相試験:KEYNOTE-A18試験(日本人集団)
子宮頸癌:国際共同臨床試験成績
国際共同第Ⅲ相試験<KEYNOTE-A18試験>(日本人集団)
1)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-A18試験)
2)Lorusso D et al. Lancet 2024; 403: 1341-1350
本試験はMSD社の資金提供により行われた。著者のうち、Kan Li、Karin Yamada、Sarper Toker、Stephen M Keefeは同社の社員である。
3)Lorusso D et al. Lancet 2024; 404: 1321-1332
Peng Liu、Karin Yamada、Sarper Toker、Stephen M Keefeは同社の社員である。
患者背景(日本人ITT集団)
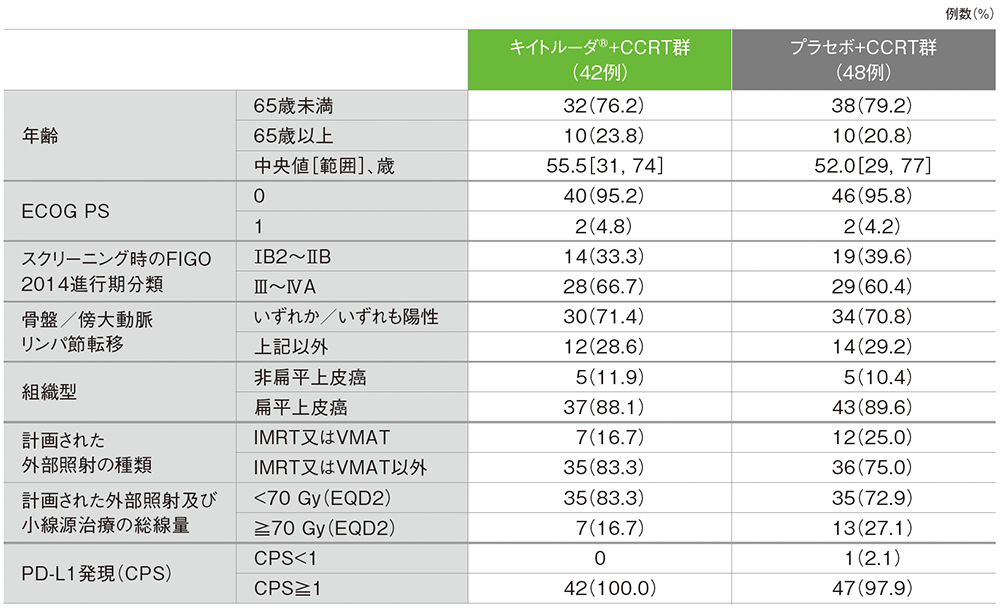
(データカットオフ日:2023年1月9日)
サブグループ解析:日本人集団における無増悪生存期間(PFS)、2年PFS率
■日本人集団における無増悪生存期間:PFS、2年PFS率


PFSのKaplan-Meier曲線(日本人ITT集団)
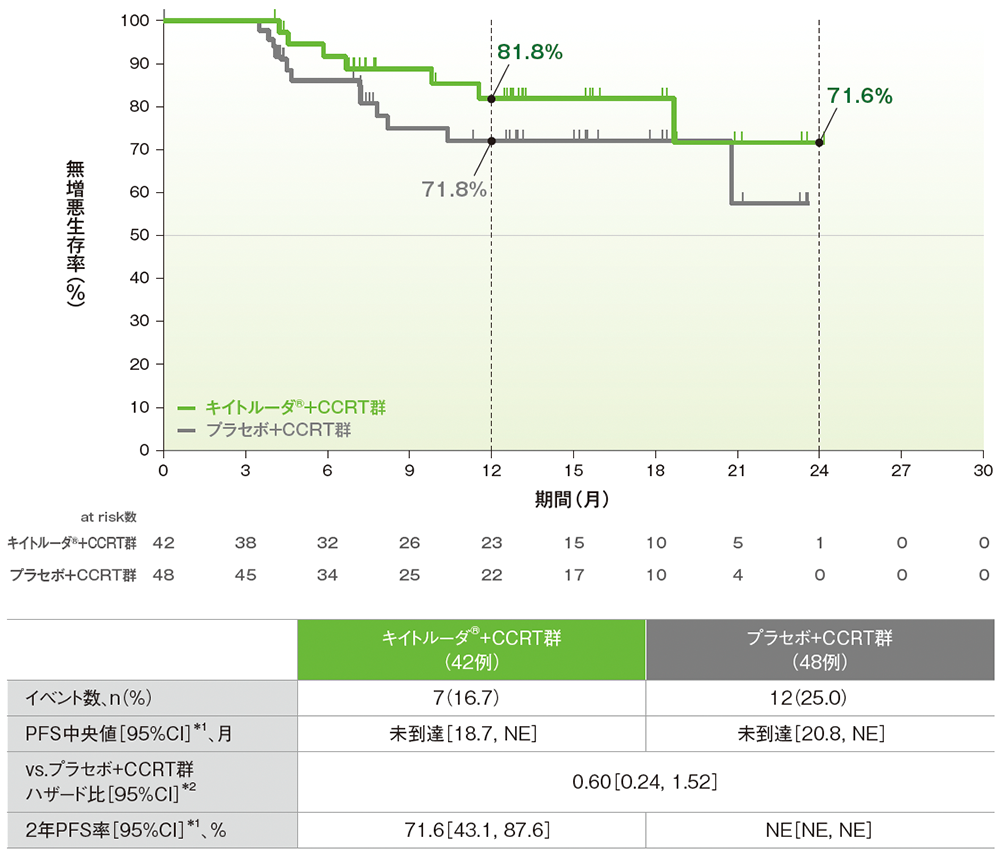
NE:Not Estimated
治験担当医師がRECISTガイドライン1.1版に基づき評価、又は(RECISTガイドライン1.1版に基づく画像上のPDが確認されていない場合)病理組織学的に確認したPDに基づく
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づく
(追跡期間中央値:キイトルーダ®+CCRT群 14.2ヵ月、プラセボ+CCRT群 15.2ヵ月、データカットオフ日:2023年1月9日)
サブグループ解析:日本人集団における全生存期間(OS)、3年OS率
■日本人集団における全生存期間:OS、3年OS率
OSのKaplan-Meier曲線(日本人ITT集団)
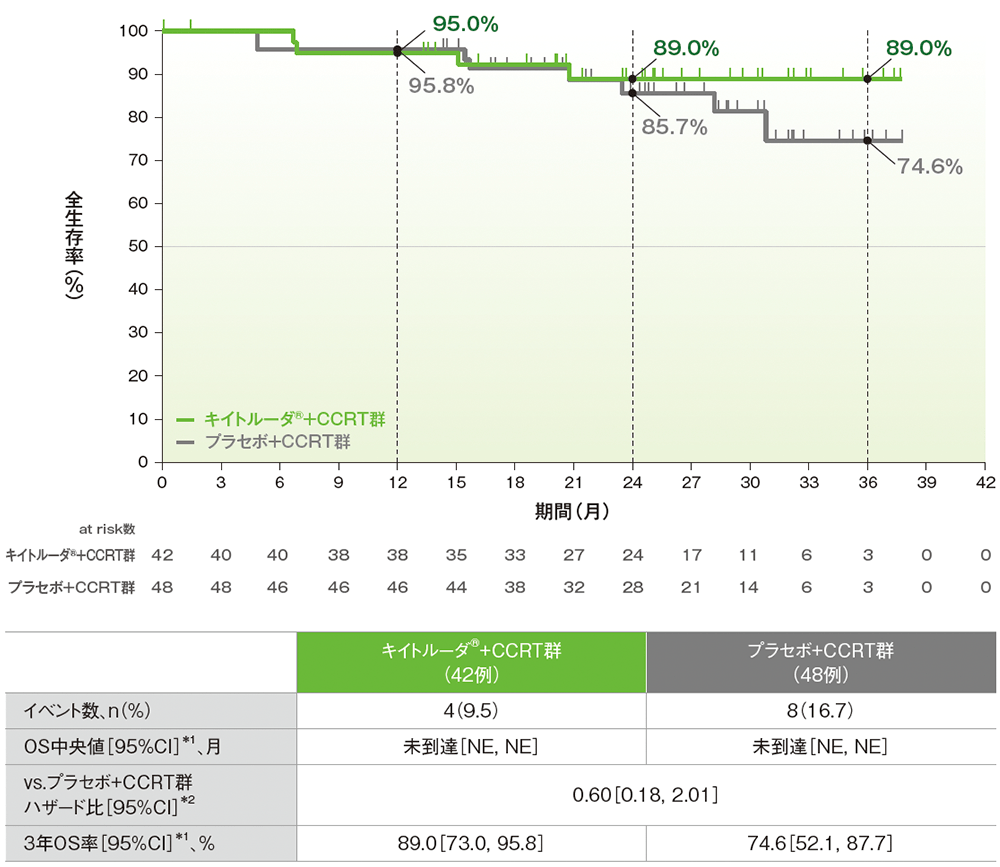
NE:Not Estimated
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づく
(追跡期間中央値:キイトルーダ®+CCRT群 26.1ヵ月、プラセボ+CCRT群 25.6ヵ月、データカットオフ日:2024年1月8日)
サブグループ解析:日本人集団における奏効率(ORR)
■日本人集団における奏効率:ORR
ORR(日本人ITT集団のうち、組入れ時に測定可能病変を有する患者集団)
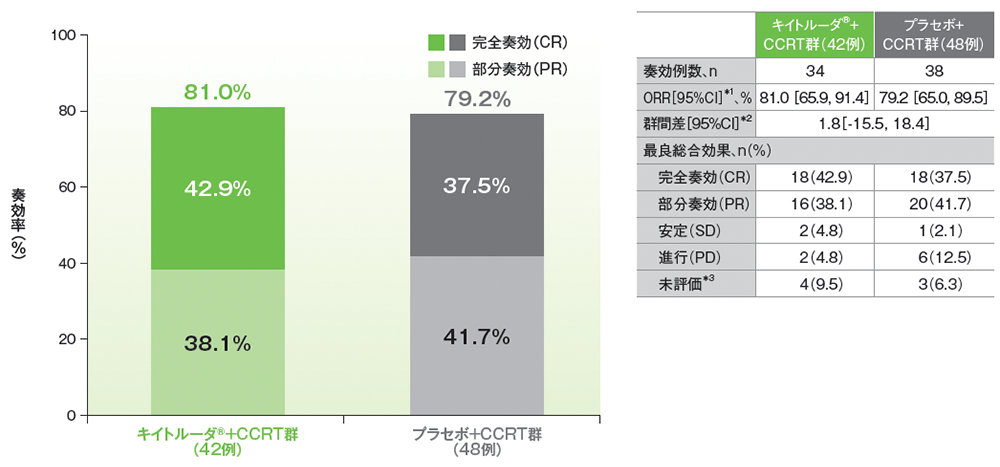
*1 二項分布の確率計算による正確法
*2 Miettinen and Nurminen法
*3 ベースライン後の画像評価がなかった患者
治験担当医師によるRECISTガイドライン1.1版に基づいた評価
(追跡期間中央値:キイトルーダ®+CCRT群 14.2ヵ月、プラセボ+CCRT群 15.2ヵ月、データカットオフ日:2023年1月9日)
日本人集団 安全性(第1回中間解析)
(日本人APaT集団)
キイトルーダ®+CCRT群の副作用は41/41例(100.0%)に認められました。主な副作用(発現率20%以上)は、下痢、悪心 各33例(80.5%)、好中球数減少26例(63.4%)、貧血25例(61.0%)、白血球数減少23例(56.1%)、血小板数減少17例(41.5%)、便秘16例(39.0%)、倦怠感、食欲減退 各14例(34.1%)、リンパ球数減少12例(29.3%)、発熱、味覚不全 各10例(24.4%)でした。重篤な副作用は8例(19.5%)に認められ、内訳は、食欲減退、下痢 各2例(4.9%)、貧血、出血性膀胱炎、甲状腺機能亢進症、肝障害、倦怠感、悪心、好中球数減少、発熱 各1例(2.4%)でした。いずれかの治療の中止に至った副作用は11例(26.8%)に認められ、内訳は、好中球数減少5例(12.2%)、甲状腺機能亢進症、無痛性甲状腺炎、下痢、肝障害、サルコイドーシス、肝酵素上昇、腎障害、多形紅斑 各1例(2.4%)でした。本試験において死亡に至った副作用は認められませんでした。
プラセボ+CCRT群では、副作用は48/48例(100.0%)に認められました。主な副作用(発現率20%以上)は、下痢41例(85.4%)、悪心30例(62.5%)、好中球数減少27例(56.3%)、貧血25例(52.1%)、血小板数減少、白血球数減少 各23例(47.9%)、便秘18例(37.5%)、倦怠感、リンパ球数減少、食欲減退 各17例(35.4%)、アラニンアミノトランスフェラーゼ増加11例(22.9%)でした。重篤な副作用は6例(12.5%)に認められ、内訳は、貧血2例(4.2%)、下痢、好中球数減少、急性腎障害、アラニンアミノトランスフェラーゼ増加、多形紅斑、発熱性好中球減少症、肝機能異常、低カリウム血症、低ナトリウム血症、腎障害 各1例(2.1%)でした。いずれかの治療の中止に至った副作用は10例(20.8%)に認められ、内訳は、アラニンアミノトランスフェラーゼ増加、血中クレアチニン増加、好中球数減少、腎機能障害 各2例(4.2%)、悪心、肝機能異常、急性腎障害 各1例(2.1%)でした。本試験において死亡に至った副作用は認められませんでした。
■主な副作用(いずれかの投与群で発現率5%以上)
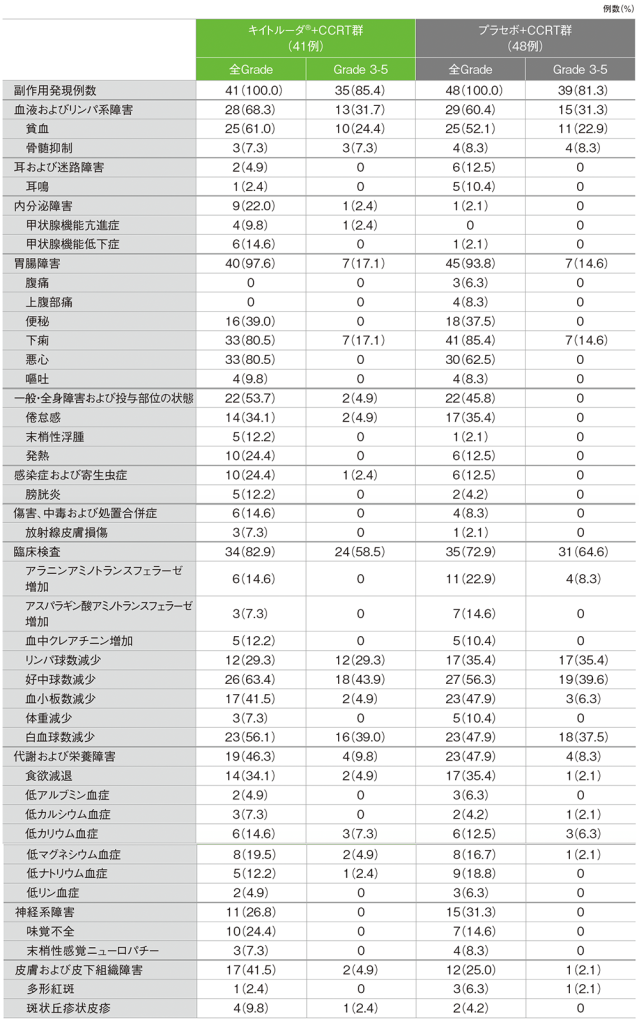
MedDRA/J v25.1、GradeはCTCAE v5.0(データカットオフ日:2023年1月9日)
日本人集団 安全性(第2回中間解析)
(日本人APaT集団)
キイトルーダ®+CCRT群の副作用は41/41例(100.0%)に認められました。主な副作用(発現率20%以上)は、下痢、悪心 各33例(80.5%)、好中球数減少26例(63.4%)、貧血25例(61.0%)、白血球数減少23例(56.1%)、血小板数減少17例(41.5%)、便秘16例(39.0%)、食欲減退、倦怠感 各14例(34.1%)、リンパ球数減少12例(29.3%)、味覚不全11例(26.8%)、発熱10例(24.4%)でした。重篤な副作用は11例(26.8%)に認められ、内訳は、食欲減退、下痢 各2例(4.9%)、副腎機能不全、貧血、出血性膀胱炎、薬疹、甲状腺機能亢進症、肝障害、倦怠感、悪心、好中球数減少、発熱、続発性副腎皮質機能不全 各1例(2.4%)でした。いずれかの治療の中止に至った副作用は12例(29.3%)に認められ、内訳は、好中球数減少5例(12.2%)、甲状腺機能亢進症、無痛性甲状腺炎、下痢、肝障害、サルコイドーシス、肝酵素上昇、腎障害、薬疹、多形紅斑 各1例(2.4%)でした。本試験において死亡に至った副作用は認められませんでした。
プラセボ+CCRT群では、副作用は48/48例(100.0%)に認められました。主な副作用(発現率20%以上)は、下痢41例(85.4%)、悪心30例(62.5%)、好中球数減少27例(56.3%)、貧血25例(52.1%)、白血球数減少、血小板数減少 各23例(47.9%)、便秘19例(39.6%)、食欲減退、倦怠感、リンパ球数減少 各17例(35.4%)、アラニンアミノトランスフェラーゼ増加11例(22.9%)でした。重篤な副作用は6例(12.5%)に認められ、内訳は、貧血2例(4.2%)、下痢、好中球数減少、急性腎障害、アラニンアミノトランスフェラーゼ増加、多形紅斑、発熱性好中球減少症、肝機能異常、低カリウム血症、低ナトリウム血症、腎障害 各1例(2.1%)でした。いずれかの治療の中止に至った副作用は10例(20.8%)に認められ、内訳は、アラニンアミノトランスフェラーゼ増加、血中クレアチニン増加、好中球数減少、腎機能障害 各2例(4.2%)、悪心、肝機能異常、急性腎障害 各1例(2.1%)でした。本試験において死亡に至った副作用は認められませんでした。
■主な副作用(いずれかの投与群で発現率5%以上)
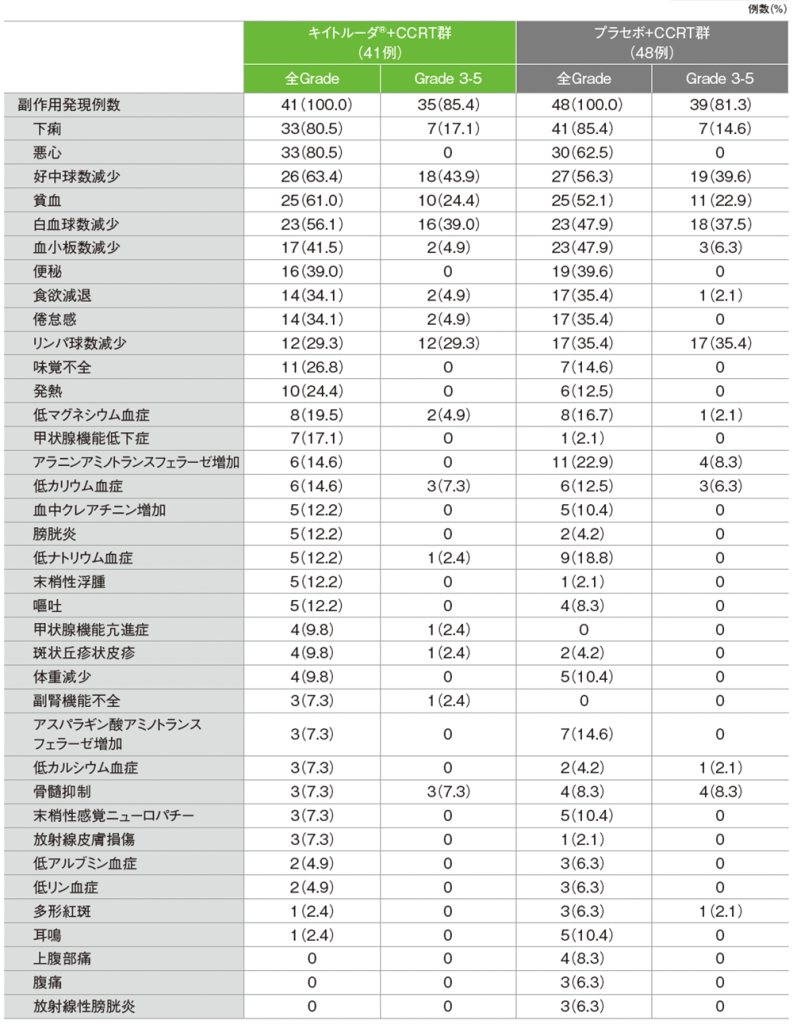
MedDRA/J v26.1、GradeはCTCAE v5.0(データカットオフ日:2024年1月8日)
■免疫関連など特に注目すべき有害事象(日本人APaT集団)
(いずれかの投与群で発現)
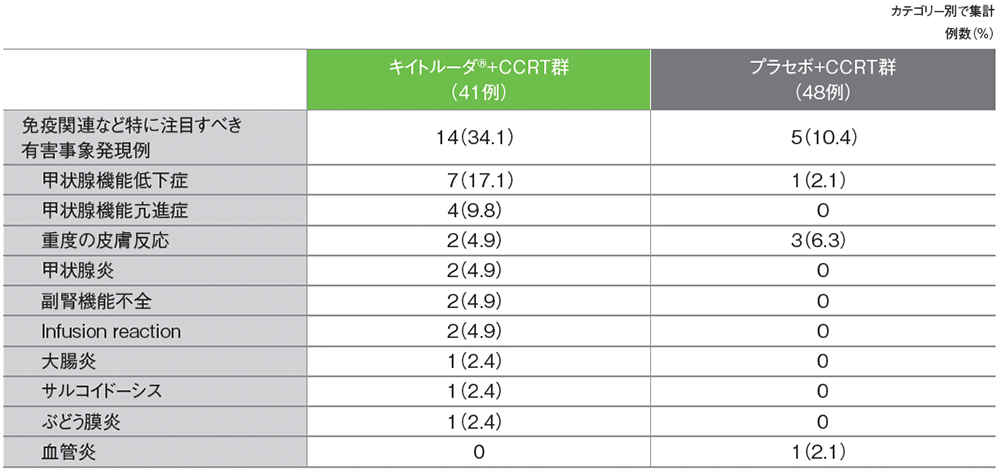
MedDRA/J v25.1(データカットオフ日:2023年1月9日)
■免疫関連など特に注目すべき有害事象(日本人APaT集団)
(いずれかの投与群で発現)
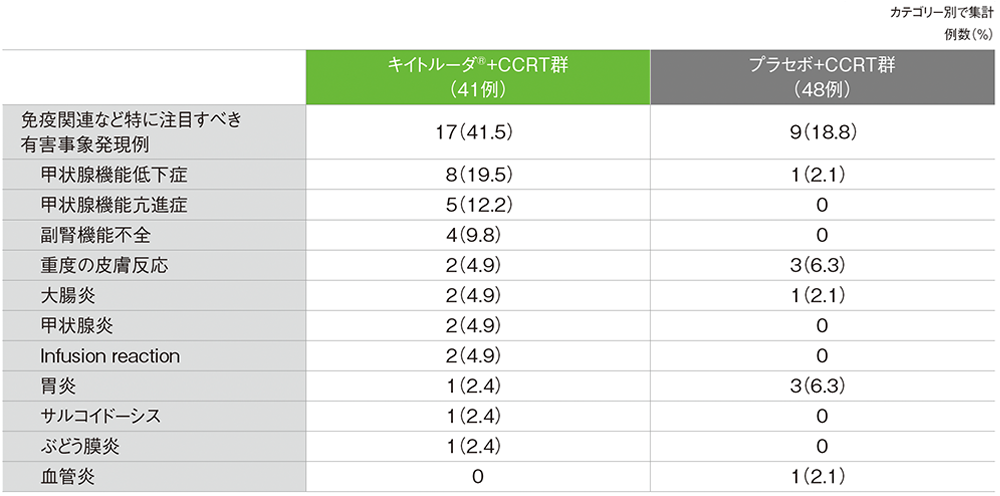
MedDRA/J v26.1(データカットオフ日:2024年1月8日)
