KEYNOTE-204試験(日本人集団)
古典的ホジキンリンパ腫:国際共同臨床試験成績:国際共同第Ⅲ相試験<KEYNOTE-204試験>(日本人集団) ※日本人集団については、治験薬投与後の同種造血幹細 […]
承認時評価資料:国際共同第Ⅱ相試験(KEYNOTE-087試験)
Chen R et al. J Clin Oncol 2017; 35: 2125-2132
Chen R et al. Blood 2019; 134: 1144-1153
本試験はMSD社の支援を受け行われた。Robert ChenはMSD社から顧問料などを受領している。また、著者のうち、Yinghua Zhang、Alejandro D. Ricart、Arun BalakumaranはMSD社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。
Armand P, et al. Blood 2023; 142: 878-886
本試験はMSD社の支援を受け行われた。Philippe ArmandはMSD社から顧問料などを受領している。また、著者のうち、Jianxin Lin、
Eunhee Kim、Samhita Chakraborty、Patricia MarinelloはMSD社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。
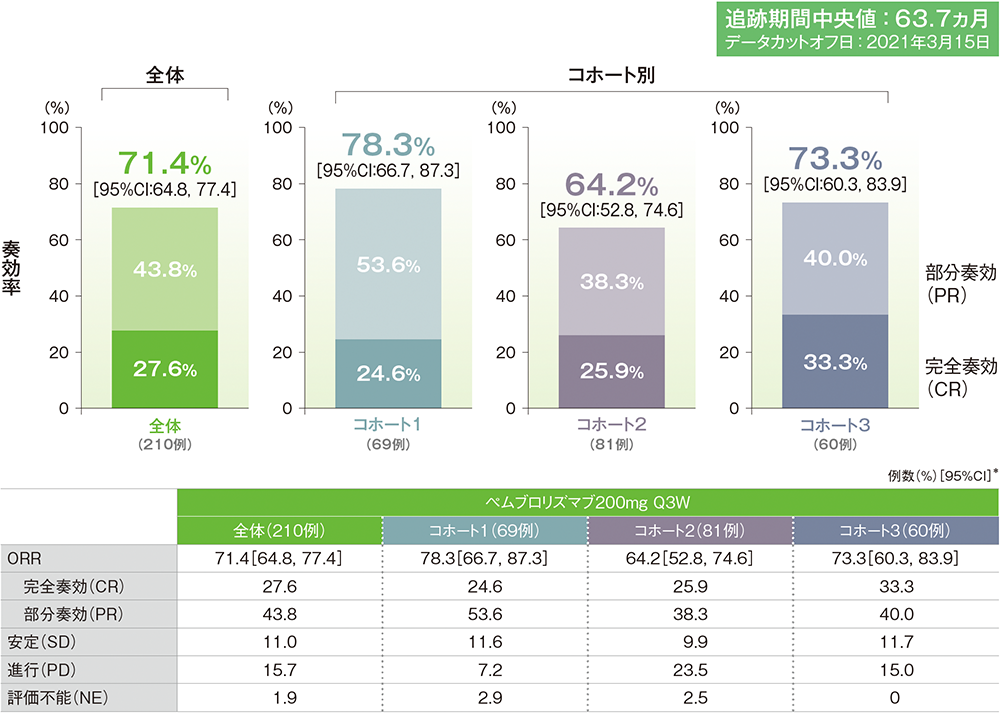
【目的】再発又は難治性の古典的ホジキンリンパ腫患者におけるキイトルーダ®の有効性及び安全性を検討する。
【デザイン】国際共同非無作為化第Ⅱ相試験
【対象】再発又は難治性の古典的ホジキンリンパ腫患者210例(日本人患者10例を含む)
【方法】疾患の状態及び前治療歴により3つのコホートに組み入れ、キイトルーダ®200mgを3週間間隔(Q3W)で点滴静注した。キイトルーダ®の投与は疾患進行(PD)又は許容できない毒性が認められるまで、最長24ヵ月継続した。
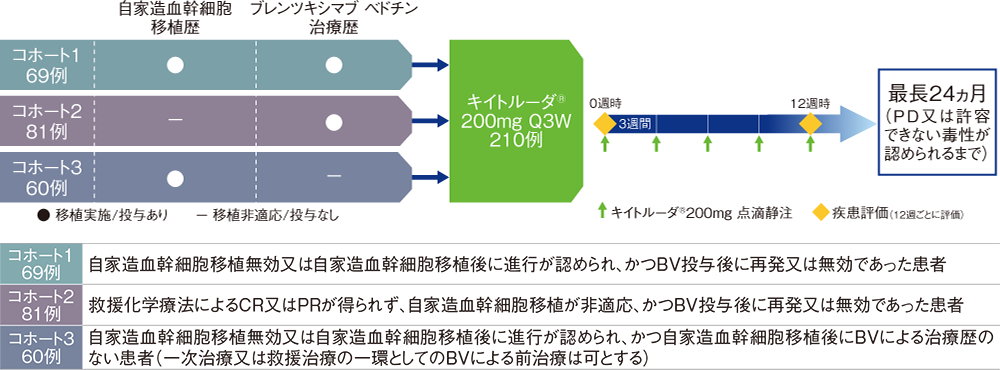
BV:ブレンツキシマブ ベドチン CR:完全奏効 PR:部分奏効 Q3W:3週間間隔投与
【評価項目】主要評価項目: 奏効率(overall response rate; ORR)、安全性
副次評価項目: 完全奏効率(complete remission rate; CRR)、奏効期間(duration of response; DOR)、無増悪生存期間(progression free survival; PFS)、全生存期間(overall survival; OS)など
【判定基準】有効性評価は、盲検下独立中央判定によりIWGの効果判定基準(2007)に基づき評価した。
【解析計画】解析対象は有効性及び安全性ともにASaT集団*とし、各評価項目について全体集団及びコホート別での解析を実施した。また、有効性をさらに検討するため前治療数が異なる次のサブグループでORR及びCRRを検討した。サブグループは、「前治療数3以上の治療後に再発した患者」「少なくとも1つの前治療に抵抗性であった患者」「primary refractory患者[一次治療に抵抗性であった患者]」「いずれの前治療に対しても抵抗性であった患者」「BV未治療の患者」などとした。
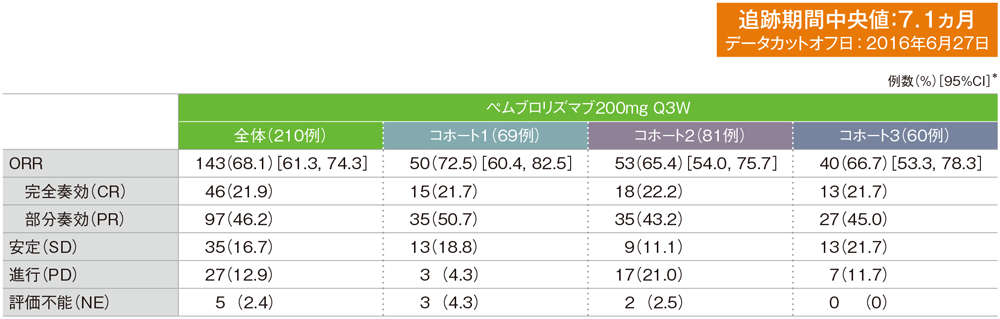
ORR及びCRRについては点推定値及びClopper-Pearsonによる正確な両側95%信頼区間(CI)を算出し、DOR、PFS及びOSについてはKaplan-Meier法を用いて推定した。ORRはヒストリカルコントロールから設定した値(ORR: 20%)を用いて、有意水準片側2.5%で二項分布に基づく正確検定を実施した。
ORRの主要解析は、最後に投与した患者の12週の評価を実施した時点、もしくは、投与を中止した時点で解析を実施し、その時点で副次評価項目の解析も実施した。さらに24週の評価を実施した時点、1年後及び2年後にも解析を実施し、有効性評価項目の結果を更新することとした。治験実施計画書に記載されていないが、日本人集団についても、ORR、DOR、PFS、OSについて算出し、評価資料として承認時に評価された。
*ASaT集団(All Subjects as Treated):治験薬を1回以上投与されたすべての患者
4. 効能又は効果(抜粋)
〇再発又は難治性の古典的ホジキンリンパ腫
5. 効能又は効果に関連する注意(抜粋)
〈再発又は難治性の古典的ホジキンリンパ腫〉
5.5 臨床試験に組み入れられた患者の前治療歴等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.12、17.1.13参照]
9. 特定の背景を有する患者に関する注意(抜粋)
9.1 合併症・既往歴等のある患者
9.1.3 臓器移植歴(造血幹細胞移植歴を含む)のある患者
本剤の投与により移植臓器に対する拒絶反応又は移植片対宿主病が発現するおそれがある。
15. その他の注意(抜粋)
15.1 臨床使用に基づく情報
15.1.2 臨床試験において、本剤による治療後に同種造血幹細胞移植が実施された症例で、重篤な移植片対宿主病等の移植関連合併症が認められた。
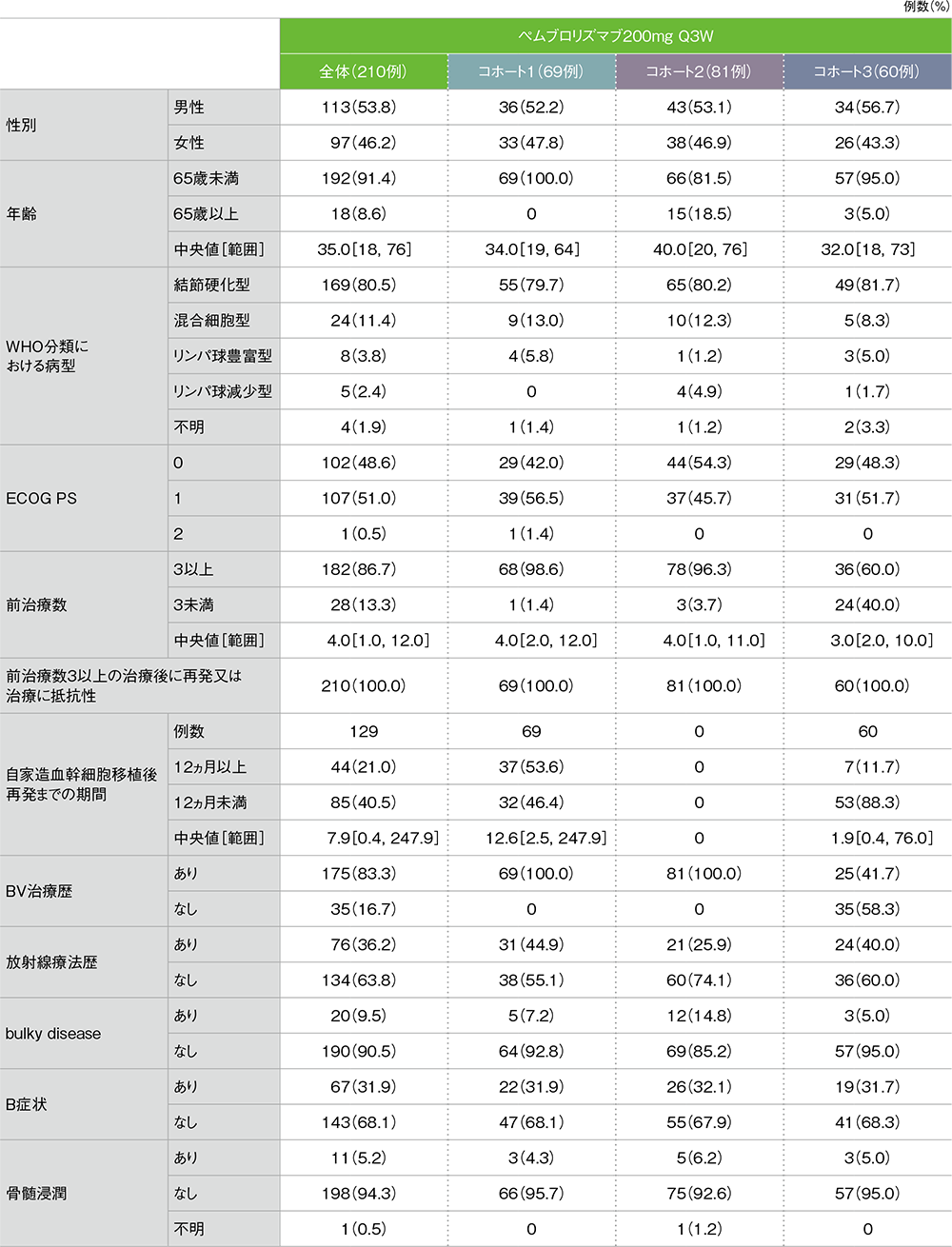
ECOG:eastern cooperative oncology group PS:performance status BV:ブレンツキシマブ ベドチン
*二項分布の確率計算による正確法
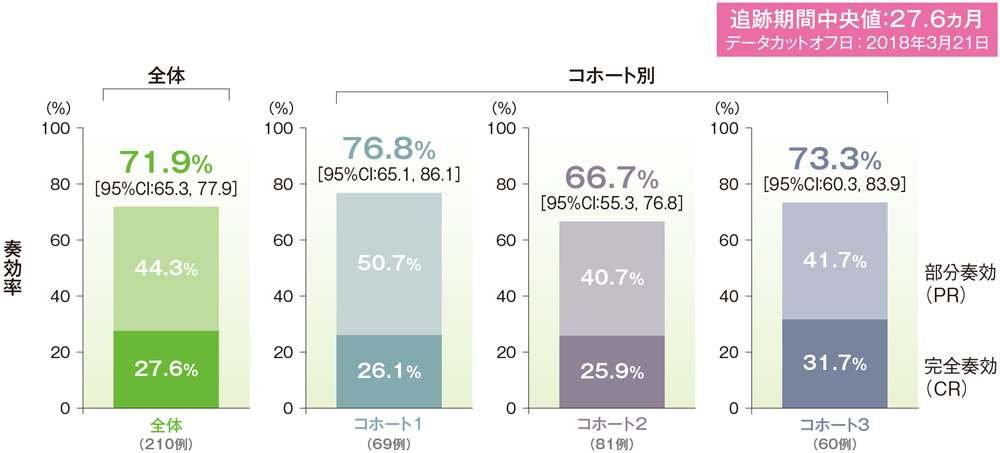

*二項分布の確率計算による正確法
*二項分布の確率計算による正確法
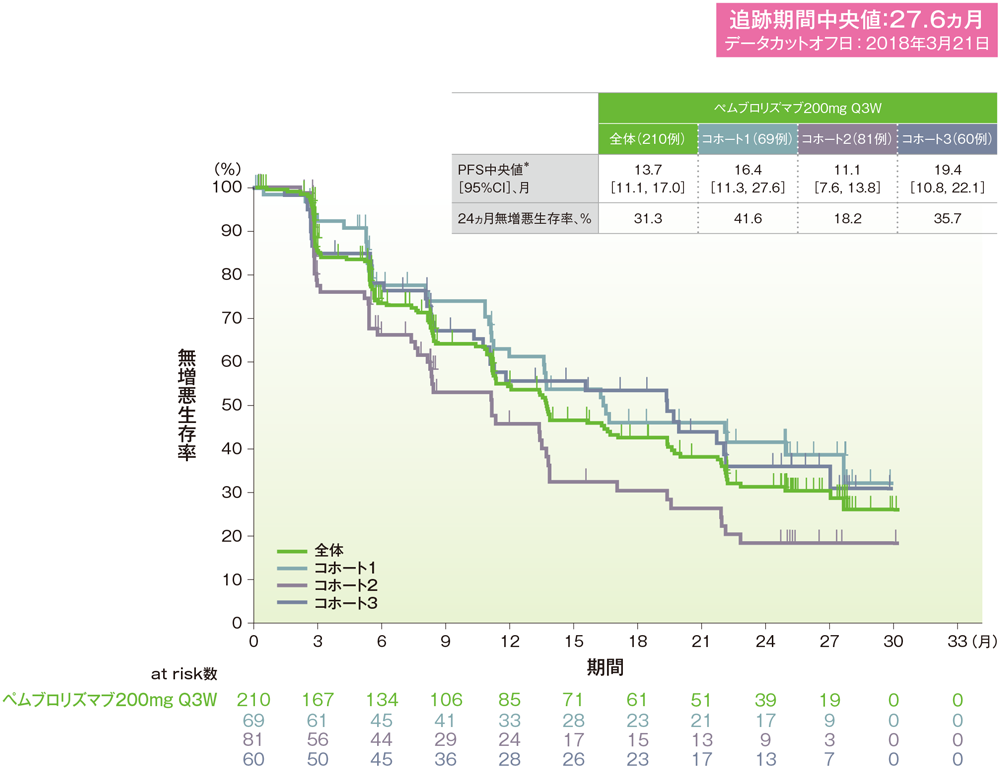
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく


*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
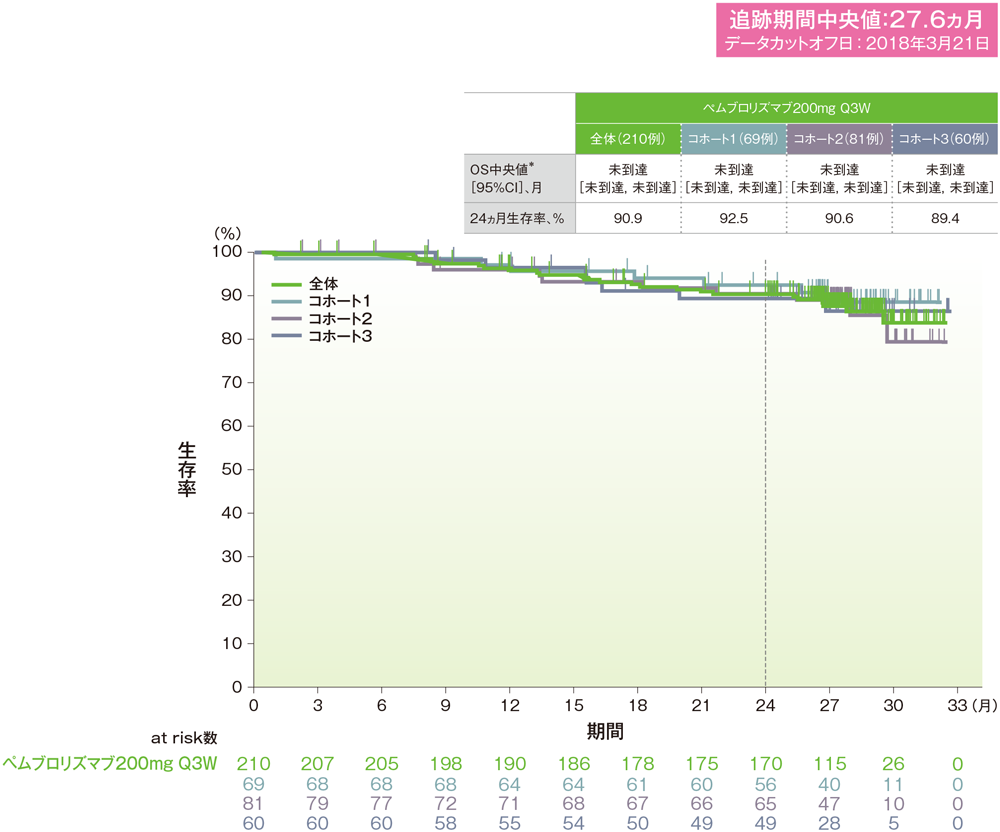
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく

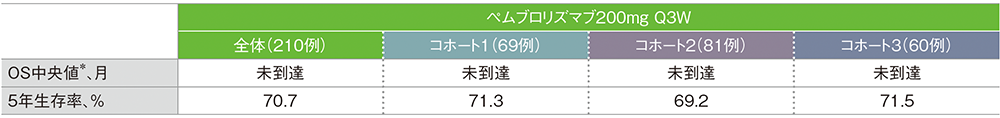
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
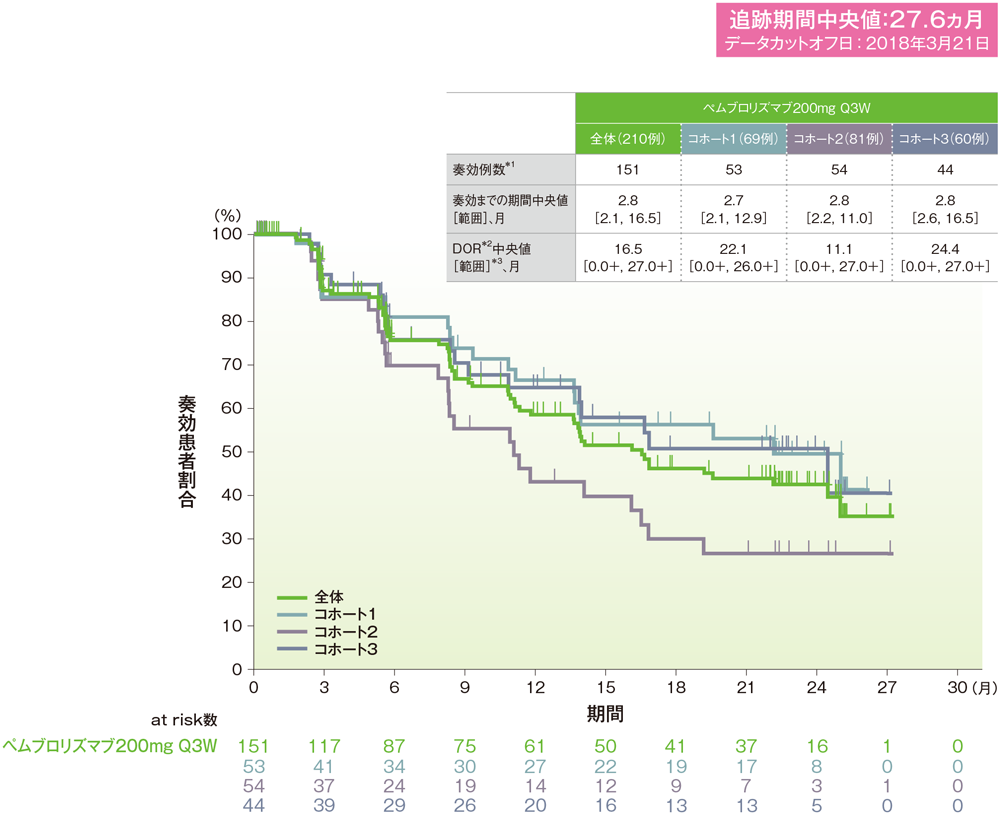
*1 CRあるいはPRが認められた患者
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 「+」は最後の疾患評価からPDがみられないことを示す

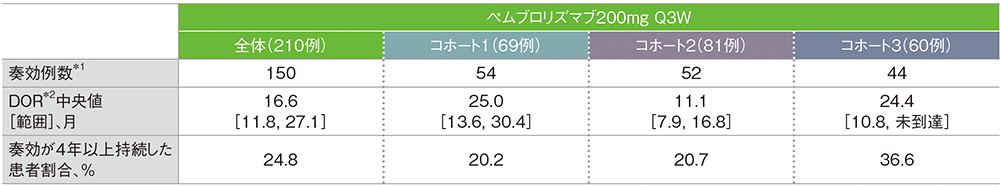
*1 CRあるいはPRが認められた患者
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく

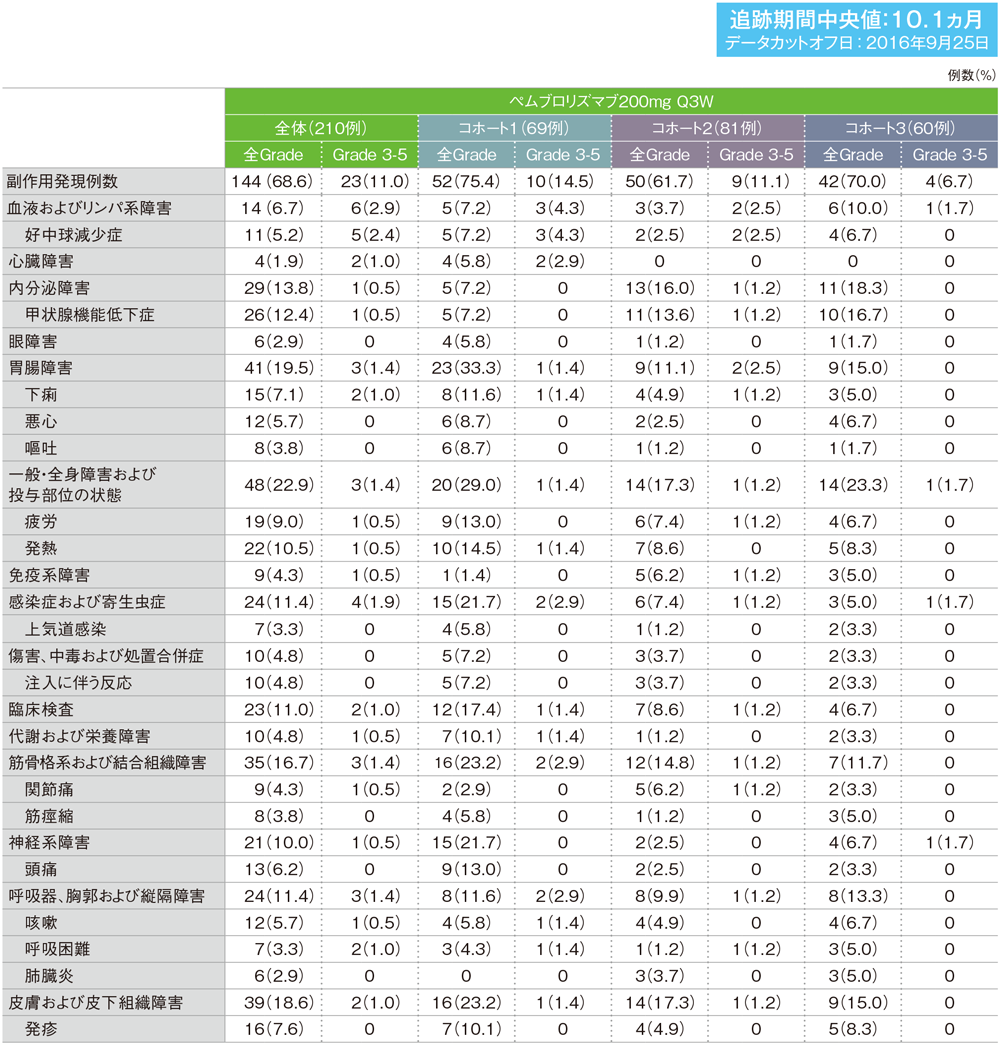
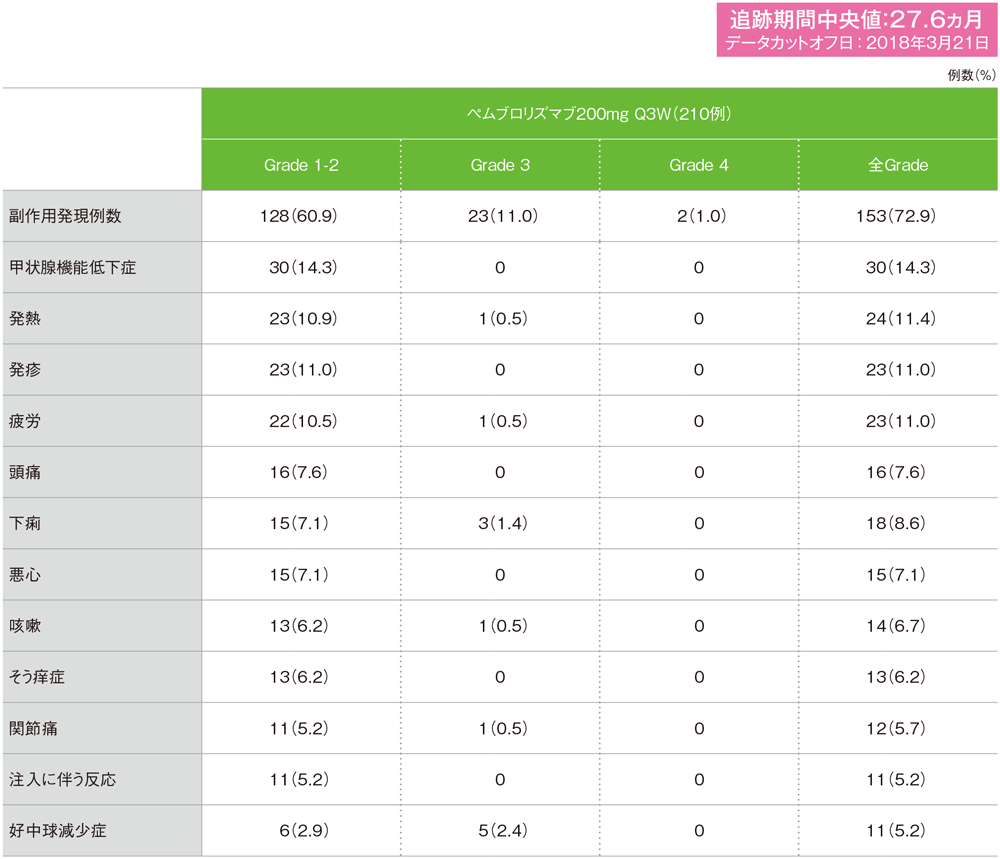
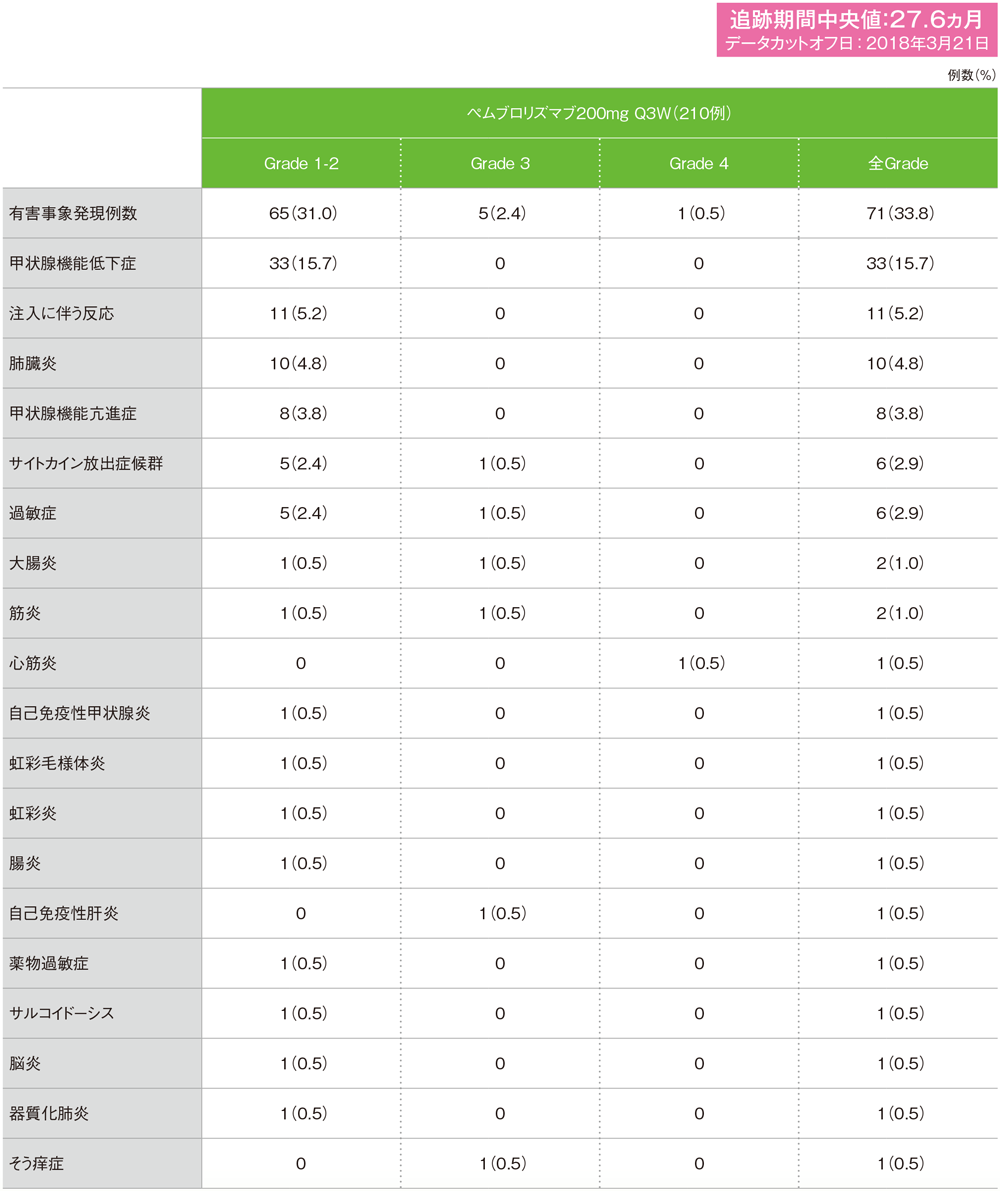
MedDRA/J version 19.0、GradeはCTCAE version 4.0


古典的ホジキンリンパ腫:国際共同臨床試験成績:国際共同第Ⅲ相試験<KEYNOTE-204試験>(日本人集団) ※日本人集団については、治験薬投与後の同種造血幹細 […]
古典的ホジキンリンパ腫:国際共同臨床試験成績:国際共同第Ⅲ相試験<KEYNOTE-204試験>(全体集団) 本試験はMSD社の資金提供により行われた。John […]
2月6日(金)9:00~11:00に、資材注文ページのメンテナンスを行います。その間、オンラインからの資材のご注文ができません。お電話にてご注文いただけますようお願いいたします。ご迷惑をおかけしますが、よろしくお願いいたします。
資材用注文専用ダイヤル:0120-024-262 (9:00 – 17:30 土日祝日・弊社休日を除く)
WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?