【胃癌】HER2陰性の治癒切除不能な進⾏・再発胃癌の1次治療におけるキイトルーダ®+化学療法の併⽤療法 適正使⽤のポイント KEYNOTE-859試験の結果より
キイトルーダ® は2024年5⽉、「治癒切除不能な進⾏・再発の胃癌」を効能⼜は効果として承認を取得いたしました。本動画では、HER2陰性の治癒切除不能な進⾏・再 […]
本併用療法は、一部承認外の用法及び用量による臨床試験も含めた臨床データパッケージで評価され、承認されました。本試験におけるキイトルーダ®単剤群のデータは国内未承認のため削除しています。
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-062試験)
Shitara K et al. JAMA Oncol 2020; 6: 1571-1580
本試験はMSD社の資金提供により行われた。著者にMSD社より顧問料などを受領している者が含まれる。著者にMSD社の社員が含まれる。
PD-L1陽性(CPS*1≧1)かつHER2陰性の進行・再発胃癌の1次治療における、キイトルーダ®単剤群*2、キイトルーダ®+化学療法群(キイトルーダ®と5-FU及びシスプラチンの併用〈FP〉、キイトルーダ®とカペシタビン及びシスプラチンの併用〈XP〉)の有効性及び安全性を化学療法群と比較検討する。
国際共同第Ⅲ相無作為化実薬対照多施設共同部分盲検試験[優越性と非劣性を検証する試験]
[第1回中間解析結果(データカットオフ日:2018年3月26日)、第2回中間解析結果(データカットオフ日:2018年9月26日)、最終解析結果(データカットオフ日:2019年3月26日)]
化学療法歴のない*3PD-L1陽性(CPS≧1)かつHER2陰性の進行・再発胃癌(胃腺癌又は食道胃接合部腺癌)患者763例(日本人103例を含む)
キイトルーダ®単剤群(キイトルーダ®200mgを各サイクルの1日目にQ3Wで点滴静注)、キイトルーダ®+化学療法群(キイトルーダ®200mgとシスプラチン80mg/m2を各サイクルの1日目にQ3Wで点滴静注、5-FU800mg/m2/日を各サイクルの1~5日目までQ3Wで持続静注、又はキイトルーダ®200mgとシスプラチン80mg/m2を各サイクルの1日目にQ3Wで点滴静注、カペシタビン1,000mg/m2を各サイクルの1~14日目まで1日2回Q3Wで経口投与)#1又は化学療法群[プラセボ(生理食塩水)とシスプラチン80mg/m2を各サイクルの1日目にQ3Wで点滴静注、5‐FU800mg/m2/日を各サイクルの1~5日目までQ3Wで持続静注、又はプラセボとシスプラチン80mg/m2を各サイクルの1日目にQ3Wで点滴静注、カペシタビン1,000mg/m2を各サイクルの1~14日目まで1日2回Q3Wで経口投与]#1に1:1:1の割合で無作為に割り付けた。6週間毎に画像検査による評価を行い、疾患進行又は許容できない毒性発現等まで投与を継続した。キイトルーダ®及びプラセボの投与期間は最大35サイクルまでとした。シスプラチンの投与期間は各国のガイドラインに従い6サイクルまでとしてよいが、5-FU/カペシタビンによる治療は治験実施計画書に従って継続することとした。
#1 キイトルーダ®+化学療法群及び化学療法群では、化学療法として5-FU+シスプラチン併用療法が施行された。地域のガイドラインに従い、シスプラチンの併用薬としてカペシタビンの使用も許容されたことから、治験担当医師は無作為割り付け前に5-FU又はカペシタビンのどちらを使用するかを決定した。
※本資材ではキイトルーダ®+化学療法群及び化学療法群の臨床成績を紹介します。
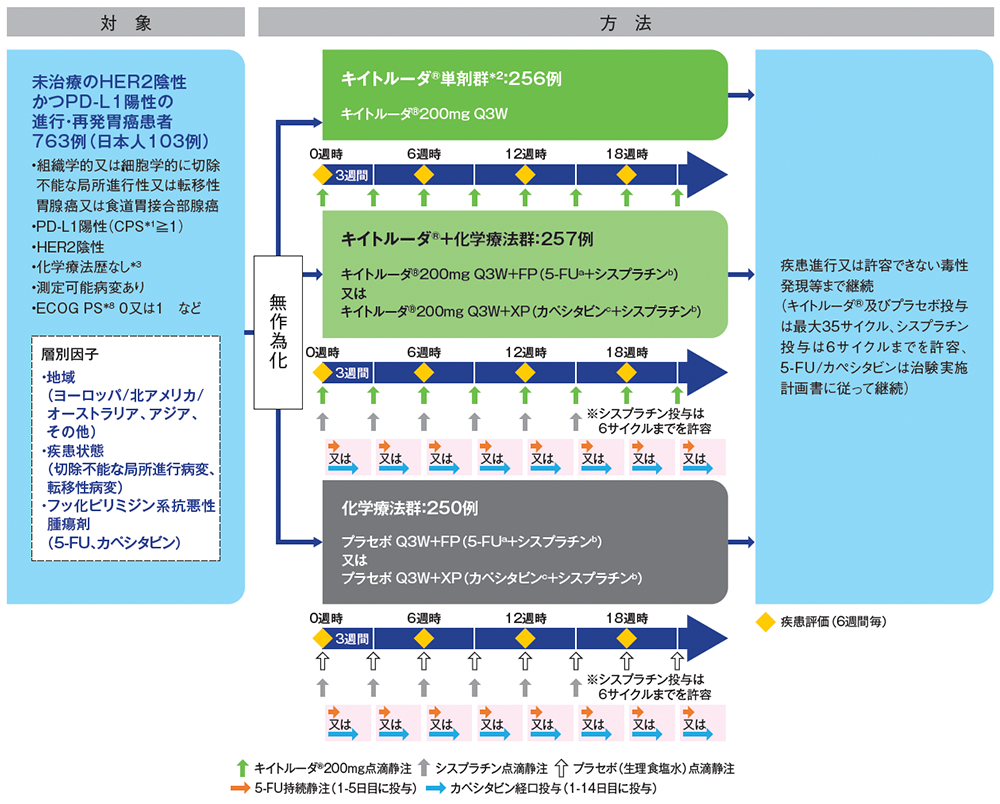
a:5-FU800mg/m2/日 Q3W 持続静注(各サイクルの1~5日目まで投与、21日を1サイクル)
b:シスプラチン80mg/m2 Q3W 点滴静注(各サイクルの1日目に投与、21日を1サイクル)
c:カペシタビン1,000mg/m2 Q3W 経口投与(各サイクルの1~14日目まで1日2回投与、21日を1サイクル)
主要評価項目
・ PD-L1陽性(CPS≧1及びCPS≧10)患者における全生存期間(overall survival; OS)#2
・ PD-L1陽性(CPS≧1)患者における無増悪生存期間(progression free survival; PFS)#2
副次評価項目
・ PD-L1陽性(CPS≧1)患者における奏効率(objective response rate; ORR)
・ PD-L1陽性(CPS≧1)患者における奏効期間(duration of response; DOR)
・ PD-L1陽性(CPS≧1)患者における健康関連QOLに関するPRO*4(EORTC QLQ-C30及びEORTC QLQ-STO22)
・ 安全性
探索的評価項目
・ 健康関連QOLに関するPRO(EuroQoL-5D3L)
#2 検証的解析項目
PFS、ORR、DORは、BICR*5がRECISTガイドライン1.1版に基づき評価した。健康関連QOLに関するPROはEORTC QLQ-C30、EORTC QLQ-STO22及びEuroQoL-5D3Lを用いて評価した。
解析対象集団:有効性はITT集団*6、安全性はASaT集団*7を解析対象とした。
有効性評価の統計手法:OS及びPFSはKaplan-Meier法を用いて生存曲線を推定した。OS 及びPFS の群間比較は層別ログランク検定を用いて評価した。ハザード比と95%信頼区間(CI)は、投与群を共変量とし、層別Cox 比例ハザードモデルにより算出した。層別ログランク検定及び層別Cox比例ハザードモデルの層別因子は、無作為化に用いた層別因子[地域(ヨーロッパ/北アメリカ/オーストラリア、アジア、その他)、疾患状態(切除不能な局所進行病変、転移性病変)、フッ化ピリミジン系抗悪性腫瘍剤(5-FU、カペシタビン)]を用いた。ORRの群間比較は各層の症例数に基づき重み付けした層別Miettinen and Nurminen法を用いて評価した。層別Miettinen and Nurminen法の層別因子は、無作為化に用いた層別因子を用いた。OS及びPFSのサブグループ解析を、地域(アメリカ及びヨーロッパ、アジア、その他)、疾患状態(局所進行性、転移性)、治療背景(5-FU、カペシタビン)、年齢(65歳以下、65歳超)、ECOG PS*8(0、1)、原発部位(胃、食道胃接合部)、組織型(びまん型、腸型、混合型)、腫瘍量(中央値以下、中央値超)、転移数(2以下、3以上)、胃切除の手術歴(あり、なし)に基づいてCox比例ハザードモデルを用いて実施した。また、日本人集団はITT集団と同様の統計手法にて解析したが、層別化は実施しなかった。
多重性の調整:本試験では6つの主要仮説([仮説1]PD-L1陽性[CPS≧1]患者におけるキイトルーダ®+化学療法群の化学療法群に対するPFSの優越性、[仮説2]PD-L1陽性[CPS≧1]患者におけるキイトルーダ®+化学療法群の化学療法群に対するOSの優越性、[仮説3]PD-L1陽性[CPS≧10]患者におけるキイトルーダ®+化学療法群の化学療法群に対するOSの優越性、[仮説4]PD-L1陽性[CPS≧1]患者におけるキイトルーダ®単剤群の化学療法群に対するOSの非劣性、[仮説5]PD-L1陽性[CPS≧1]患者におけるキイトルーダ®単剤群の化学療法群に対するOSの優越性、[仮説6]PD-L1陽性[CPS≧10]患者におけるキイトルーダ®単剤群の化学療法群に対するOSの優越性)及び1つの副次仮説([仮説7]PD-L1陽性[CPS≧1]患者におけるキイトルーダ®+化学療法群の化学療法群に対するORRの優越性)について、有効性の中間解析を2回、安全性の中間解析を1回事前に計画した。多重性については、Maurer and Bretzのグラフィカルアプローチを用いて試験全体の有意水準を片側2.5%に厳密に制御した。OSは第1回中間解析、第2回中間解析及び最終解析の計3回、PFSは第1回中間解析及び第2回中間解析(PFSの最終解析)の計2回の解析を、ORRは第1回中間解析(ORRの最終解析)を実施することとした。有意水準の配分にはHwang-Shih-DeCaniによるα消費関数を用いた。最初に1段目の仮説(仮説1~4)について並行して検定を行い、1段目の仮説が検証された場合のみ、その仮説から出ている矢印の先にある2段目の仮説(仮説5~7)の検定を行うこととした。
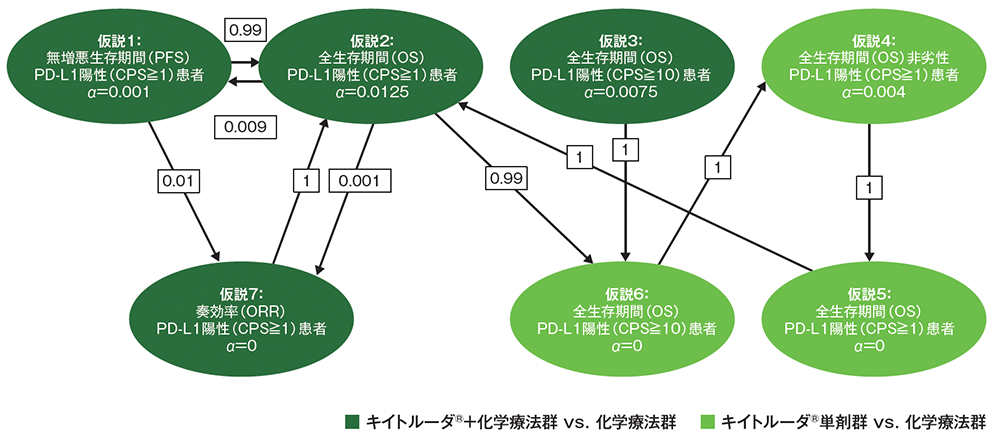
*1 CPS(combined positive score):PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた値。PD-L1発現の評価は、IHC法(PD-L1 IHC 22C3 pharmDx「ダコ」)を用いて、治験薬投与前に採取された腫瘍組織検体中の腫瘍細胞及び炎症細胞を解析した
*2 キイトルーダ®単剤は治癒切除不能な進行・再発の胃癌に対して本邦未承認
*3 無作為割り付け6ヵ月前までに術前・術後補助化学療法が完了していた患者は登録が許容された
*4 PRO(patient reported outcome):患者報告アウトカム
*5 BICR(blinded independent central review):盲検化された中央画像判定機関
*6 ITT(intention-to-treat)集団:無作為化したすべての患者
*7 ASaT(all subjects as treated)集団:治験薬を1回以上投与されたすべての患者
*8 ECOG(Eastern Cooperative Oncology Group):米国東海岸がん臨床グループ、PS(performance status):全身状態の指標
キイトルーダ®
4. 効能又は効果(抜粋) 治癒切除不能な進行・再発の胃癌
5. 効能又は効果に関連する注意(抜粋)
〈治癒切除不能な進行・再発の胃癌〉
5.33 本剤の術後補助療法における有効性及び安全性は確立していない。
5.34 HER2陰性の患者に投与すること。
5.35 本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されている。CPSについて、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.30参照]
6. 用法及び用量(抜粋)
〈治癒切除不能な進行・再発の胃癌〉
他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
7. 用法及び用量に関連する注意(抜粋)
〈治癒切除不能な進行・再発の胃癌〉
7.7 併用する他の抗悪性腫瘍剤は「17. 臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で、選択すること。[17.1.30参照]
5-FU
6. 用法及び用量(抜粋)
6.3 頭頸部癌、食道癌及び治癒切除不能な進行・再発の胃癌に対する他の抗悪性腫瘍剤との併用療法の場合
他の抗悪性腫瘍剤との併用療法において、通常、成人にはフルオロウラシルとして1日1000mg/m2(体表面積)までを、4~5日間連日で持続点滴する。投与を繰り返す場合には少なくとも3週間以上の間隔をあけて投与する。本剤単独投与の場合には併用投与時に準じる。
なお、年齢、患者の状態などにより適宜減量する。
カペシタビン
6. 用法及び用量(抜粋)
胃癌には白金製剤との併用でC法を使用する。
C法:体表面積にあわせて次の投与量を朝食後と夕食後30分以内に1日2回、14日間連日経口投与し、その後7日間休薬する。
これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。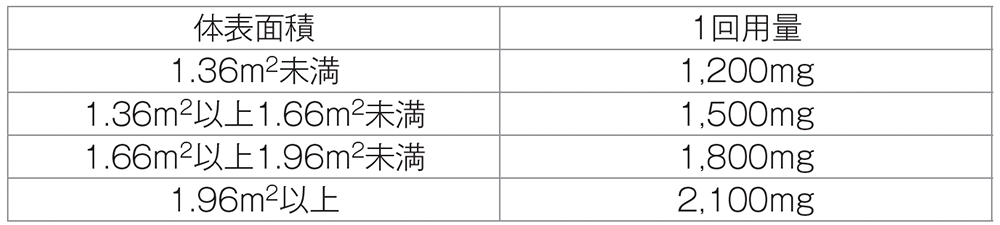
シスプラチン
6. 用法及び用量(抜粋)
〈シスプラチン通常療法〉
(1)神経芽細胞腫、胃癌、小細胞肺癌には、E法を選択する。
E法:シスプラチンとして70〜90mg/m2(体表面積)を1日1回投与し、少なくとも3週間休薬する。これを1クールとし、投与を繰り返す。
なお、A~G法の投与量は疾患、症状により適宜増減する。

*1 無作為化時の層別因子に基づく
※国内未承認につきキイトルーダ®単剤群のデータは提示していません。
キイトルーダ®+化学療法群の化学療法群に対するハザード比は0.85(95%CI: 0.70, 1.03)で優越性は示されませんでした(p=0.04611、層別ログランク検定[片側]、有意水準α=0.0088;検証的解析結果)。OS中央値はキイトルーダ®+化学療法群で12.5ヵ月(95%CI: 10.8, 13.9)、化学療法群で11.1ヵ月(95%CI: 9.2, 12.8)でした。
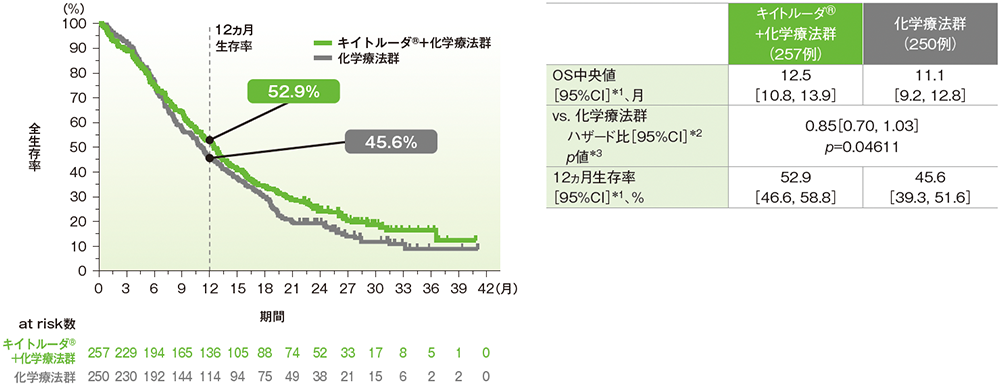
ITT集団の追跡期間中央値:キイトルーダ®+化学療法群12.5ヵ月、化学療法群11.1ヵ月(最終解析)
データカットオフ日:2019年3月26日(最終解析)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とした層別Cox比例ハザードモデルに基づいてハザード比を推定した
*3 層別ログランク検定[片側]
※層別Cox比例ハザードモデル及び層別ログランク検定に用いられた層別因子は次のとおりであった。[地域(ヨーロッパ/北アメリカ/オーストラリア、アジア、その他)、疾患状態(切除不能な局所進行病変、転移性病変)、フッ化ピリミジン系抗悪性腫瘍剤(5-FU、カペシタビン)]
併用する化学療法は治験担当医師が無作為化前に5-FU又はカペシタビンのいずれかを選択
キイトルーダ®+化学療法群の化学療法群に対するハザード比は0.85(95%CI: 0.62, 1.17)で優越性は示されませんでした(p=0.15804、層別ログランク検定[片側]、有意水準α=0.0064;検証的解析結果)。OS中央値はキイトルーダ®+化学療法群で12.3ヵ月(95%CI: 9.5, 14.8)、化学療法群で10.8ヵ月(95%CI: 8.5, 13.8)でした。
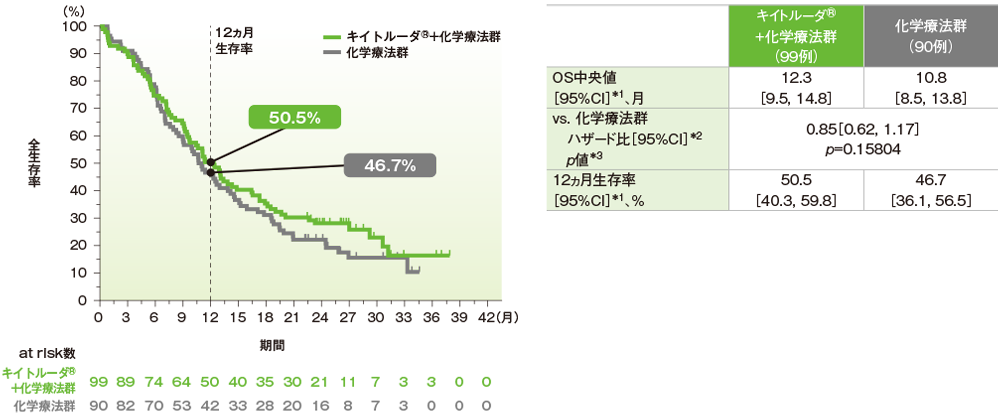
データカットオフ日:2019年3月26日(最終解析)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とした層別Cox比例ハザードモデルに基づいてハザード比を推定した
*3 層別ログランク検定[片側]
※層別Cox比例ハザードモデル及び層別ログランク検定に用いられた層別因子は次のとおりであった。[地域(ヨーロッパ/北アメリカ/オーストラリア、アジア、その他)、疾患状態(切除不能な局所進行病変、転移性病変)、フッ化ピリミジン系抗悪性腫瘍剤(5-FU、カペシタビン)]
併用する化学療法は治験担当医師が無作為化前に5-FU又はカペシタビンのいずれかを選択
キイトルーダ®+化学療法群の化学療法群に対するハザード比は0.84(95%CI: 0.70, 1.02)で優越性は示されませんでした(p=0.03918、層別ログランク検定[片側]、有意水準α=0.0008;検証的解析結果)。PFS中央値はキイトルーダ®+化学療法群で6.9ヵ月(95%CI: 5.7, 7.3)、化学療法群で6.4ヵ月(95%CI: 5.7, 7.0)でした。
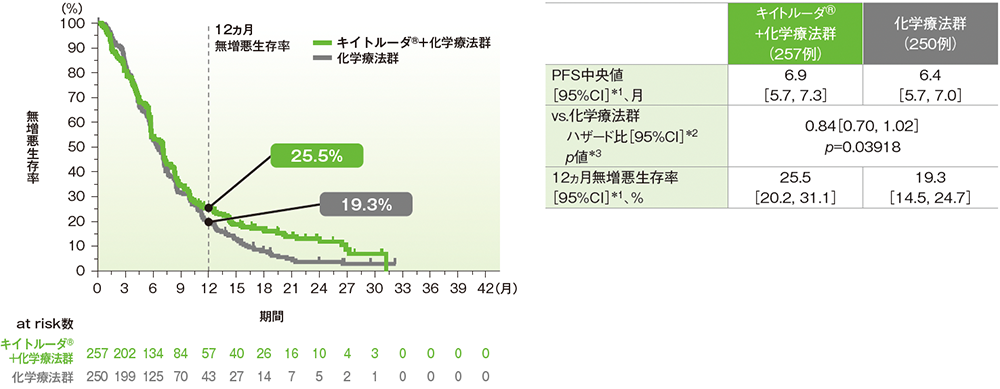
データカットオフ日:2018年9月26日(第2回中間解析)
RECIST 1.1に基づくBICR判定による評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とした層別Cox比例ハザードモデルに基づいてハザード比を推定した
*3 層別ログランク検定[片側]
※層別Cox比例ハザードモデル及び層別ログランク検定に用いられた層別因子は次のとおりであった。[地域(ヨーロッパ/北アメリカ/オーストラリア、アジア、その他)、疾患状態(切除不能な局所進行病変、転移性病変)、フッ化ピリミジン系抗悪性腫瘍剤(5-FU、カペシタビン)]
併用する化学療法は治験担当医師が無作為化前に5-FU又はカペシタビンのいずれかを選択
ORRはキイトルーダ®+化学療法群で48.6%、化学療法群で36.8%でした※。DORはともに6.8ヵ月でした。
■奏効率(ORR: CR+PR)、最良総合効果及び奏効期間(DOR)
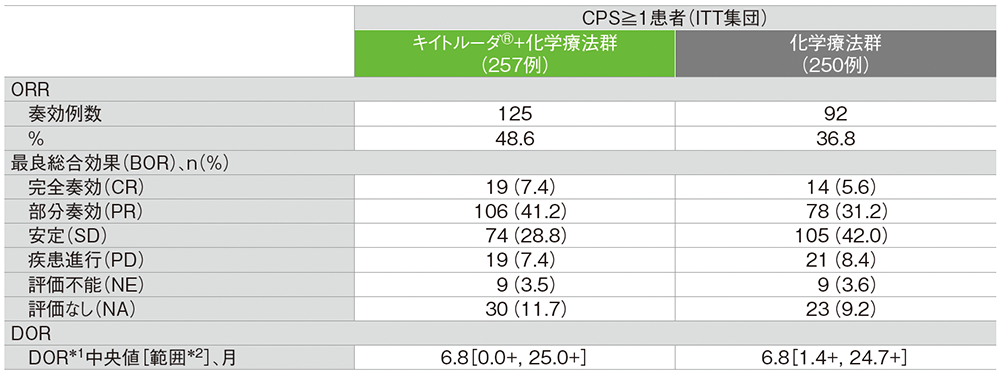
データカットオフ日:2018年3月26日(第1回中間解析:ORRの最終解析)、2019年3月26日(最終解析:DORの最終解析)
RECIST 1.1に基づくBICR判定による評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までPDがみられなかったことを示す
※CPS≧1患者におけるOSとPFS、及びCPS≧10患者におけるOSについて、キイトルーダ®+化学療法群の化学療法群に対する優越性が示されなかったことにより検定の手順を終了したため、CPS≧1患者におけるキイトルーダ®+化学療法群の化学療法群に対するORRの優越性は検定を行わなかった。
キイトルーダ®+化学療法群の副作用は235/250例(94.0%)に認められました。主な副作用(発現率20%以上)は、悪心145例(58.0%)、貧血、疲労各90例(36.0%)、好中球減少症88例(35.2%)、食欲減退75例(30.0%)、嘔吐66例(26.4%)、下痢63例(25.2%)、手掌・足底発赤知覚不全症候群59例(23.6%)、好中球数減少56例(22.4%)でした。
重篤な副作用は73例(29.2%)に認められました。発現率が2%以上であった重篤な副作用は、貧血10例(4.0%)、発熱性好中球減少症8例(3.2%)、大腸炎、下痢各6例(2.4%)、肺塞栓症、急性腎障害、脱水各5例(2.0%)でした。
いずれかの治験薬で投与中止に至った副作用は、69例(27.6%)に認められました。発現率が1%以上であった投与中止に至った副作用は、末梢性感覚ニューロパチー6例(2.4%)、悪心、食欲減退各5例(2.0%)、下痢、疲労各4例(1.6%)、貧血、大腸炎、急性腎障害各3例(1.2%)でした。
死亡に至った副作用は5例(2.0%)で、その内訳は悪性新生物進行、腸炎、敗血症、発熱性好中球減少症、心筋虚血各1例(0.4%)でした。
MedDRA/J v21.1
データカットオフ日:2019年3月26日
化学療法群の副作用は224/244例(91.8%)に認められました。主な副作用(発現率20%以上)は、悪心120例(49.2%)、好中球減少症95例(38.9%)、貧血80例(32.8%)、食欲減退74例(30.3%)、嘔吐71例(29.1%)、疲労63例(25.8%)、下痢62例(25.4%)でした。
重篤な副作用は71例(29.1%)に認められました。発現率が2%以上であった重篤な副作用は、下痢、肺塞栓症、貧血各9例(3.7%)、嘔吐8例(3.3%)、脱水、発熱性好中球減少症各6例(2.5%)、食欲減退、急性腎障害各5例(2.0%)でした。
いずれかの治験薬で投与中止に至った副作用は、44例(18.0%)に認められました。発現率が1%以上であった投与中止に至った副作用は、好中球数減少4例(1.6%)、食欲減退、発熱性好中球減少症、好中球減少症、下痢、無力症、血中クレアチニン増加各3例(1.2%)でした。
死亡に至った副作用は3例(1.2%)で、その内訳は肺臓炎、多臓器不全症候群、肺塞栓症各1例(0.4%)でした。
MedDRA/J v21.1
データカットオフ日:2019年3月26日
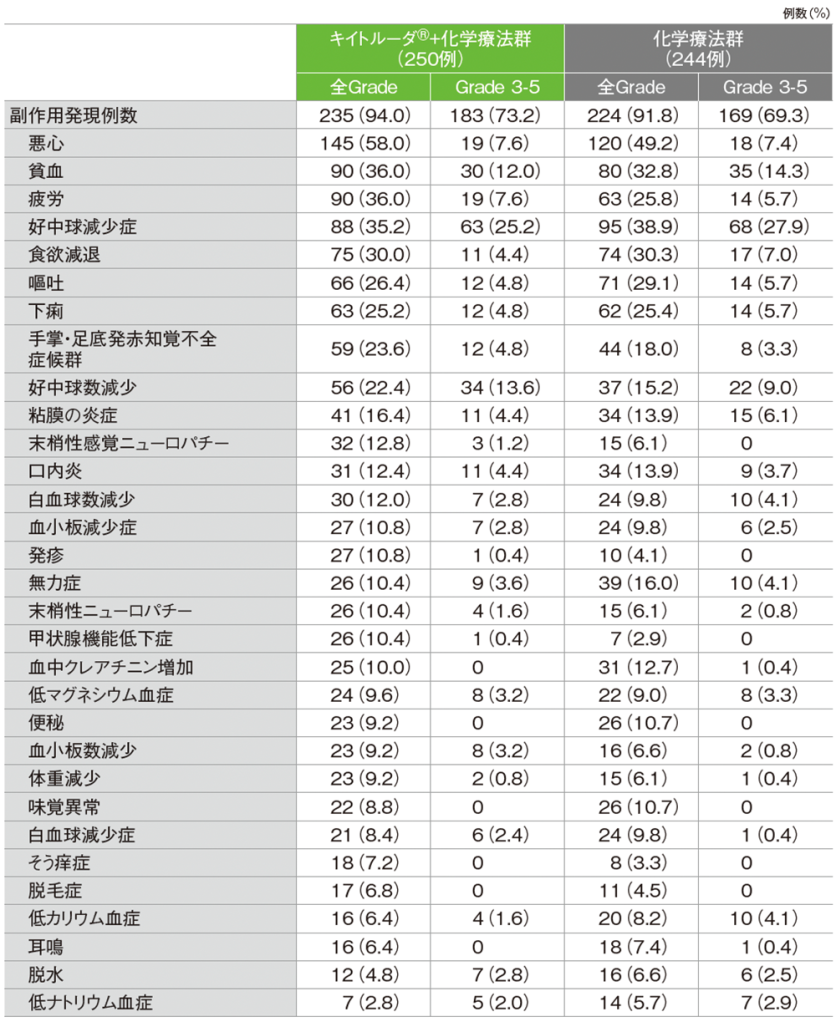
MedDRA/J v21.1、GradeはCTCAE v4.0
データカットオフ日:2019年3月26日
キイトルーダ®+化学療法群
キイトルーダ®+化学療法群の免疫関連など特に注目すべき有害事象は60/250例(24.0%)に認められ、発現率が3%以上であった免疫関連など特に注目すべき有害事象は、甲状腺機能低下症29例(11.6%)、甲状腺機能亢進症11例(4.4%)、大腸炎9例(3.6%)、肺臓炎8例(3.2%)でした。
MedDRA/J v21.1
データカットオフ日:2019年3月26日
化学療法群
化学療法群の免疫関連など特に注目すべき有害事象は19/244例(7.8%)に認められ、発現率が3%以上であった免疫関連など特に注目すべき有害事象は、甲状腺機能低下症10例(4.1%)でした。
MedDRA/J v21.1
データカットオフ日:2019年3月26日

キイトルーダ® は2024年5⽉、「治癒切除不能な進⾏・再発の胃癌」を効能⼜は効果として承認を取得いたしました。本動画では、HER2陰性の治癒切除不能な進⾏・再 […]

胃癌の患者ではさまざまな遺伝⼦変異が起こることが報告されており、治療選択の際には、バイオマーカーを⽤いて個々の患者の治療感受性を事前に予測することが重要です。本 […]


WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?