【胃癌】HER2陰性の治癒切除不能な進⾏・再発胃癌の1次治療におけるキイトルーダ®+化学療法の併⽤療法 適正使⽤のポイント KEYNOTE-859試験の結果より
キイトルーダ® は2024年5⽉、「治癒切除不能な進⾏・再発の胃癌」を効能⼜は効果として承認を取得いたしました。本動画では、HER2陰性の治癒切除不能な進⾏・再 […]
承認時評価資料:国内後期第Ⅱ相試験(KEYNOTE-659試験)
Yamaguchi K et al. Cancer Sci 2022; 113: 2814-2827
本試験はMSD社の資金提供により行われた。著者にMSD社より顧問料などを受領している者が含まれる。著者にMSD社の社員が含まれる。
PD-L1陽性(CPS*1≧1)かつHER2陰性の進行・再発胃癌の1次治療におけるキイトルーダ®+化学療法群(コホート1:キイトルーダ®とS-1及びオキサリプラチン〈SOX〉の併用、コホート2:キイトルーダ®とS-1及びシスプラチン〈SP〉の併用)の有効性及び安全性を検討する。
多施設共同非無作為化非盲検第Ⅱ相試験
[最終解析結果(データカットオフ日:2021年5月30日)]
化学療法歴のない*2PD-L1陽性(CPS≧1)かつHER2陰性の進行・再発胃癌(胃腺癌又は食道胃接合部腺癌)日本人患者100例(コホート1:54例、コホート2:46例)
コホート1(キイトルーダ®200mgとオキサリプラチン130mg/m2を各サイクルの1日目にQ3Wで点滴静注、S-1#1 40~60mg/回を各サイクルの1~14日目まで1日2回Q3Wで経口投与)又はコホート2(キイトルーダ®200mgとシスプラチン60mg/m2を各サイクルの1日目にQ3Wで点滴静注、S-1 40~60mg/回を各サイクルの1~14日目まで1日2回Q3Wで経口投与)に割り付けた。6週間毎に画像検査による評価を行い、疾患進行又は許容できない毒性発現等まで最大35サイクルまでとして投与を継続した。
#1 KEYNOTE-659試験においては、S-1の初回投与量は、体表面積(<1.25m2:1回投与量40mg、≧1.25~<1.5m2:1回投与量50mg、≧1.5m2:1回投与量60mg)に従い、1日2回朝食後及び夕食後に服用することとした。
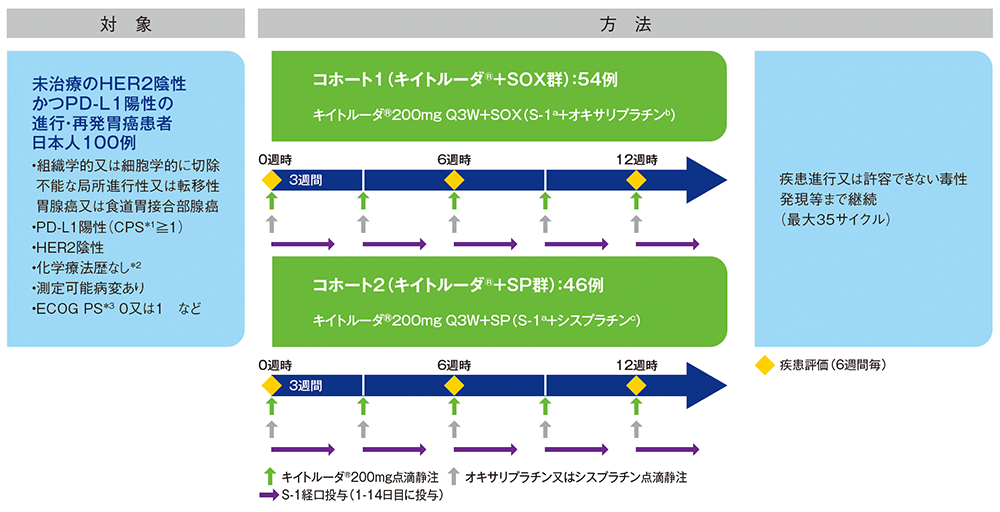
a:S-1#1 40~60mg/回 Q3W 経口投与(各サイクルの1~14日目まで1日2回投与、21日を1サイクル)
b:オキサリプラチン130mg/m2 Q3W 点滴静注(各サイクルの1日目に投与、21日を1サイクル)
c:シスプラチン60mg/m2 Q3W 点滴静注(各サイクルの1日目投与、21日を1サイクル)
主要評価項目
・ 奏効率(objective response rate; ORR)#2
副次評価項目
・ 奏効期間(duration of response; DOR)
・ ORR#3
・ 病勢コントロール率(disease control rate; DCR)
・ 無増悪生存期間(progression free survival; PFS)
・ 奏効までの期間(time to response; TTR)
・ 全生存期間(overall survival; OS)
・ 安全性
#2 RECIST ガイドライン1.1版に基づき評価したORR(主要評価項目)
#3 iRECISTに基づき評価したORR(副次評価項目)
ORR、DOR、DCR、PFS及びTTRはRECIST ガイドライン1.1版及びiRECISTに基づきBICR*4が評価した。
解析対象集団:有効性及び安全性は共にASaT集団*5を解析対象とした。
有効性評価の統計手法:DOR、PFS、TTR及びOSはKaplan-Meier法を用いて生存曲線及びその中央値を推定した。ORR及びDCRは二項分布に基づく正確法により95%信頼区間(CI)を算出した。主要評価項目における治療効果の推定値を各分類変数のカテゴリごとに算出し、患者背景別のサブグループ解析を実施した。
*1 CPS(combined positive score):PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた値。PD-L1発現の評価は、IHC法(PD-L1 IHC 22C3 pharmDx「ダコ」)を用いて、治験薬投与前に採取された腫瘍組織検体中の腫瘍細胞及び炎症細胞を解析した
*2 登録6ヵ月前までに術前・術後補助化学療法が完了していた患者は登録が許容された
*3 ECOG(Eastern Cooperative Oncology Group):米国東海岸がん臨床グループ、PS(performance status):全身状態の指標
*4 BICR(blinded independent central review):盲検化された中央画像判定機関
*5 ASaT(all subjects as treated)集団:治験薬を1回以上投与されたすべての患者
キイトルーダ®
4. 効能又は効果(抜粋) 治癒切除不能な進行・再発の胃癌
5. 効能又は効果に関連する注意(抜粋)
〈治癒切除不能な進行・再発の胃癌〉
5.33 本剤の術後補助療法における有効性及び安全性は確立していない。
5.34 HER2陰性の患者に投与すること。
5.35 本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されている。CPSについて、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.30参照]
6. 用法及び用量(抜粋)
〈治癒切除不能な進行・再発の胃癌〉
他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
7. 用法及び用量に関連する注意(抜粋)
〈治癒切除不能な進行・再発の胃癌〉
7.7 併用する他の抗悪性腫瘍剤は「17. 臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で、選択すること。[17.1.30参照]
S-1
6. 用法及び用量(抜粋)
〈胃癌、結腸・直腸癌、頭頸部癌、非小細胞肺癌、手術不能又は再発乳癌、膵癌、胆道癌〉
胃癌にはA法、B法又はC法、結腸・直腸癌にはA法、C法又はD法、頭頸部癌にはA法、非小細胞肺癌にはA法、B法又はC法、手術不能又は再発乳癌にはA法、膵癌にはA法又はC法、胆道癌にはA法、E法又はF法を使用する。
A法:通常、成人には初回投与量(1回量)を体表面積に合わせて下表の基準量とし、朝食後及び夕食後の1日2回、28日間連日経口投与し、その後14日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜増減する。
増量は本剤の投与によると判断される臨床検査値異常(血液検査、肝・腎機能検査)及び消化器症状が発現せず、安全性に問題がなく、増量できると判断される場合に初回基準量から一段階までとし、75mg/回を限度とする。
B法:通常、成人には初回投与量(1回量)を体表面積に合わせて下表の基準量とし、朝食後及び夕食後の1日2回、21日間連日経口投与し、その後14日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
C法:通常、成人には初回投与量(1回量)を体表面積に合わせて下表の基準量とし、朝食後及び夕食後の1日2回、14日間連日経口投与し、その後7日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
A法~E法における初回投与量(1回量)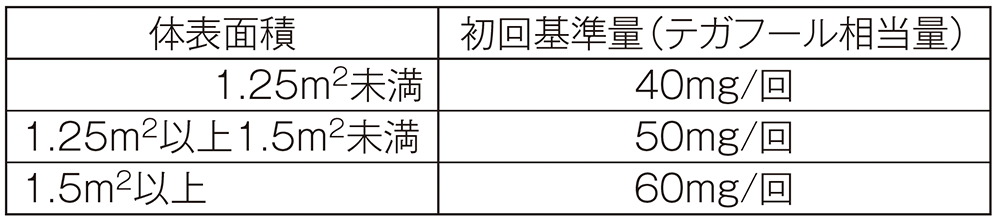
オキサリプラチン
6. 用法及び用量(抜粋)
治癒切除不能な進行・再発の結腸・直腸癌、結腸癌における術後補助療法及び胃癌にはA法又はB法を、治癒切除不能な膵癌及び小腸癌にはA法を使用する。なお、患者の状態により適宜減量する。
A法:他の抗悪性腫瘍剤との併用において、通常、成人にはオキサリプラチンとして85mg/m2(体表面積)を1日1回静脈内に2時間で点滴投与し、少なくとも13日間休薬する。これを1サイクルとして投与を繰り返す。
B法:他の抗悪性腫瘍剤との併用において、通常、成人にはオキサリプラチンとして130mg/m2(体表面積)を1日1回静脈内に2時間で点滴投与し、少なくとも20日間休薬する。これを1サイクルとして投与を繰り返す。
シスプラチン
6. 用法及び用量(抜粋)
〈シスプラチン通常療法〉
(1)神経芽細胞腫、胃癌、小細胞肺癌には、E法を選択する。
E法:シスプラチンとして70〜90mg/m2(体表面積)を1日1回投与し、少なくとも3週間休薬する。これを1クールとし、投与を繰り返す。
なお、A~G法の投与量は疾患、症状により適宜増減する。

*初回診断時に転移の有無が不明であった1例を含む
Yamaguchi K et al. Cancer Sci 2022; 113: 2814-2827
ORR*1はコホート1(キイトルーダ®+SOX群)で72.2%(95%CI: 58.4, 83.5)、コホート2(キイトルーダ®+SP群)で80.4%(95%CI: 66.1, 90.6)でした。
■奏効率(ORR: CR+PR)及び最良総合効果
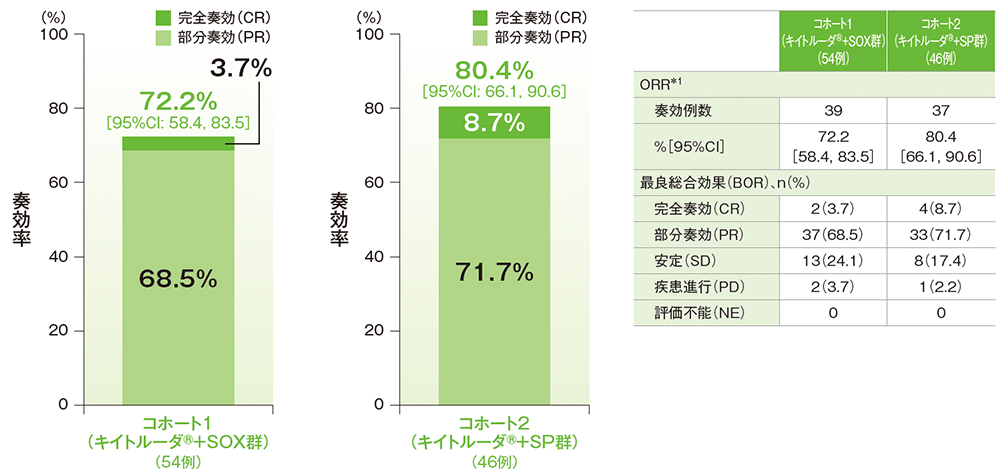
データカットオフ日:2021年5月30日
*1 RECIST 1.1に基づくBICR判定による評価
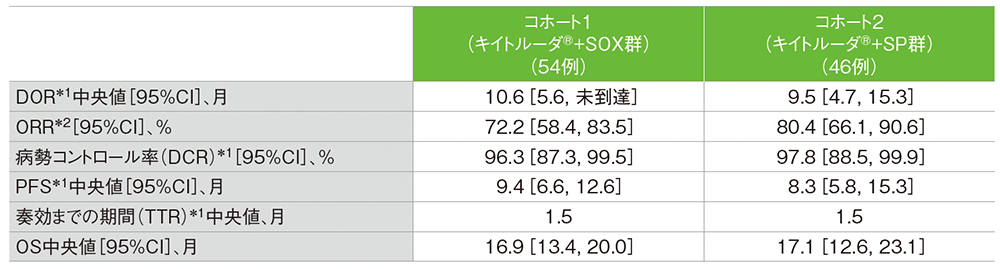
データカットオフ日:2021年5月30日
*1 RECIST 1.1に基づくBICR判定による評価
*2 iRECISTに基づくBICR判定による評価
コホート1の副作用は54/54例(100.0%)に認められました。主な副作用(発現率20%以上)は、末梢性感覚ニューロパチー51例(94.4%)、食欲減退33例(61.1%)、悪心32例(59.3%)、血小板数減少28例(51.9%)、好中球数減少22例(40.7%)、下痢21例(38.9%)、倦怠感20例(37.0%)、味覚不全19例(35.2%)、口内炎14例(25.9%)、疲労11例(20.4%)でした。
重篤な副作用は18例(33.3%)に認められました。発現率が3%以上であった重篤な副作用は、副腎機能不全3例(5.6%)、大腸炎、嘔吐各2例(3.7%)でした。
いずれかの治験薬で投与中止に至った副作用は3例(5.6%)で、その内訳は心停止、小腸炎、膵仮性嚢胞、膵炎各1例(1.9%)でした。
死亡に至った副作用は1例(1.9%)で、その内訳は心停止1例(1.9%)でした。
MedDRA/J v24.0
データカットオフ日:2021年5月30日
コホート2の副作用は46/46例(100.0%)に認められました。主な副作用(発現率20%以上)は、好中球数減少32例(69.6%)、食欲減退、悪心各28例(60.9%)、便秘22例(47.8%)、下痢20例(43.5%)、口内炎、貧血各15例(32.6%)、味覚不全14例(30.4%)、倦怠感13例(28.3%)、末梢性感覚ニューロパチー12例(26.1%)、血小板数減少、疲労各11例(23.9%)、嘔吐10例(21.7%)でした。
重篤な副作用は17例(37.0%)に認められました。発現率が3%以上であった重篤な副作用は、副腎機能不全3例(6.5%)、低ナトリウム血症、発疹各2例(4.3%)でした。
いずれかの治験薬で投与中止に至った副作用は2例(4.3%)で、その内訳は発疹2例(4.3%)でした。
死亡に至った副作用は認められませんでした。
MedDRA/J v24.0
データカットオフ日:2021年5月30日
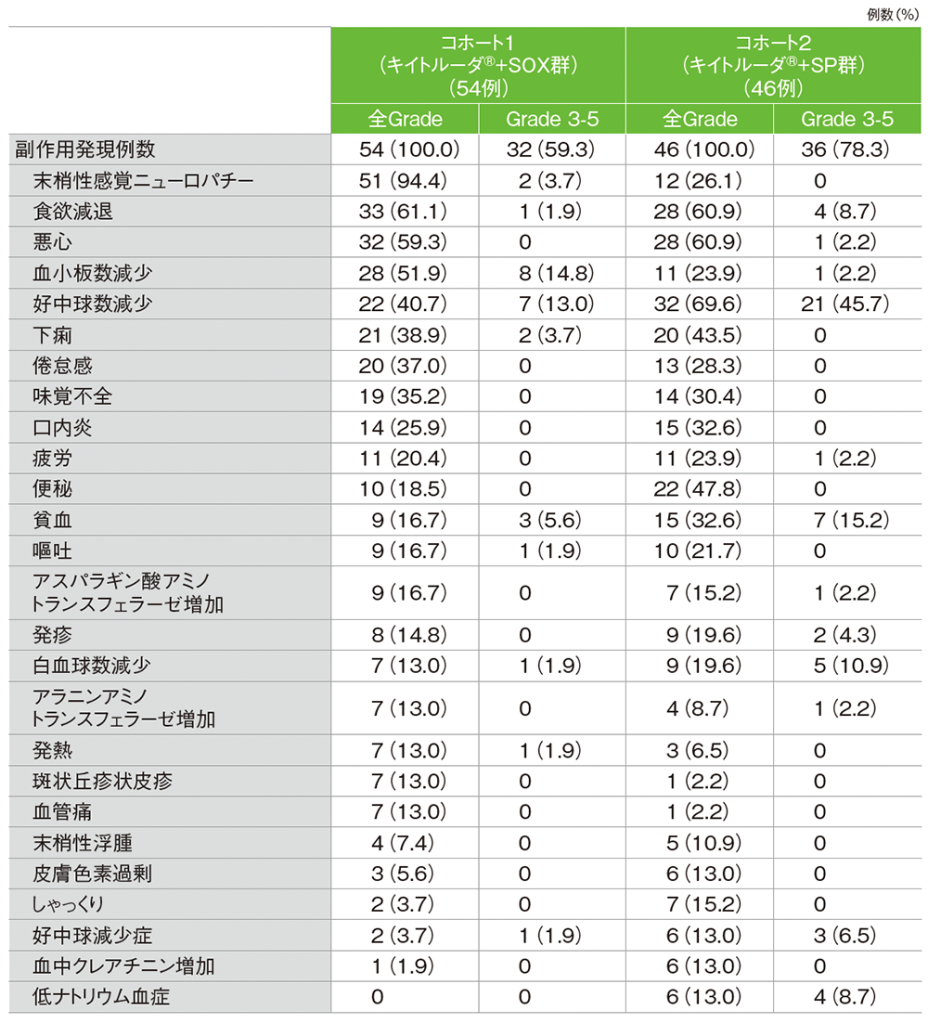
MedDRA/J v24.0、GradeはCTCAE v4.0
データカットオフ日:2021年5月30日
コホート1(キイトルーダ®+SOX群)
コホート1の免疫関連など特に注目すべき副作用は、斑状丘疹状皮疹6例(11.1%)、発疹、甲状腺機能低下症各5例(9.3%)、大腸炎4例(7.4%)、副腎機能不全3例(5.6%)、甲状腺機能亢進症2例(3.7%)、小腸炎、腸炎、肺臓炎、1型糖尿病各1例(1.9%)でした。
MedDRA/J v24.0
データカットオフ日:2021年5月30日
コホート2(キイトルーダ®+SP群)
コホート2の免疫関連など特に注目すべき副作用は、発疹8例(17.4%)、甲状腺機能低下症、副腎機能不全各3例(6.5%)、甲状腺機能亢進症2例(4.3%)、斑状丘疹状皮疹、1型糖尿病、自己免疫性大腸炎各1例(2.2%)でした。
MedDRA/J v24.0
データカットオフ日:2021年5月30日

キイトルーダ® は2024年5⽉、「治癒切除不能な進⾏・再発の胃癌」を効能⼜は効果として承認を取得いたしました。本動画では、HER2陰性の治癒切除不能な進⾏・再 […]

胃癌の患者ではさまざまな遺伝⼦変異が起こることが報告されており、治療選択の際には、バイオマーカーを⽤いて個々の患者の治療感受性を事前に予測することが重要です。本 […]


WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?