KEYNOTE-006試験(切除不能, P3)
本剤は、一部承認外の用法及び用量による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。そのため、国内で承認されている用法及び用量と異なるデータも紹介しています。
悪性黒色腫:臨床試験成績:海外第Ⅲ相試験<KEYNOTE-006試験>(海外データ)
承認時評価資料:海外第Ⅲ相試験(KEYNOTE-006試験)
Robert C et al. N Engl J Med 2015; 372: 2521-2532
Schachter J et al. Lancet 2017; 390: 1853-1862
本試験はMSD社の資金により行われた。Caroline Robert、Jacob SchachterはMSD社から顧問料を受領している。また、著者のうちHonghong ZhouとScot Ebbinghaus とNageatte IbrahimはMSD社の社員である。その他の著者にMSD社より講演料、顧問料など受領している者が含まれる。本試験の中間解析で物流や行政的な支援を行ったMargaret Hodgson、データの収集を行ったLamar Eaton、Maureen Bucci、統計解析のレビューを行ったKeaven Anderson、Cong Chen、研究グループの幹部で論文のレビューを行ったRoger Dansey、Eric Rubin、本試験の最終解析でデータの収集を行ったHonghong ZhouとNageatte Ibrahim、データ解析を行ったHonghong ZhouとScot EbbinghausとNageatte Ibrahim、論文の草稿を作成したScot EbbinghausとNageatte Ibrahim、論文のレビューと最終投稿用原稿の承認をしたHonghong ZhouとScot EbbinghausとNageatte IbrahimはMSD社の社員である。
※本試験におけるキイトルーダ®の用法及び用量は、現在承認されている用法及び用量と異なります。
試験概要
【目的】イピリムマブ未治療の切除不能又は転移性悪性黒色腫患者に対するキイトルーダ®の有効性及び安全性を、イピリムマブと比較検討する。
【デザイン】多施設共同非盲検無作為化第Ⅲ相試験[優越性試験]
【対象】イピリムマブ未治療の局所治療が適応とならない切除不能(Ⅲ期)又は転移性(Ⅳ期)の病変を有する悪性黒色腫患者(ぶどう膜又は眼内悪性黒色腫は除く)834例
【方法】キイトルーダ®10mg/kg 3週間間隔(Q3W)群、10mg/kg 2週間間隔(Q2W)群又はイピリムマブ群に1:1:1の割合で無作為に割り付けた。
- キイトルーダ®10mg/kg Q3W群:キイトルーダ®10mg/kgを3週間間隔で点滴静注し、疾患進行又は許容できない毒性発現等まで、あるいは最長2年間投与した。
- キイトルーダ®10mg/kg Q2W群:キイトルーダ®10mg/kgを2週間間隔で点滴静注し、疾患進行又は許容できない毒性発現等まで、あるいは最長2年間投与した。
- イピリムマブ群:イピリムマブ3mg/kgを3週間間隔で点滴静注し、最大4回、もしくは疾患進行又は許容できない毒性発現等まで投与した。
疾患の評価は、0週および12週に実施し、12~48週までは6週間ごと、以降は12週間ごとに実施した。
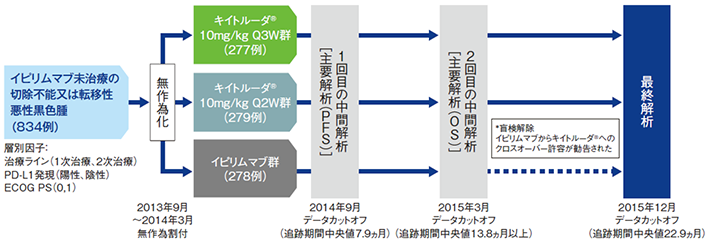
【評価項目】主要評価項目:無増悪生存期間(progression free survival:PFS)※、全生存期間(overall survival:OS)※
副次評価項目:奏効率(overall response rate:ORR)、安全性など
探索的評価項目:奏効期間(duration of response:DOR)
※検証的解析項目
【判定基準】奏効及び疾患進行は、独立した放射線科医及び腫瘍専門医がRECISTガイドライン1.1版に基づき盲検下で評価した。
【解析計画】 解析対象集団:有効性の解析はITT*1集団、安全性の解析はAPaT集団*2を対象として実施した。
有効性評価の統計手法:PFS、OS及びDORはKaplan-Meier法を用いて推定した。PFS及びOSの群間比較は層別ログランク検定を用いて評価し、投与群を共変量とした層別Cox比例ハザードモデルを用いてハザード比と95%信頼区間(CI)を算出した。ORRの群間比較には層別Miettinen and Nurminen法を用いた。層別ログランク検定及び層別Cox比例ハザードモデルでは、治療ライン(1次治療、2次治療)、PD-L1発現(陽性、陰性)、ECOG PS(0、1)を層別因子として用いた。また、Cox比例ハザードモデルを用いて、年齢(≦65歳、>65歳)、性別(女性、男性)、ECOG PS(0、1)、治療ライン(1次治療、2次治療)、BRAF阻害剤による前治療歴(あり、なし)、BRAF遺伝子変異(あり、なし)、PD-L1発現(陽性、陰性)別によるサブグループ解析を実施した。
多重性の調整:本試験は2回の中間解析を事前に計画し、試験全体の有意水準を片側2.5%とした。PFSは、Bonferroni法でキイトルーダ®各群の多重性を調整することとし、1回目の中間解析を主要解析として有意水準をそれぞれ片側0.2%、2回目の中間解析は有意水準をそれぞれ片側0.05%とした。OSはHochberg step-up法にて多重性を調整することとし、1回目の有意水準を片側0.002%、2回目の有意水準を片側0.5%とし、最終解析時の有意水準を1回目及び2回目のPFSの解析結果により片側2.0%で設定した*3。
*1 ITT(intention-to-treat)集団:無作為化したすべての患者
*2 APaT集団(all patients as treated):無作為化され、治験薬が1回以上投与されたすべての患者
*3 独立したデータモニタリング委員会より2回目の中間解析の結果をもってOSの最終解析とし、盲検を解除しイピリムマブ群からキイトルーダ®群へクロスオーバーを許容するよう勧告された。
4. 効能又は効果(抜粋)
○悪性黒色腫
6. 用法及び用量(抜粋)
〈悪性黒色腫〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。ただし、術後補助療法の場合は、投与期間は12ヵ月間までとする。
患者背景
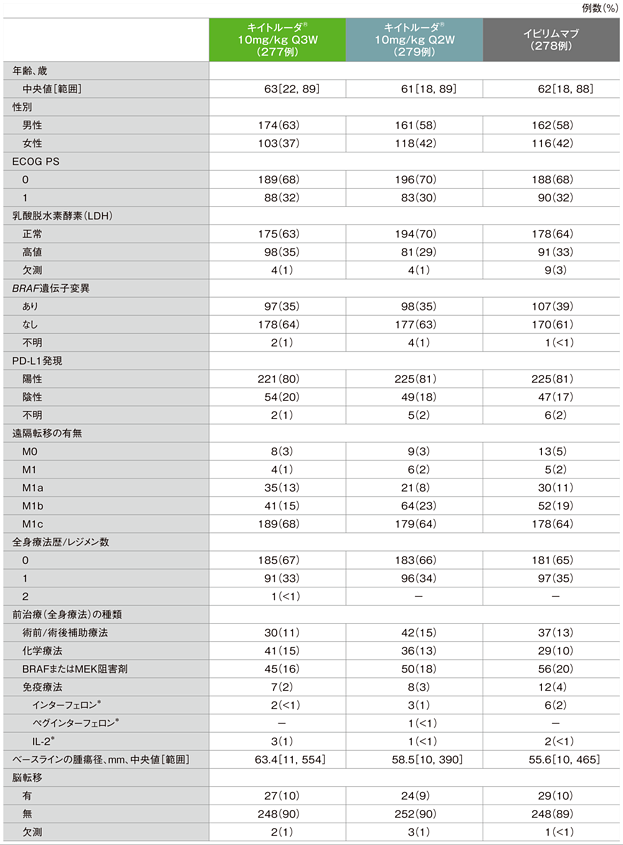
ECOG:Eastern Cooperative Oncology Group PS:performance status
*本邦未承認薬を含む
盲検解除後における後治療の内訳
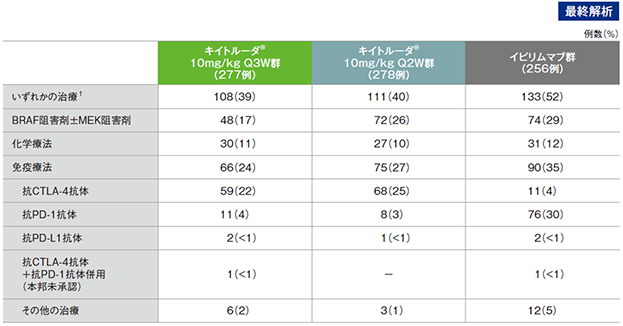
† 患者が少なくとも1種類の後治療を受けたことを示す
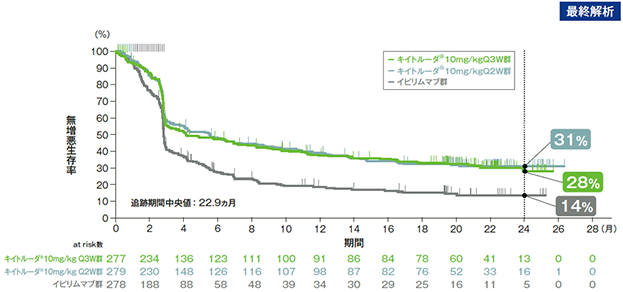
(追跡期間中央値:22.9ヵ月)
- 後治療として免疫療法を受けていた患者のうちQ3W群の22%、Q2W群の25%、イピリムマブ群の4%が抗CTLA-4抗体の投与を受け、Q3W群の4%、Q2W群の3%、イピリムマブ群の30%が抗PD-1抗体の投与を受けました。
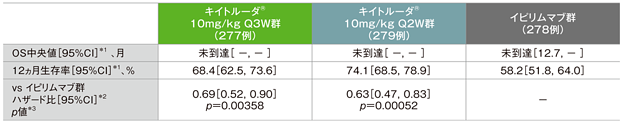
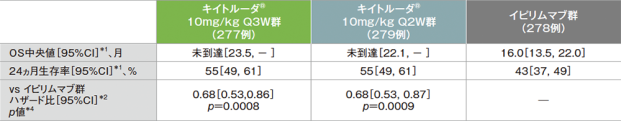
主要評価項目 全生存期間:OS
全生存期間(OS)のKaplan-Meier曲線(ITT集団)
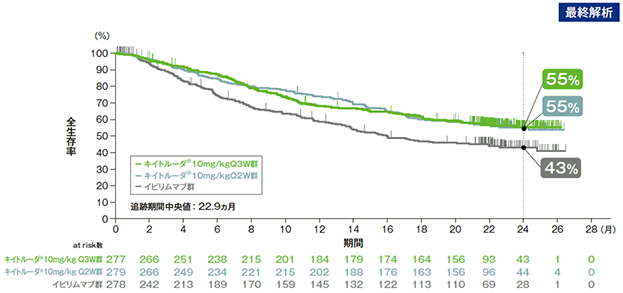
2回目の中間解析(追跡期間中央値13.8ヵ月)(検証的解析結果)
最終解析(追跡期間中央値22.9ヵ月)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、治療ライン(1次治療、2次治療)、PD-L1発現(陽性、陰性)及びECOG PS(0, 1)を層別因子(無作為割付時の層別因子)としたCox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為割付時の層別因子)(有意水準α=0.005)(検証的解析結果)
*4 層別ログランク検定[片側](層別因子は無作為割付時の層別因子)(名目上のp値)
- 全生存期間(OS)については、中間解析(追跡期間中央値13.8ヵ月)では、イピリムマブ群に対するキイトルーダ®10mg/kg Q3W群及びQ2W群のハザード比がそれぞれ0.69(95%CI:0.52, 0.90)(p=0.00358、層別ログランク検定[片側]、有意水準α=0.005;検証的解析結果)及び0.63(95%CI:0.47, 0.83)(p=0.00052、層別ログランク検定[片側]、有意水準α=0.005;検証的解析結果)であり、キイトルーダ®両群の優越性が示されました。
- 最終解析(追跡期間中央値22.9ヵ月)では、イピリムマブ群に対するキイトルーダ®10mg/kg Q3W群及びQ2W群のハザード比がそれぞれ0.68(95%CI:0.53, 0.86)(p=0.0008、層別ログランク検定[片側]、名目上のp値)及び0.68(95%CI:0.53, 0.87)(p=0.0009、層別ログランク検定[片側]、名目上のp値)であり、キイトルーダ®両群の優越性が示されました。
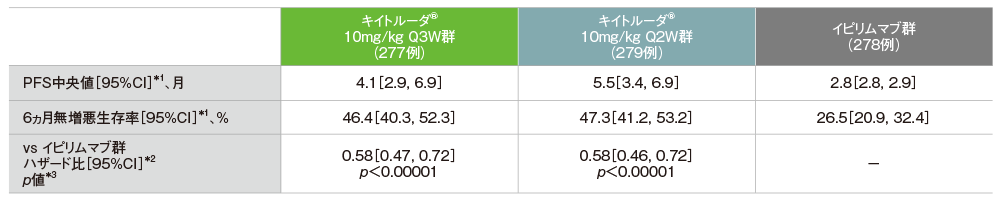
主要評価項目 無増悪生存期間:PFS
無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
1回目の中間解析(追跡期間中央値7.9ヵ月)(検証的解析結果)
最終解析(追跡期間中央値22.9ヵ月)

*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、治療ライン(1次治療、2次治療)、PD-L1発現(陽性、陰性)及びECOG PS(0, 1)を層別因子(無作為割付時の層別因子)としたCox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為割付時の層別因子)(有意水準α=0.002)(検証的解析結果)
*4 層別ログランク検定[片側](層別因子は無作為割付時の層別因子)(名目上のp値)
- 無増悪生存期間(PFS)については、中間解析(追跡期間中央値7.9ヵ月)では、イピリムマブ群に対するキイトルーダ®10mg/kg Q3W群及びQ2W群のハザード比がそれぞれ0.58(95%CI:0.47, 0.72)及び0.58(95%CI:0.46, 0.72)であり、PFSを有意に改善しました(キイトルーダ®10mg/kg Q3W群p<0.00001及びQ2W群p<0.00001、層別ログランク検定[片側]、有意水準α=0.002;検証的解析結果)。
- 最終解析(追跡期間中央値22.9ヵ月)では、イピリムマブ群に対するキイトルーダ®10mg/kg Q3W群及びQ2W群のハザード比はそれぞれ0.61(95%CI:0.50, 0.75)でした。
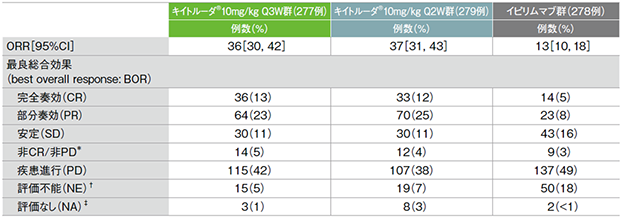
副次評価項目 奏効率:ORR
奏効率(ORR)(ITT集団)
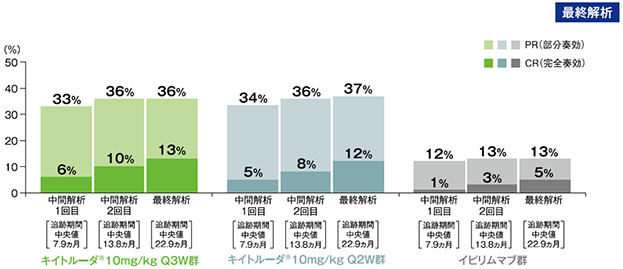
最終解析(追跡期間中央値22.9ヵ月)
RECISTガイドライン1.1版を用いた独立した中央判定委員会による評価
*ベースラインにおいて独立した中央判定委員会による測定可能疾患がない症例(CR/PDではない)
† ベースライン以降の画像評価で描出されない標的病変又は標的病変の外科切除
‡ ベースライン以降、画像評価施行なし又は画像が評価不能
(追跡期間中央値:22.9ヵ月)
- 奏効率(ORR)は、キイトルーダ®10mg/kg Q3W群で36%(95%CI:30, 42)、10mg/kg Q2W群で37%(95%CI:31, 43)でした。
探索的評価項目 奏効持続期間
奏効持続期間のKaplan-Meier曲線(ITT集団)
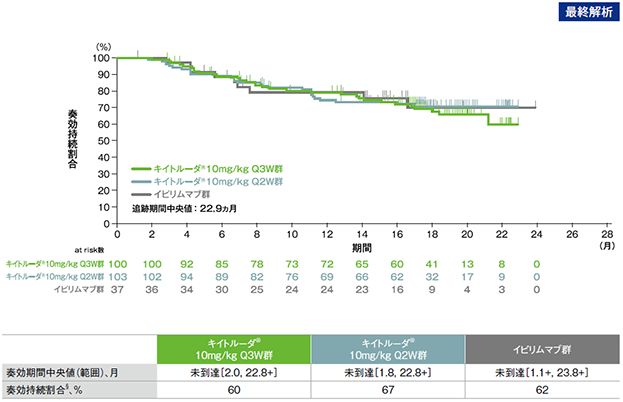
RECISTガイドライン1.1版を用いた独立した中央判定委員会による評価
「+」は最終評価時点(打ち切り)までに疾患進行がないことを示す
§ 疾患進行、死亡または新たな抗がん治療がない患者
- 最終解析(追跡期間中央値22.9ヵ月)において、キイトルーダ®投与で奏効が得られた患者のうち、Q3W群60%及びQ2W群67%で奏効が持続しました。奏効期間の中央値は、それぞれ未到達でした。
サブグループ解析 BRAF遺伝子変異別、治療歴の有無別の全生存期間:OS
BRAF遺伝子変異別、治療歴の有無別の全生存期間(OS)のKaplan-Meier曲線(ITT集団)

- キイトルーダ®併合群における6ヵ月生存率は、BRAF遺伝子変異ありの群で86.6%、なしの群で86.0%でした。
- キイトルーダ®併合群における6ヵ月生存率は、BRAF遺伝子変異ありのBRAF阻害剤未治療の群で93.5%、既治療の群で78.1%でした。
主な副作用(いずれかの群で発現率5%以上)(APaT集団)
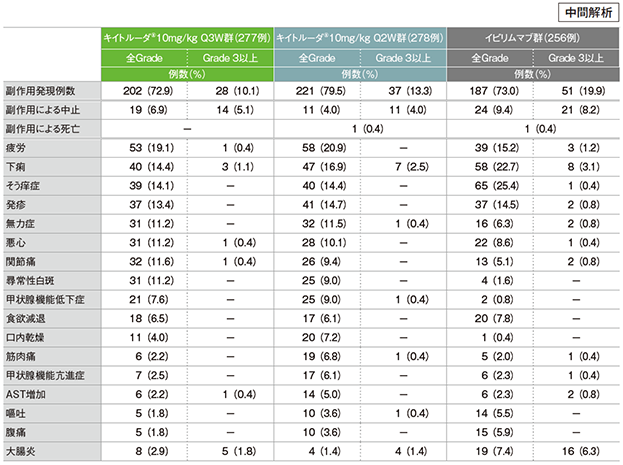
MedDRA/J v17.1、GradeはCTCAE v4.0
- キイトルーダ®10mg/kg Q3W群で副作用は202/277例(72.9%)に認められました。主な副作用(発現率10%以上)は、疲労53例(19.1%)、下痢40例(14.4%)、そう痒症39例(14.1%)、発疹37例(13.4%)、関節痛32例(11.6%)、悪心31例(11.2%)、無力症31例(11.2%)、尋常性白斑31例(11.2%)でした。重篤な副作用は18例(6.5%)認められました。主な重篤な副作用(1%以上)は大腸炎5例(2.2%)でした。副作用による中止は19例(6.9%)で、その内訳は大腸炎が5例(1.8%)、認知障害、肝炎、肺臓炎、アナフィラキシー様反応、食道炎、腎不全、咳嗽、血小板減少症、自己免疫性肝炎、薬物性肝障害、ギランバレー症候群、関節痛、唾液腺障害、尋常性白斑、1型糖尿病、リパーゼ増加、多発ニューロパチー、視神経炎が各1例(0.4%)でした。副作用による死亡例はみられませんでした。
- キイトルーダ®10mg/kg Q2W群で副作用は221/278例(79.5%)に認められました。主な副作用(発現率10%以上)は、疲労58例(20.9%)、下痢47例(16.9%)、発疹41例(14.7%)、そう痒症40例(14.4%)、無力症32例(11.5%)、悪心28例(10.1%)でした。重篤な副作用は31例(11.2%)に認められました。主な重篤な副作用(1%以上)は大腸炎4例(1.4%)、下痢8例(2.9%)、自己免疫性肝炎3例(1.1%)でした。副作用による中止は11例(4.0%)で、その内訳は大腸炎が3例(1.1%)、脳炎、てんかん、副腎不全、薬物過敏症、シェーグレン症候群、自己免疫性膵炎、乾癬、自己免疫性肝炎が各1例(0.4%)でした。副作用による死亡は出血性卒中1例(0.4%)でした。
- イピリムマブ群で副作用は187/256例(73.0%)に認められました。主な副作用(発現率10%以上)は、そう痒症65例(25.4%)、下痢58例(22.7%)、疲労39例(15.2%)、発疹37例(14.5%)でした。重篤な副作用は45例(17.6%)に認められました。主な重篤な副作用(1%以上)は大腸炎16例(6.3%)、下痢10例(3.9%)でした。副作用による中止は24例(9.4%)で、その内訳は大腸炎が9例(3.5%)、下痢が5例(2.0%)、肝細胞損傷が2例(0.8%)、関節痛、筋肉痛、自己免疫性肝炎、下垂体機能低下症、ALT増加、AST増加、発疹、結腸膿瘍、肝障害、過敏症、腸炎が各1例(0.4%)でした。副作用による死亡は下痢の合併症1例(0.4%)でした。
免疫関連など特に注目すべき有害事象(APaT集団)
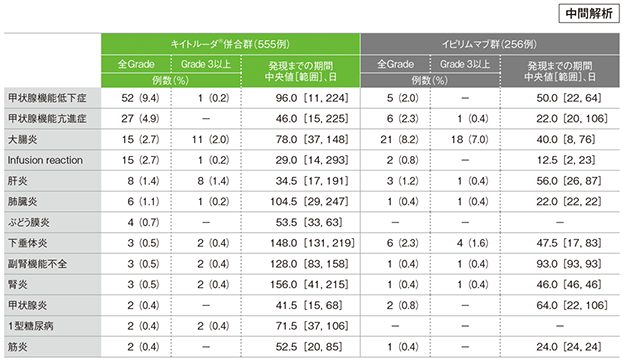
MedDRA/J v17.1、GradeはCTCAE v4.0
- 主な免疫関連など特に注目すべき有害事象(発現率5%以上)は、キイトルーダ®併合群では甲状腺機能低下症52例(9.4%)であり、イピリムマブ群では大腸炎21例(8.2%)でした。
主な副作用(いずれかの群で発現率10%以上)(APaT集団)
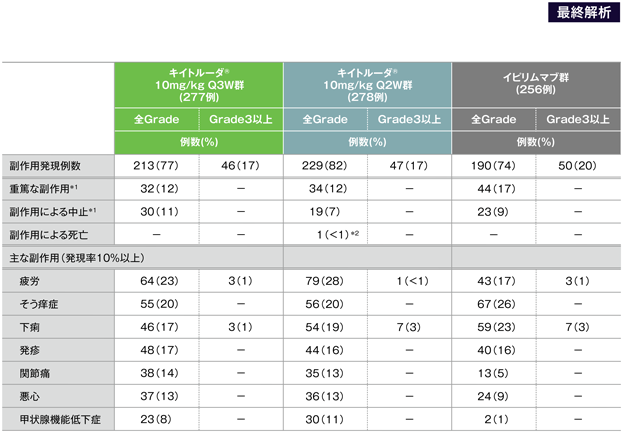
*1 Schachter J et al. Lancet 2017; 390: 1853-1862に重篤な副作用、副作用による中止の内訳は記載されていない。
*2 敗血症による死亡
Schachter J et al. Lancet 2017; 390: 1853-1862.
本試験はMSD社の資金により行われた。