データカットオフ:2019年9月9日
MSI-High固形癌:国際共同臨床試験成績:国際共同第Ⅱ相試験〈KEYNOTE-164試験(コホートA)※〉 最終解析(データカットオフ:2019年9月9日)
承認時評価資料:国際共同第Ⅱ相試験(KEYNOTE-164試験)
Le DT et al. J Clin Oncol 2020; 38: 11-19
社内資料:国際共同第Ⅱ相試験(KEYNOTE-164試験)最終解析(承認条件に係る解析)
本試験はMSD社の資金提供を受けており、著者らは同社の社員や謝金を受領したものを含みます。
※本試験はコホートAと、コホートAの組み入れ終了後に新たに追加されたコホートBで構成されています。
評価資料として審査されたコホートAの成績についてご紹介します。
コホートAの有効性の結果は、「PCR法によりMSI-High又は免疫組織化学染色(IHC)法によりMMR欠損と判定された患者(広義:全集団 61例)」、及び「PCR法によりMSI-Highと判定された患者(狭義:全集団 39例))」での結果をあわせて記載します。
試験概要
【目的】フッ化ピリミジン系抗悪性腫瘍剤、オキサリプラチン及びイリノテカンの3剤による化学療法歴のある治癒切除不能な進行・再発のミスマッチ修復(MMR)欠損又は高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸癌(CRC)患者におけるキイトルーダ®の有効性及び安全性を検討する。
【デザイン】国際共同非無作為化非盲検第Ⅱ相試験
【対象】フッ化ピリミジン系抗悪性腫瘍剤、オキサリプラチン及びイリノテカンの3剤による化学療法歴のある治癒切除不能な進行・再発のミスマッチ修復(MMR)欠損又はMSI-Highを有する結腸・直腸癌(CRC)患者61例(日本人7例を含む)
【方法】キイトルーダ®200mgを3週間間隔(Q3W)で点滴静注した。9週間毎に画像検査による評価を行い、疾患進行(PD)又は許容できない有害事象の発現等による投与中止まで、最長約2年間投与を継続した。
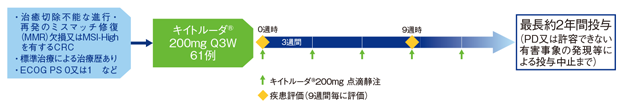
【評価項目】主要評価項目:奏効率(overall response rate; ORR)
副次評価項目:病勢コントロール率(disease control rate;DCR)、奏効期間(duration of response; DOR)、無増悪生存期間(progression free survival; PFS)、全生存期間(overall survival; OS)、安全性
【判定基準】ORR、DCR、DOR、PFSは、独立判定委員会(independent review committee; IRC)がRECISTガイドライン1.1版に基づき評価した。
【解析計画】解析対象集団:有効性及び安全性の主要解析はASaT集団*を対象として実施した。
有効性評価の統計手法:ORR、DCRは、点推定値及び二項分布に基づく正確法による95%信頼区間(CI)を算出した。
DOR、PFS、OSは、Kaplan-Meier法による生存曲線及びその中央値の推定値を計算した。
また、サブグループ解析として、日本人集団におけるORR、DCR、DOR、PFS、OSは、治験実施計画書に記載されていないが、全体集団と同様の統計手法にて検討し、評価資料として承認時に評価された。
【データカットオフ】 2017年2月10日(承認時評価資料)、2019年9月9日(最終解析)
*ASaT(all subjects as treated)集団:治験薬を1回以上投与されたすべての患者
5. 効能又は効果に関連する注意(抜粋)
〈がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)〉
5.9 十分な経験を有する病理医又は検査施設における検査により、MSI-Highが確認された進行・再発の固形癌患者に投与すること。検査にあたっては、関連学会のガイドライン等の最新の情報を参考に、先行の化学療法等によるMSI検査結果への影響及び検査に用いる検体の採取時期について確認し、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.10 結腸・直腸癌以外の固形癌の場合、本剤の一次治療における有効性及び安全性は確立していない。また、二次治療において標準的な治療が可能な場合にはこれらの治療を優先すること。
5.11 本剤の手術の補助療法における有効性及び安全性は確立していない。
5.12 臨床試験に組み入れられた患者のがん種等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと。[17.1.14、17.1.15参照]
患者背景(ASaT集団)
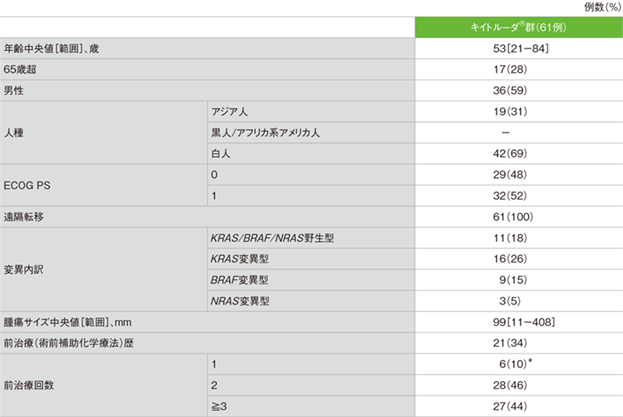
*術後補助療法を受け、投与終了後6ヵ月以内に疾患進行が認められた場合、前治療1とカウントされた
Le DT et al. J Clin Oncol 2020; 38: 11-19より作成
本試験はMSD社の資金提供を受けており、著者らは同社の社員や謝金を受領したものを含みます。
主要評価項目 奏効率:ORR、副次評価項目 病勢コントロール率:DCR
奏効率(ORR)(ASaT集団)
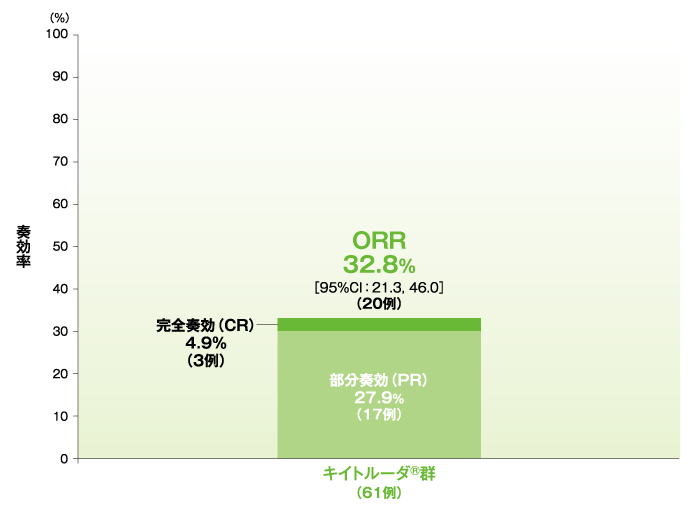
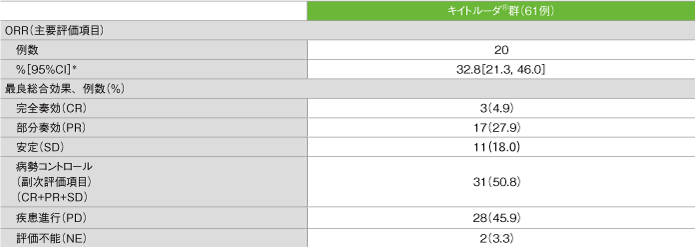
*二項分布の確率計算による正確法
社内資料:国際共同第Ⅱ相試験(KEYNOTE-164試験)最終解析(承認条件に係る解析)より作成
- ORRは32.8%(95%CI:21.3, 46.0)、DCRは50.8%でした。
副次評価項目 奏効期間:DOR
データカットオフ:2019年9月9日(追跡期間中央値31.4ヵ月)における ASaT集団の IRC評価による DORの中央値は、未到達であった。
社内資料:国際共同第Ⅱ相試験(KEYNOTE-164試験)最終解析(承認条件に係る解析)
副次評価項目 無増悪生存期間:PFS
無増悪生存期間(PFS)のKaplan-Meier曲線(ASaT集団)
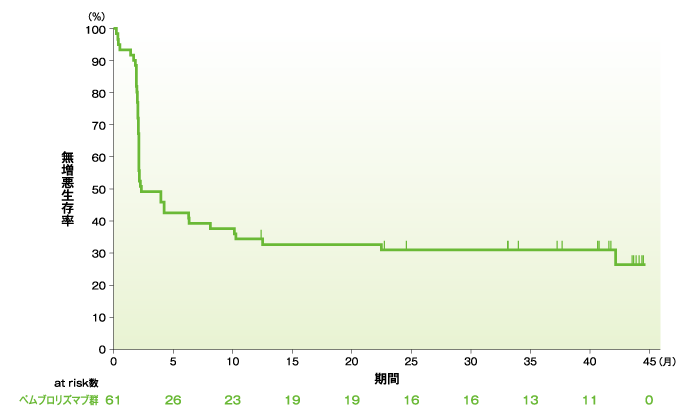
社内資料:国際共同第Ⅱ相試験(KEYNOTE-164試験)最終解析(承認条件に係る解析)
無増悪生存期間(PFS)の要約(ASaT集団)
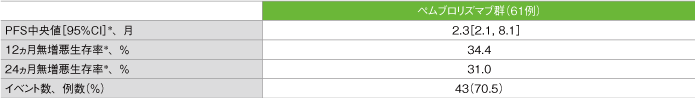
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-164試験)最終解析(承認条件に係る解析)より作成
- PFS中央値は2.3ヵ月(95%CI:2.1, 8.1)でした。12ヵ月無増悪生存率は34.4%、24ヵ月無増悪生存率は31.0%でした。
副次評価項目 全生存期間:OS
全生存期間(OS)のKaplan-Meier曲線(ASaT集団)
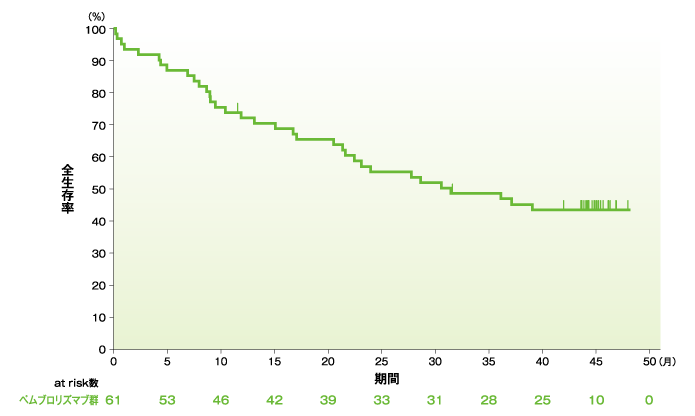
社内資料:国際共同第Ⅱ相試験(KEYNOTE-164試験)最終解析(承認条件に係る解析)
全生存期間(OS)の要約(ASaT集団)
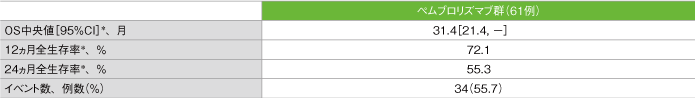
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
社内資料:国際共同第Ⅱ相試験(KEYNOTE-164試験)最終解析(承認条件に係る解析)より作成
- OS中央値は31.4ヵ月(95%CI:21.4, 未到達)でした。12ヵ月全生存率は72.1%、24ヵ月全生存率は55.3%でした。
主な副作用(ASaT集団)
- 副作用は39/61例(63.9%)に認められました。主な副作用(発現率10%以上)は、関節痛、悪心各10例(16.4%)、下痢、無力症、そう痒症各8例(13.1%)でした。重篤な副作用は、脱水、多形紅斑、膵炎、麻痺、扁平上皮癌各1例(1.6%)でした。副作用による中止としてアラニンアミノトランスフェラーゼ増加1例と肺臓炎1例が認められました。本試験において、副作用による死亡は認められませんでした。
主な副作用(発現率10%以上)
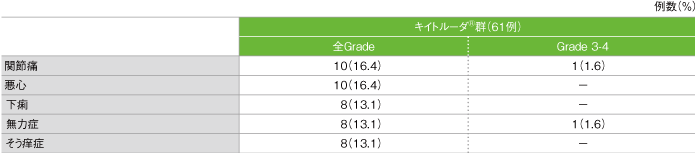
GradeはCTCAE v4.0
社内資料:国際共同第Ⅱ相試験(KEYNOTE-164試験)最終解析(承認条件に係る解析)より作成
免疫関連など特に注目すべき有害事象(ASaT集団)
- 免疫関連など特に注目すべき有害事象は13/61例(21.3%)に認められました。主な免疫関連など特に注目すべき有害事象(発現率5%以上)は、甲状腺機能低下症6例(9.8%)でした。
免疫関連など特に注目すべき有害事象
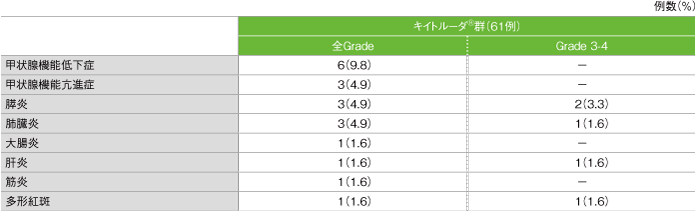
GradeはCTCAE v4.0
社内資料:国際共同第Ⅱ相試験(KEYNOTE-164試験)最終解析(承認条件に係る解析)より作成