KEYNOTE-189試験(拡大コホートを含む日本人集団)
国際共同第Ⅲ相試験:KEYNOTE-189試験(拡大コホートを含む日本人集団)
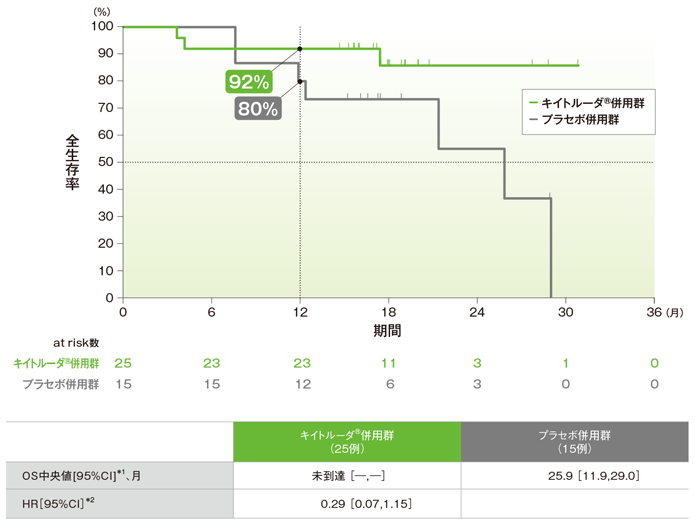
拡大コホートを含む日本人集団における全生存期間:OS(主要評価項目)
全生存期間(OS)のKaplan-Meier曲線(ITT集団)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 Cox比例ハザードモデルに基づく
(追跡期間中央値:18.5ヵ月)(データカットオフ日:2019年5月20日)
Horinouchi H et al. Cancer Sci 2021; 112: 3255-3265
本試験はMSD社の資金提供により行われた。
OS中央値はキイトルーダ®併用群で未到達、プラセボ併用群で25.9ヵ月でした。プラセボ併用群に対するキイトルーダ®併用群のOSのハザード比は0.29でした。
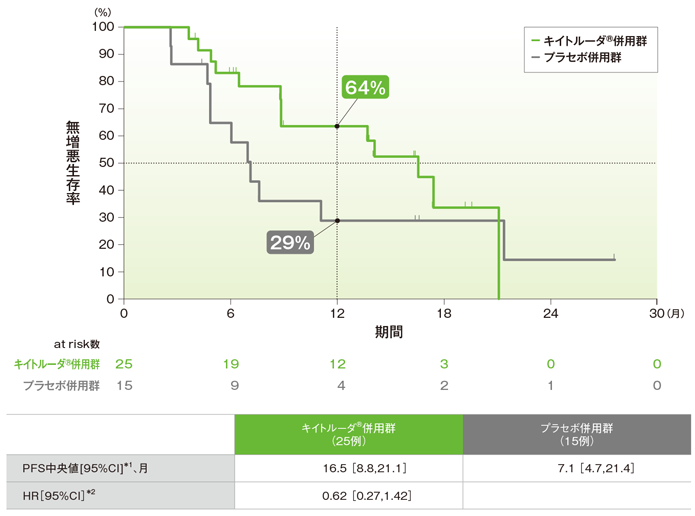
拡大コホートを含む日本人集団における無増悪生存期間:PFS(主要評価項目)
無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 Cox比例ハザードモデルに基づく
(追跡期間中央値:18.5ヵ月)(データカットオフ日:2019年5月20日)
Horinouchi H et al. Cancer Sci 2021; 112: 3255-3265
本試験はMSD社の資金提供により行われた。
PFS中央値はキイトルーダ®併用群で16.5ヵ月、プラセボ併用群で7.1ヵ月でした。プラセボ併用群に対するキイトルーダ®併用群のPFSのハザード比は0.62でした。
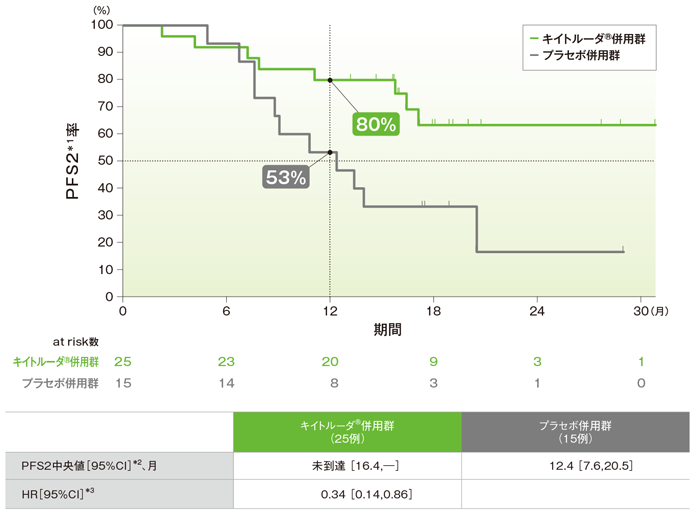
拡大コホートを含む日本人集団におけるランダム化割り付けから2次治療での病勢進行、又は死亡のいずれかが先に起こるまでの期間:PFS2(探索的評価項目)
PFS2のKaplan-Meier曲線(ITT集団)
*1 ランダム化割り付けから2次治療での病勢進行、又は死亡のいずれかが先に起こるまでの期間
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 Cox比例ハザードモデルに基づく
(追跡期間中央値:18.5ヵ月)(データカットオフ日:2019年5月20日)
Horinouchi H et al. Cancer Sci 2021; 112: 3255-3265
本試験はMSD社の資金提供により行われた。
PFS2中央値はキイトルーダ®併用群で未到達、プラセボ併用群が12.4ヵ月でした。プラセボ併用群に対するキイトルーダ®併用群のPFS2のハザード比は0.34でした。
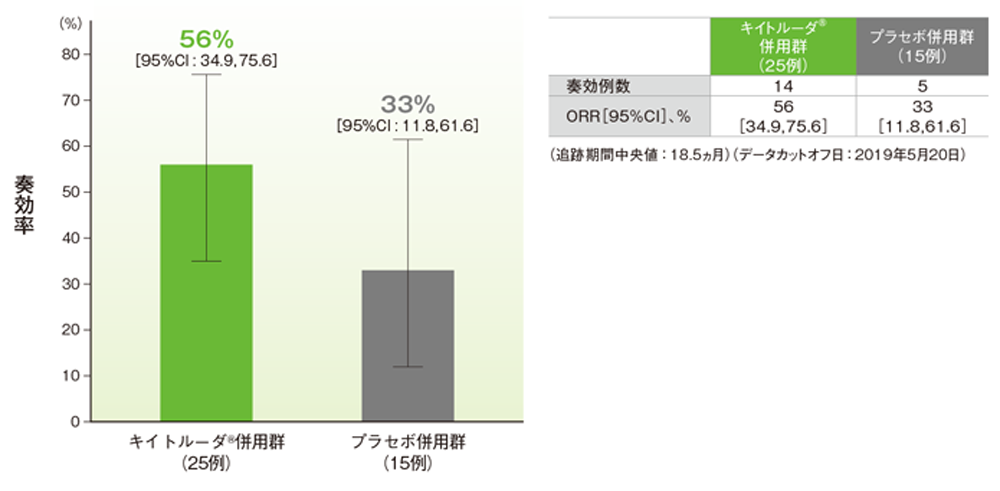
拡大コホートを含む日本人集団における奏効率:ORR(副次評価項目)
奏効率(ORR)の要約(ITT集団)
Horinouchi H et al. Cancer Sci 2021; 112: 3255-3265
本試験はMSD社の資金提供により行われた。
奏効率はキイトルーダ®併用群で56%、プラセボ併用群で33%でした。
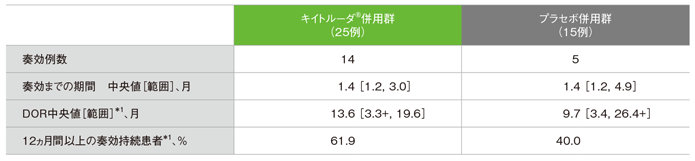
拡大コホートを含む日本人集団における奏効までの期間及び奏効期間:DOR(副次評価項目)
奏効までの期間及び奏効期間(DOR)の要約
「+」は最後の疾患評価までPDがみられなかったことを示す
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
(追跡期間中央値:18.5ヵ月)(データカットオフ日:2019年5月20日)
Horinouchi H et al. Cancer Sci 2021; 112: 3255-3265
本試験はMSD社の資金提供により行われた。
キイトルーダ®併用群で奏効を達成した14例において、奏効までの期間中央値は1.4ヵ月、奏効期間中央値は13.6ヵ月で、12ヵ月以上奏効が持続した患者の割合は61.9%でした。
一方、プラセボ併用群で奏効を達成した5例において、奏効までの期間中央値は1.4ヵ月、奏効期間中央値は9.7ヵ月で、12ヵ月以上の奏効が持続した患者の割合は40.0%でした。
拡大コホートを含む日本人集団における安全性
【有害事象】
キイトルーダ®併用群:25/25例(100%) Grade 3-4の有害事象:18例(72%)
プラセボ併用群:15/15例(100%) Grade 3-4の有害事象:9例(60%)
【いずれか又はすべての試験薬の投与中止に至った有害事象】
キイトルーダ®併用群:9例(36%)
プラセボ併用群:3例(20%)
【死亡に至った有害事象】
キイトルーダ®併用群:認められなかった
プラセボ併用群:認められなかった
*重篤な有害事象及び投与中止に至った有害事象の内訳は論文中に記載なし
(データカットオフ日:2019年5月20日)
Horinouchi H et al. Cancer Sci 2021; 112: 3255-3265
本試験はMSD社の資金提供により行われた。
有害事象及び免疫関連など特に注目すべき有害事象一覧
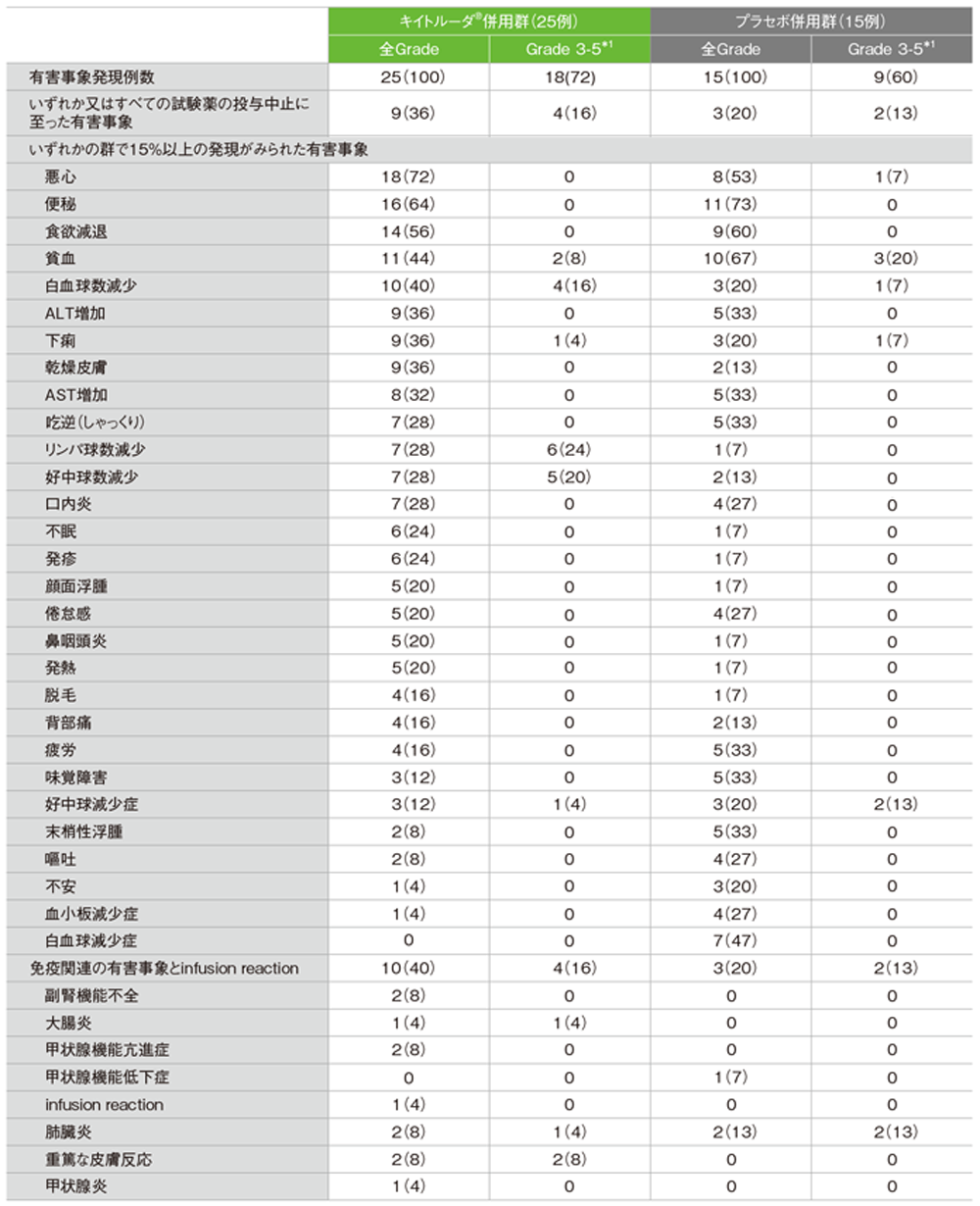
GradeはCTCAE version 4.0
*1 Grade 5の有害事象は認められなかった
※重篤な副作用、投与中止に至った副作用、死亡に至った副作用の内訳は資料中に記載なし
(追跡期間中央値:18.5ヵ月)(データカットオフ日:2019年5月20日)
Horinouchi H et al. Cancer Sci 2021; 112: 3255-3265
本試験はMSD社の資金提供により行われた。