KEYNOTE-407試験(最終解析)
主要評価項目 最終解析での全生存期間:OS
全生存期間(OS)のKaplan-Meier曲線(ITT集団)
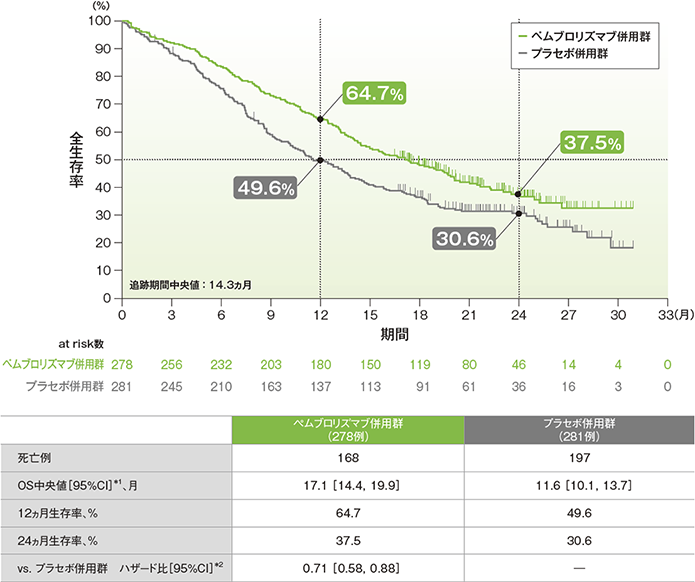
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、PD-L1発現(≥1%、<1%)、タキサン系薬剤(パクリタキセル、nab-パクリタキセル)、治験実施医療機関の地域(東アジア、東アジア以外)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:14.3ヵ月)(データカットオフ日:2019年5月9日)
- OS中央値は、キイトルーダ®併用群で17.1ヵ月(95%CI:14.4, 19.9)、プラセボ併用群で11.6ヵ月(95%CI:10.1, 13.7)でした。
主要評価項目 最終解析でのクロスオーバーの影響を補正した全生存期間:OS
全生存期間(OS)のKaplan-Meier曲線(ITT集団)
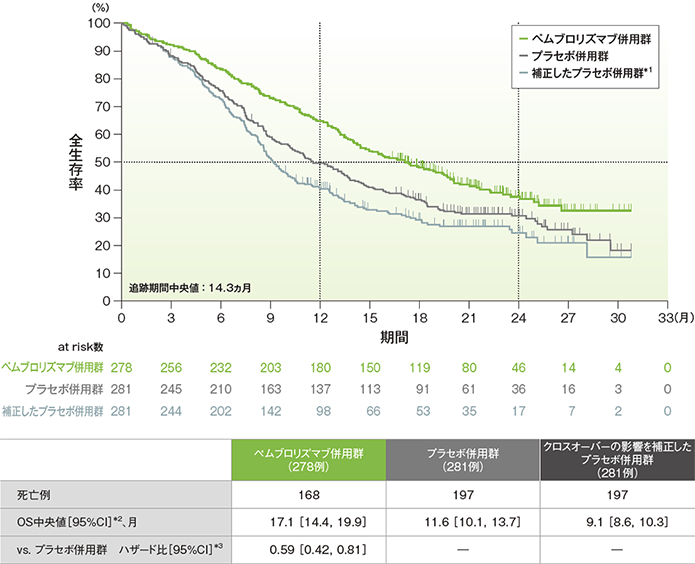
*1 two-stageモデルで補正
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 投与群を共変量とし、PD-L1発現(≥1%、<1%)、タキサン系薬剤(パクリタキセル、nab-パクリタキセル)、治験実施医療機関の地域(東アジア、東アジア以外)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:14.3ヵ月)(データカットオフ日:2019年5月9日)
- OS中央値は、クロスオーバーの影響を補正する前のプラセボ併用群では11.6ヵ月(95%CI:10.1, 13.7)でしたが、補正後は9.1ヵ月(95%CI:8.6, 10.3)となりました。
- クロスオーバーの影響を補正したプラセボ併用群に対するキイトルーダ®併用群のハザード比は0.59(95%CI:0.42, 0.81)でした。
主要評価項目 最終解析での無増悪生存期間:PFS
無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
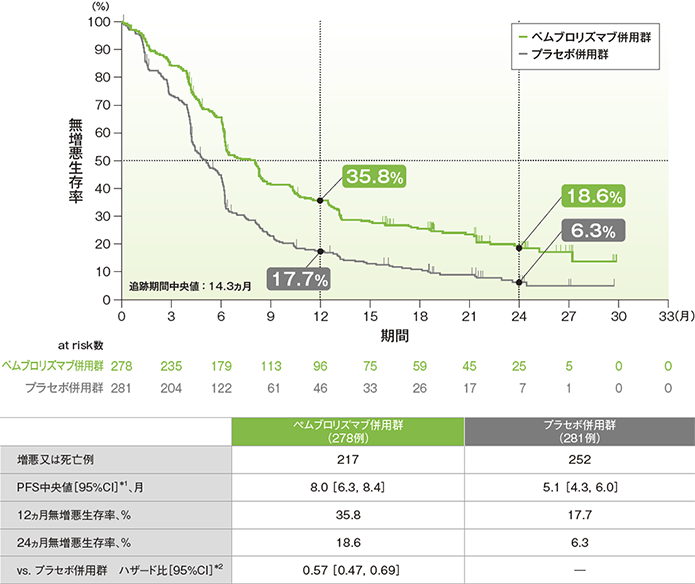
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、PD-L1発現(≥1%、<1%)、タキサン系薬剤(パクリタキセル、nab-パクリタキセル)、治験実施医療機関の地域(東アジア、東アジア以外)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:14.3ヵ月)(データカットオフ日:2019年5月9日)
- PFS中央値は、キイトルーダ®併用群で8.0ヵ月(95%CI:6.3, 8.4)、プラセボ併用群で5.1ヵ月(95%CI:4.3, 6.0)でした。
副次評価項目 最終解析での奏効率:ORR
奏効率(ORR)の要約(ITT集団)
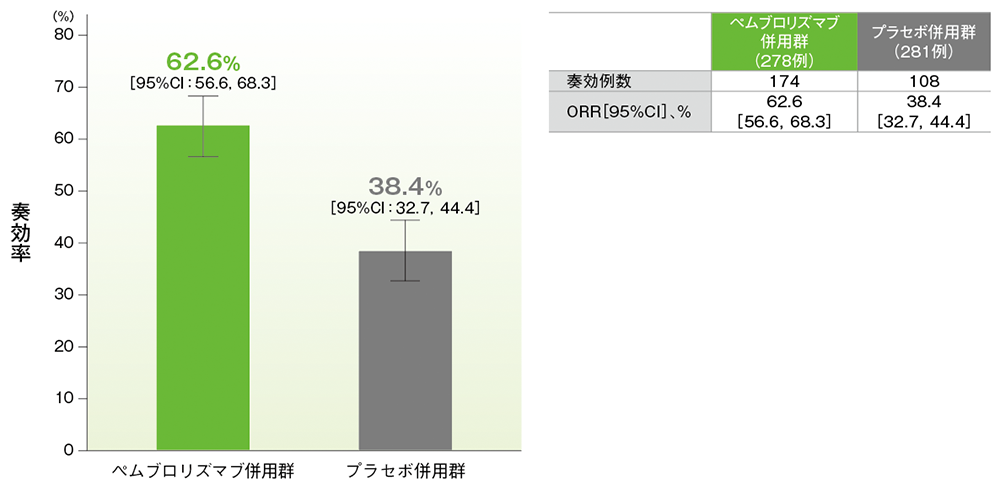
(追跡期間中央値:14.3ヵ月)(データカットオフ日:2019年5月9日)
- ORRは、キイトルーダ®併用群で62.6%(95%CI:56.6, 68.3)、プラセボ併用群で38.4%(95%CI:32.7, 44.4)でした。
副次評価項目 最終解析での奏効期間:DOR
最終解析での奏効期間(DOR)の要約(ITT集団)
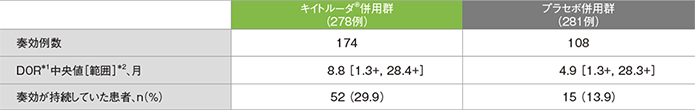
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までPDがみられなかったことを示す
(追跡期間中央値:14.3ヵ月)(データカットオフ日:2019年5月9日)
- DOR中央値は、キイトルーダ®併用群で8.8ヵ月(範囲:1.3+, 28.4+)、プラセボ併用群で4.9ヵ月(範囲:1.3+, 28.3+)でした。
- データカットオフ時点で、キイトルーダ®併用群では奏効例174例中52例(29.9%)、プラセボ併用群では奏効例108例中15例(13.9%)に奏効の持続が認められました。
最終解析での副作用(ASaT集団)
【副作用1)】
- ぺムブロリズマブ併用群:266例(95.7%)
- プラセボ併用群:252例(90.0%)
【重篤な副作用1)】
- ぺムブロリズマブ併用群:75例(27.0%) 内訳(2例以上):発熱性好中球減少症14例(5.0%)、好中球減少症、肺炎、肺臓炎各7例(2.5%)、血小板減少症、大腸炎各6例(2.2%)、貧血、下痢、注入に伴う反応各5例(1.8%)、白血球減少症、敗血症各4例(1.4%)、発熱、自己免疫性肝炎各3例(1.1%)、十二指腸炎、死亡、低ナトリウム血症、間質性肺疾患各2例(0.7%)
- プラセボ併用群:52例(18.6%) 内訳(2例以上):発熱性好中球減少症9例(3.2%)、好中球減少症8例(2.9%)、貧血5例(1.8%)、下痢、無力症、肺炎各4例(1.4%)、血小板減少症、急性腎障害各3例(1.1%)、疲労、間質性肺疾患、敗血症性ショック、低血圧各2例(0.7%)
【投与中止に至った副作用1)】
ぺムブロリズマブ併用群
- ペムブロリズマブの投与中止に至った副作用:40例(14.4%) 内訳(2例以上):自己免疫性肝炎6例(2.2%)、肺臓炎5例(1.8%)、大腸炎、敗血症各3例(1.1%)、下痢2例(0.7%)
- 化学療法の投与中止に至った副作用:32例(11.5%) 内訳(2例以上):好中球減少症6例(2.2%)、注入に伴う反応、敗血症各3例(1.1%)、発熱性好中球減少症、末梢性感覚ニューロパチー各2例(0.7%)
プラセボ併用群
- プラセボの投与中止に至った副作用:9例(3.2%) 内訳(2例以上):敗血症性ショック2例(0.7%)
- 化学療法の投与中止に至った副作用:21例(7.5%) 内訳(2例以上):好中球減少症、血小板減少症各3例(1.1%)、急性腎障害、敗血症性ショック各2例(0.7%)
【死亡に至った副作用2)】
- ぺムブロリズマブ併用群:12例(4.3%) 内訳:敗血症3例、死亡2例、心停止、心不全、肝不全、壊死性筋膜炎、肺臓炎、肺出血、呼吸不全各1例
- プラセボ併用群:5例(1.8%) 内訳:敗血症性ショック2例、肺炎、急性腎障害、肺出血各1例
注)プラセボ併用群からクロスオーバー後、最初の投与後に生じた有害事象は除外した
(データカットオフ日:2019年5月9日)
1)社内資料 KEYNOTE-407試験:安全性
2)Paz-Ares L et al. J Thorac Oncol 2020; 15: 1657-1669
本試験はMSD社の資金提供により行われた。
有害事象及び免疫関連など特に注目すべき有害事象一覧
(データカットオフ日:2019年5月9日)
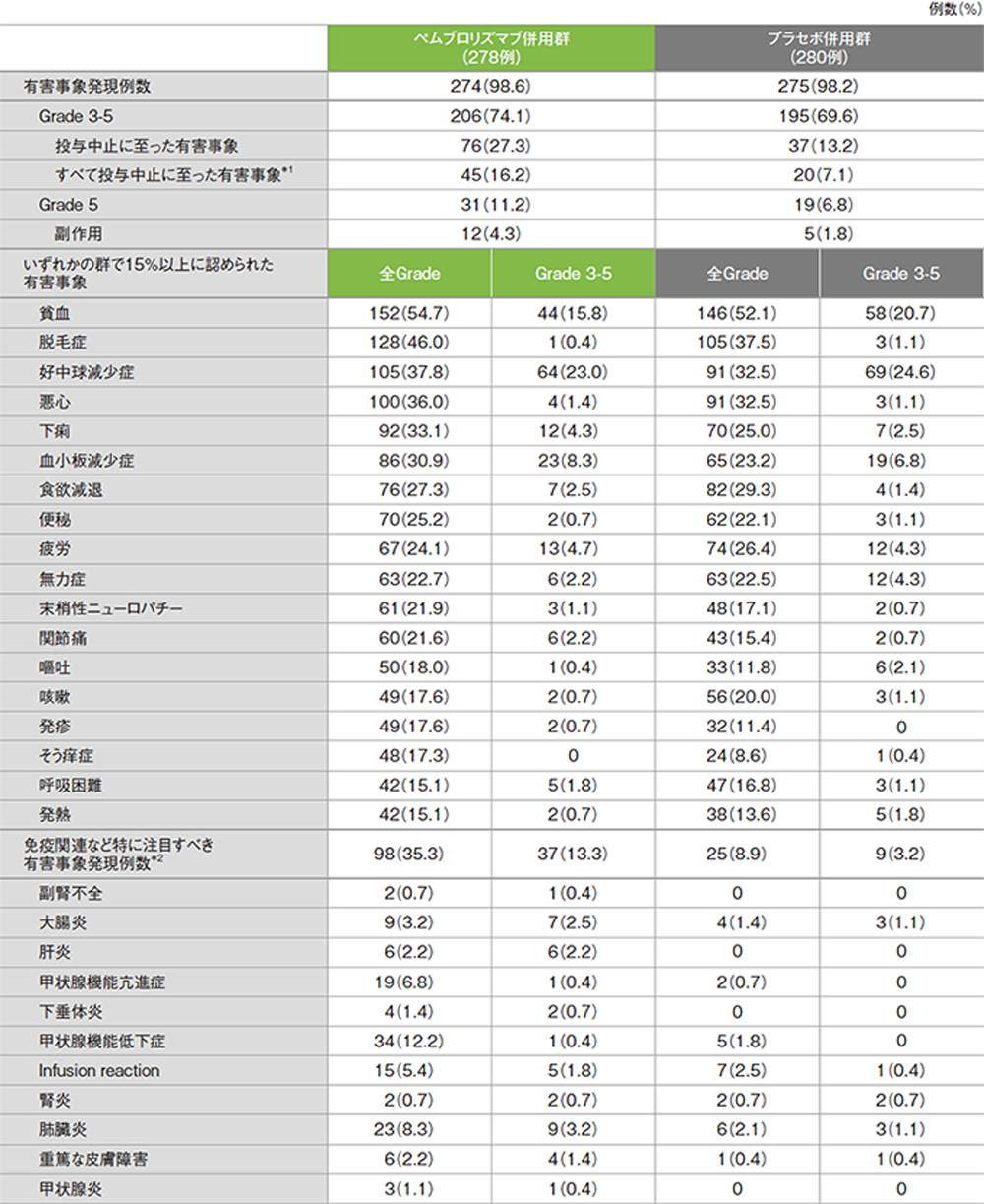
GradeはCTCAE version 4.03
*1 ペムブロリズマブ又はプラセボ、カルボプラチン、タキサンを投与中止した患者及びカルボプラチンとタキサンを4サイクル完了した後にペムブロリズマブ又はプラセボを投与中止した患者が含まれる
*2 死亡に至った有害事象は、ペムブロリズマブ併用群で肺臓炎1例、プラセボ併用群で肺臓炎1例に認められた