KEYNOTE-024試験(2年間フォローアップ)
副次評価項目 2年間フォローアップでの全生存期間:OS
全生存期間(OS)のKaplan-Meier曲線(ITT集団)
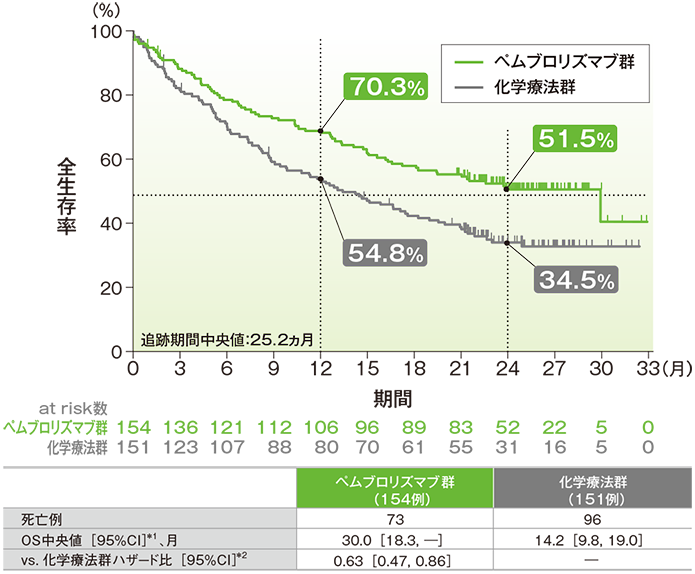
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、治験実施医療機関の地域(東アジア、東アジア以外)、ECOG PS(0、1)、非小細胞肺癌組織型(扁平上皮癌、非扁平上皮癌)を層別因子とした層別Cox比例ハザードモデルに基づく
Reprinted with permission. © 2019 American Society of Clinical Oncology. All rights reserved.
Reck M et al. J Clin Oncol 2019; 37(7): 537-546.
本試験はMSD社の資金提供により行われた。
- キイトルーダ®群の化学療法群に対するOSのハザード比は0.63(95%CI:0.47, 0.86)でした。
- OS中央値はキイトルーダ®群で30.0ヵ月(95%CI:18.3, 未到達)、化学療法群で14.2ヵ月(95%CI:9.8, 19.0)でした。
2年間フォローアップでの部分集団因子別にみた全生存期間:OS(サブグループ解析)
全生存期間(OS)のハザード比のフォレストプロット(ITT集団)
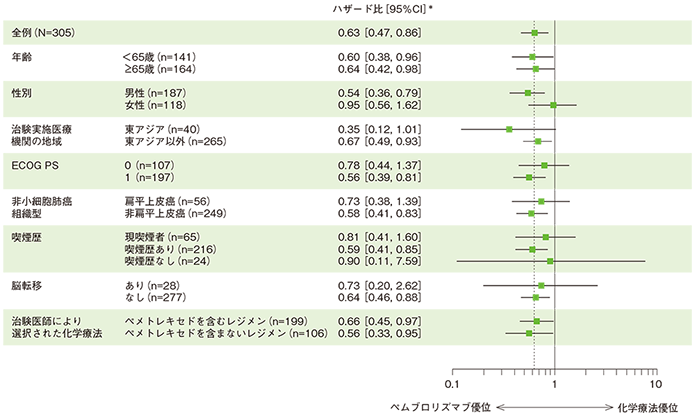
*投与群を共変量とし、治験実施医療機関の地域(東アジア、東アジア以外)、ECOG PS(0、1)、非小細胞肺癌組織型(扁平上皮癌、非扁平上皮癌)を層別因子とした層別Cox比例ハザードモデル
Reprinted with permission. © 2019 American Society of Clinical Oncology. All rights reserved.
Reck M et al. J Clin Oncol 2019; 37(7): 537-546.
本試験はMSD社の資金提供により行われた。
副次評価項目 2年間フォローアップでのクロスオーバーの影響を補正した全生存期間:OS
全生存期間(OS)のKaplan-Meier曲線(ITT集団)
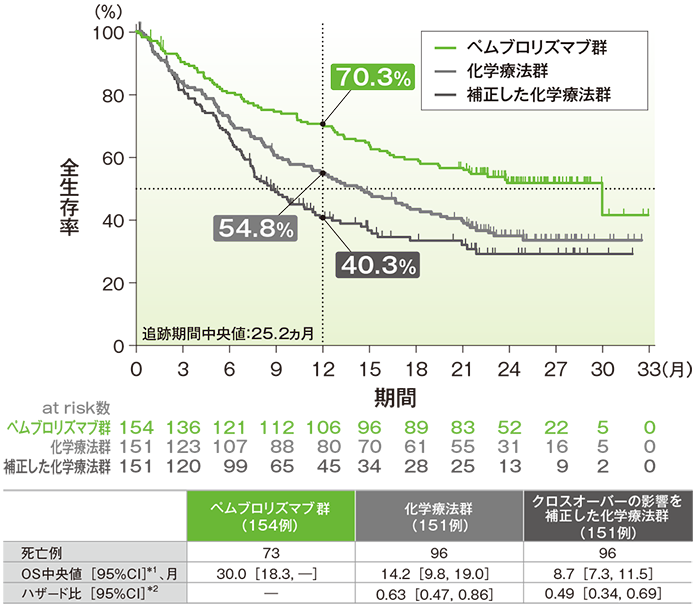
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、治験実施医療機関の地域(東アジア、東アジア以外)、ECOG PS(0、1)、非小細胞肺癌組織型(扁平上皮癌、非扁平上皮癌)を層別因子とした層別Cox比例ハザードモデルに基づく
Reprinted with permission. © 2019 American Society of Clinical Oncology. All rights reserved.
Reck M et al. J Clin Oncol 2019; 37(7): 537-546.
本試験はMSD社の資金提供により行われた。
- クロスオーバーの影響を補正した化学療法群のキイトルーダ®群に対するハザード比は0.49(95%CI:0.34, 0.69)でした。
- OS中央値はクロスオーバーの影響を補正する前の化学療法群では14.2ヵ月(95%CI:9.8, 19.0)でしたが、補正後は8.7ヵ月(95%CI:7.3, 11.5)となりました。
探索的評価項目 2年間フォローアップでのクロスオーバーにおいて奏効が認められた患者における奏効期間:DOR
奏効期間(DOR)のKaplan-Meier曲線(ITT集団)
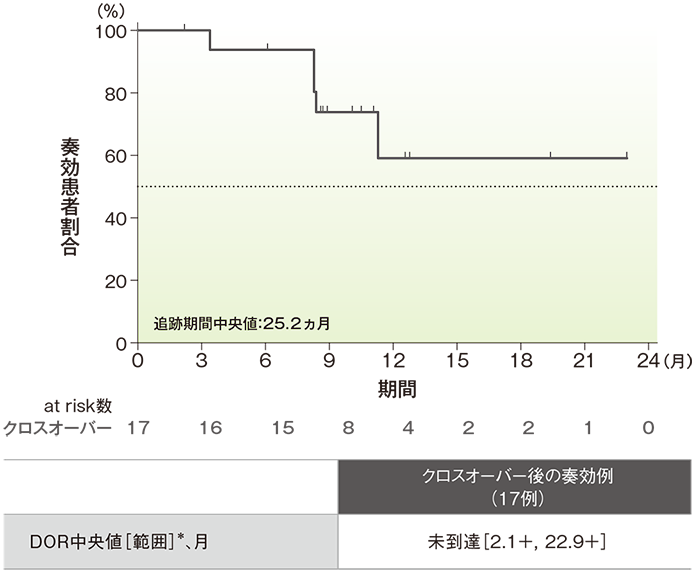
*「+」は最後の疾患評価までPDがみられなかったことを示す
Reprinted with permission. © 2019 American Society of Clinical Oncology. All rights reserved.
Reck M et al. J Clin Oncol 2019; 37(7): 537-546.
本試験はMSD社の資金提供により行われた。
安全性(2年間フォローアップ)
【重篤な副作用】1)
キイトルーダ®群:35例(22.7%) 内訳(2例以上):肺臓炎8例(5.2%)、下痢3例(1.9%)、ALT(GPT)上昇、大腸炎、下気道感染各2例(1.3%)
化学療法群:31例(20.7%) 内訳(2例以上):貧血4例(2.7%)、発熱性好中球減少症、汎血球減少症、肺炎、血小板減少症各3例(2.0%)、急性腎障害、鼻出血、肺感染各2例(1.3%)
【投与中止に至った副作用】1)
キイトルーダ®群:21例(13.6%) 内訳:肺臓炎8例(5.2%)、ALT(GPT)上昇、大腸炎、下痢各2例(1.3%)、血中クレアチニン増加、疲労、嘔吐、AST(GOT)上昇、手掌・足底発赤知覚不全症候群、突然死、トランスアミナーゼ上昇、ぶどう膜炎各1例(0.6%)
化学療法群:16例(10.7%) 内訳:疲労、血中クレアチニン増加各2例(1.3%)、嘔吐、急性腎障害、血中クレアチン増加、クレアチニン腎クリアランス減少、食欲減退、粘膜疹、発熱性好中球減少症、歩行障害、聴力低下、低酸素症、嗜眠、白血球増加症、悪心、末梢性感覚ニューロパチー、血小板数減少、肺胞出血、肺敗血症、気道感染各1例(0.7%)
【死亡に至った副作用】2)
キイトルーダ®群:2例(1.3%) 内訳:肺臓炎、突然死各1例
化学療法群:3例(2.0%) 内訳:肺敗血症、肺胞出血、死亡各1例
(データカットオフ日:2017年7月10日)
1)社内資料:KEYNOTE-024試験:安全性
2)Reck M et al. J Clin Oncol 2019; 37: 537-546
本試験はMSD社の資金提供により行われた。
副作用一覧(ASaT集団)
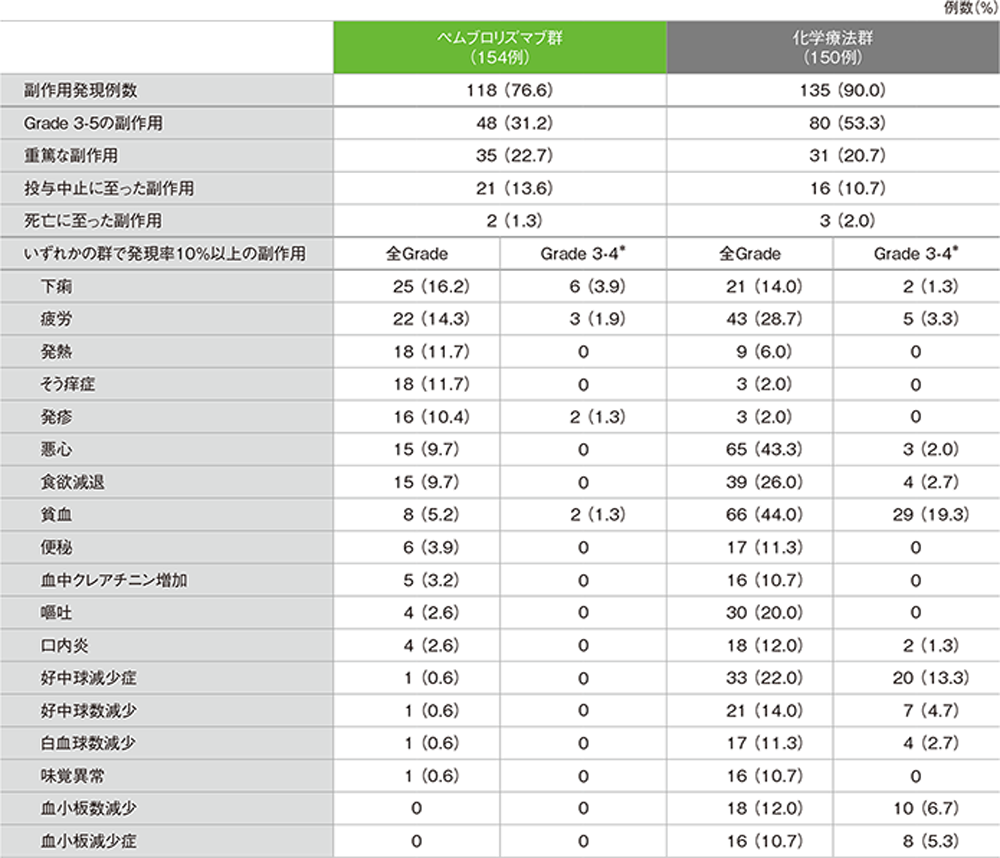
*ペムブロリズマブ群の2例(肺臓炎及び突然死)、化学療法群の3例(死亡、肺敗血症及び肺胞出血)でGrade 5の副作用が認められた
Reprinted with permission. © 2019 American Society of Clinical Oncology. All rights reserved.
Reck M et al. J Clin Oncol 2019; 37(7): 537-546.
本試験はMSD社の資金提供により行われた。
2年間フォローアップでの免疫関連など特に注目すべき有害事象(ASaT集団)
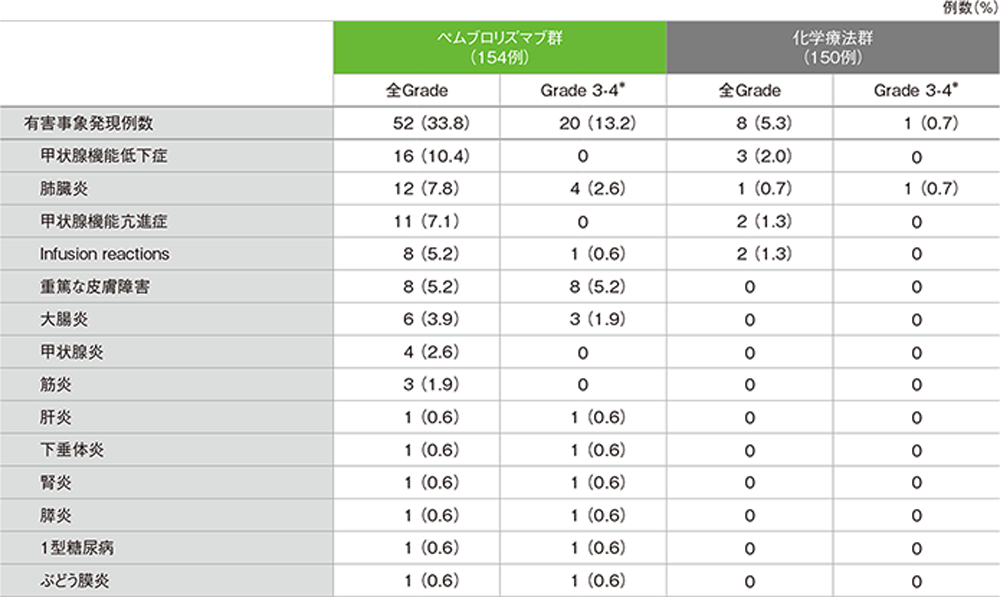
*ペムブロリズマブ群で1例(肺臓炎)でGrade 5の免疫関連など特に注目すべき有害事象が認められた
Reprinted with permission. © 2019 American Society of Clinical Oncology. All rights reserved.
Reck M et al. J Clin Oncol 2019; 37(7): 537-546.
本試験はMSD社の資金提供により行われた。