安全性関連
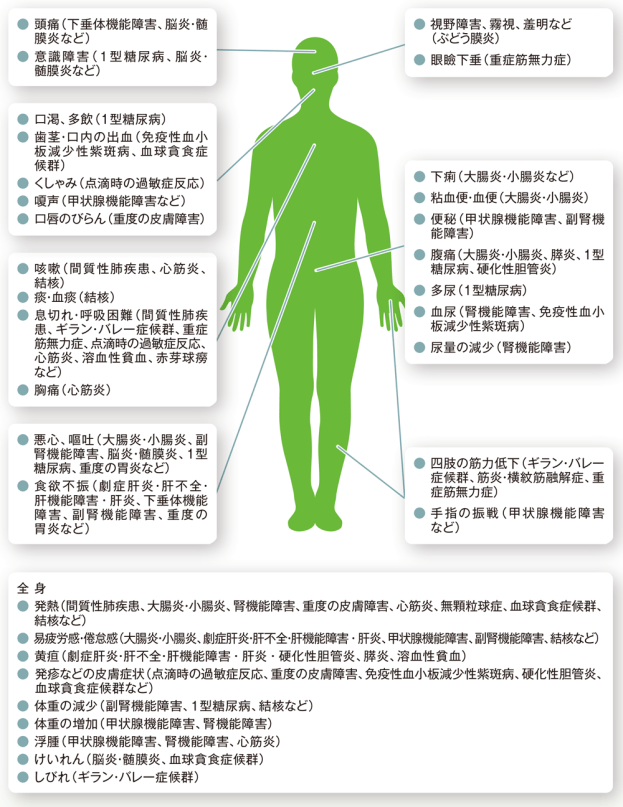
キイトルーダ®投与において注意を要する有害事象とその症状
キイトルーダ®において報告されている注意を要する有害事象の発現時期の目安*
単独投与時

*データは、本剤2mg/kg※もしくは200mgを3週間間隔又は10mg/kgを2週間もしくは3週間間隔※で単独投与した臨床試験で発現した有害事象の併合解析に基づく(本サイト掲載の臨床試験は「適正使用ガイド」参照)。
※キイトルーダ®の本用法及び用量は、現在承認されている用法及び用量と異なります。
併用投与時

*データは、本剤200mgを3週間間隔で併用投与した臨床試験で発現した有害事象の併合解析に基づく(本サイト掲載の臨床試験は「適正使用ガイド」参照)。
キイトルーダ®の用法及び用量は以下のとおりです。
6. 用法及び用量(抜粋)
〈悪性黒色腫〉通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。ただし、術後補助療法の場合は、投与期間は12ヵ月間までとする。
〈切除不能な進行・再発の非小細胞肺癌〉通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
関連コンテンツ
キイトルーダ®・悪性腫瘍関連領域情報
関連製品
