KEYNOTE-170試験
海外第Ⅱ相試験<KEYNOTE-170試験>(海外データ)
承認時評価資料: 海外第Ⅱ相試験(KEYNOTE-170試験)
Armand P et al. J Clin Oncol 2019; 37: 3291-3299 supplements Study Protocol 1
本試験はMSD社の資金提供により行われた。Philippe ArmandはMSD社から研究助成金などを受領している。
また、著者のうち、Arun Balakumaran、Robert Orlowskiは同社の社員である。
その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。
Zinzani PL et al. Blood 2023; 142: 141-145
本試験はMSD社の資金提供により行われた。Pier Luigi ZinzaniはMSD社から顧問料を受領している。著者のうち、Seth Thompson、Samhita Chakraborty、Patricia Marinelloは同社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。
試験概要
【 目 的 】再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫患者*1におけるキイトルーダ®の有効性及び安全性を検討する。
【デザイン】海外非盲検単群第Ⅱ相試験[主要評価項目データカットオフ日:2020年5月7日、追跡期間中央値22.3ヵ月(範囲:0.1, 50.4ヵ月)][4年フォローアップデータ解析時データカットオフ日:2020年10月23日、追跡期間中央値:48.7ヵ月(範囲:41.2, 56.2)]
【 対 象 】再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫患者53例
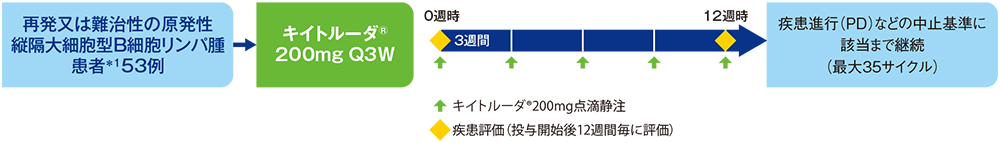
【 方 法 】キイトルーダ®200mgを3週間間隔(Q3W)で点滴静注した。投与12週間毎に画像検査による評価を行い、疾患進行(PD)などの中止基準に該当するまで、最大35サイクルとして継続した。
【評価項目】主要評価項目:奏効率(objective response rate; ORR)*2
副次評価項目: ORR*3、奏効期間(duration of response; DOR)*2, 3、病勢コントロール率(disease control rate; DCR)*2,3、無増悪生存期間(progression free survival; PFS)*2,3、全生存期間(overall survival; OS)、安全性及び忍容性 など
【判定基準】奏効評価は、国際ワーキンググループ(IWG)の効果判定基準に基づき評価した。
【解析計画】解析対象集団:有効性及び安全性の解析はASaT(all subjects as treated)集団*4を対象として実施した。
有効性評価の統計手法:主要評価項目のORRについては点推定値及びClopper-Pearsonによる正確な両側95%信頼区間(CI)を算出した。副次評価項目のORRの解析では点推定値及びClopper-Pearsonによる正確な両側90%信頼区間(CI)を算出した。DOR、PFS及びOSについてはKaplan-Meier法を用いて推定した。ORRのサブグループ解析として、自家造血幹細胞移植歴の有無*5別などの解析を実施した。有効性の主要評価項目であるORRは中間解析と最終解析を計画した。中間解析と最終解析における実際の閾値はα消費関数に基づく。ここではORRの最終解析の結果を示す。そのほか、治験薬投与後に同種造血幹細胞移植を受けた患者については、同種造血幹細胞移植に関連する合併症を収集することが規定されていた。
*1 自家造血幹細胞移植後に再発が認められた患者、自家造血幹細胞移植後60日以内にCR若しくはPRが得られなかった患者、又は自家造血幹細胞移植に不適格である場合、2種類以上の前治療を受け、無効若しくは直近の治療後に再発した患者が組み入れられた
組入れ基準の補足はこちら→
*2 中央画像判定機関(中央判定)による評価
*3 治験担当医師判定による評価
*4 治験薬を1回以上投与されたすべての患者
*5 自家造血幹細胞移植歴なしの理由:化学療法感受性なし、不適格/患者希望
患者背景(ASaT集団)
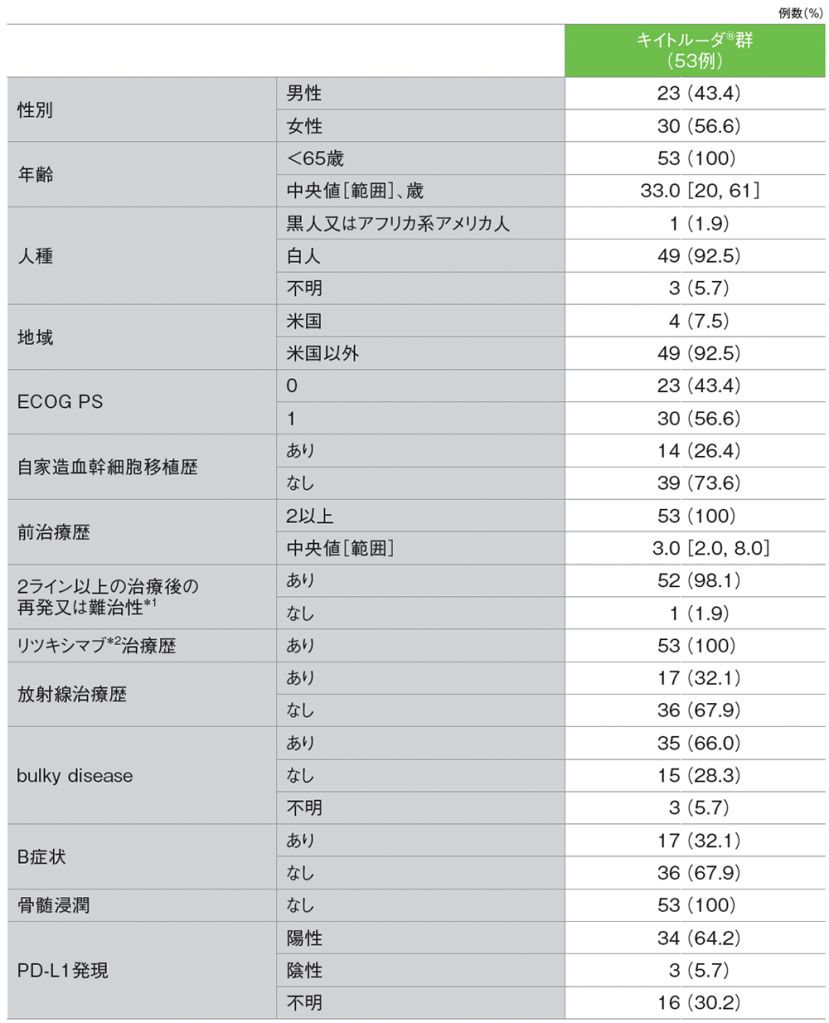
*1 16例(30.2%)はすべての前治療に対して難治性であった
*2 国内での効能又は効果(抜粋):CD20陽性のB細胞性非ホジキンリンパ腫
主要評価項目:奏効率(ORR)(ASaT集団)中央判定による評価


中央判定による評価
* 二項分布の確率計算による正確法
- ORRは45.3%で、CR例は53例中10例、PR例は14例でした。
■標的病変における腫瘍径のベースラインからの最大変化率(ASaT集団)
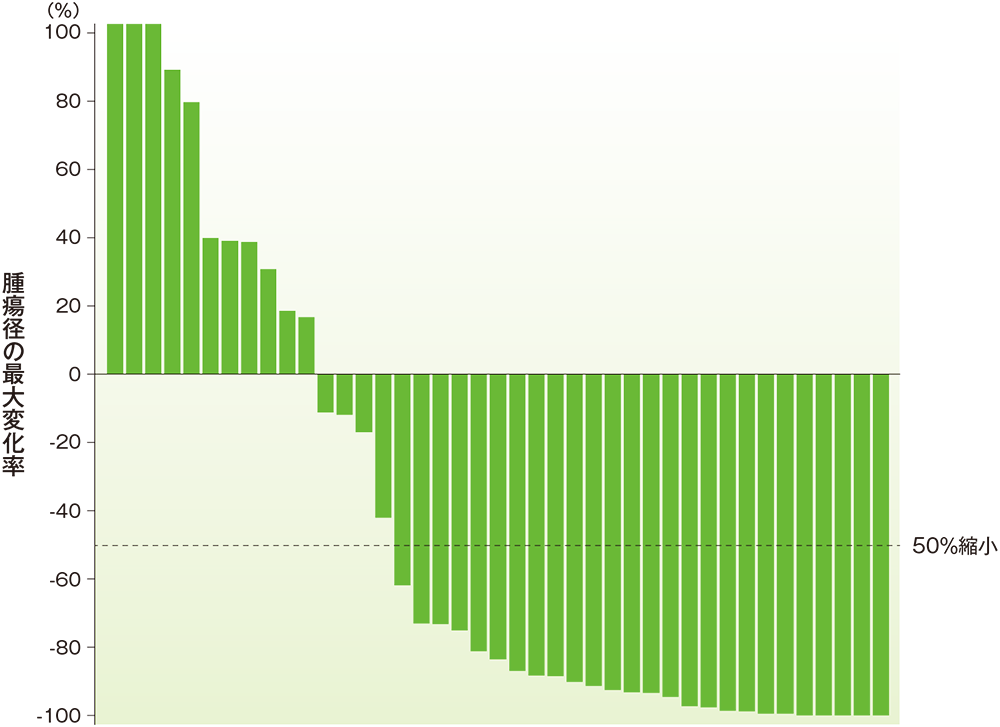
中央判定による評価
副次評価項目:奏効率(ORR)(ASaT集団)治験担当医師判定による評価

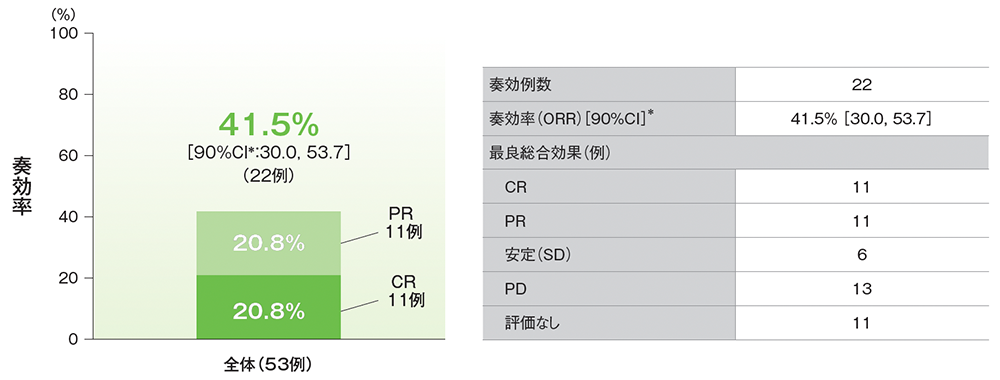
治験担当医師判定による評価
*二項分布の確率計算による正確法
- ORRは41.5%で、CR及びPRはいずれも11例、SD 6例、PD13例でした。
■キイトルーダ®投与後に幹細胞移植を実施した7例の(キイトルーダ®投与時の)最良総合効果
- キイトルーダ®投与後に幹細胞移植を実施した7例の(キイトルーダ®投与時の)最良総合効果は、自家移植へ移行した5例において、PR1例、SD1例、PD3例でした。PR1例は移植前にPDでした。同種移植へ移行した2例はいずれもPRでした。
サブグループ解析:自家造血幹細胞移植歴の有無別の奏効率(ORR)(ASaT集団)

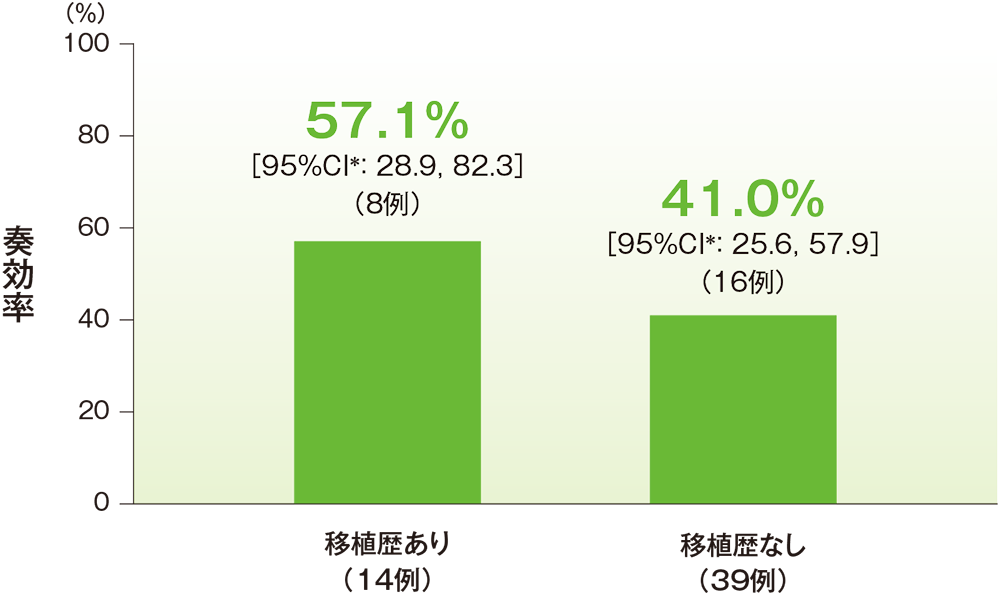
中央判定による評価
* 二項分布の確率計算による正確法
副次評価項目:奏効期間(DOR) (ASaT集団)
■DORのKaplan-Meier曲線

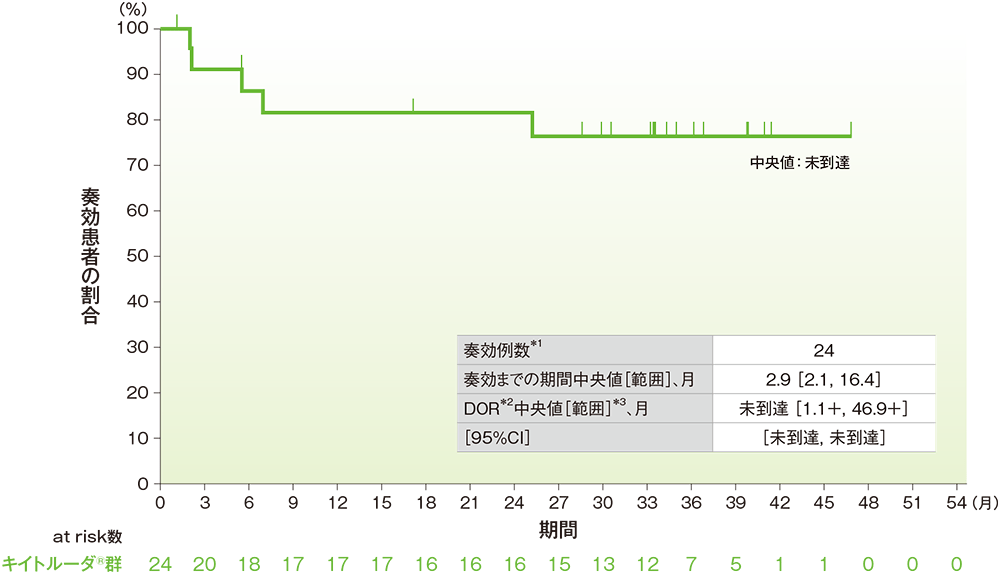
中央判定による評価
*1 CR又はPRを認めた症例数
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 「+」は最後の疾患評価までにPDがみられないことを示す
- DORの中央値は、未到達(95%CI:未到達, 未到達)でした。

- DORの中央値*は、未到達でした。48ヵ月時点で奏効が持続していた患者の割合は80.6%でした。
治験担当医師判定による評価
* 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
副次評価項目:無増悪生存期間(PFS) (ASaT集団)
■PFSのKaplan-Meier曲線

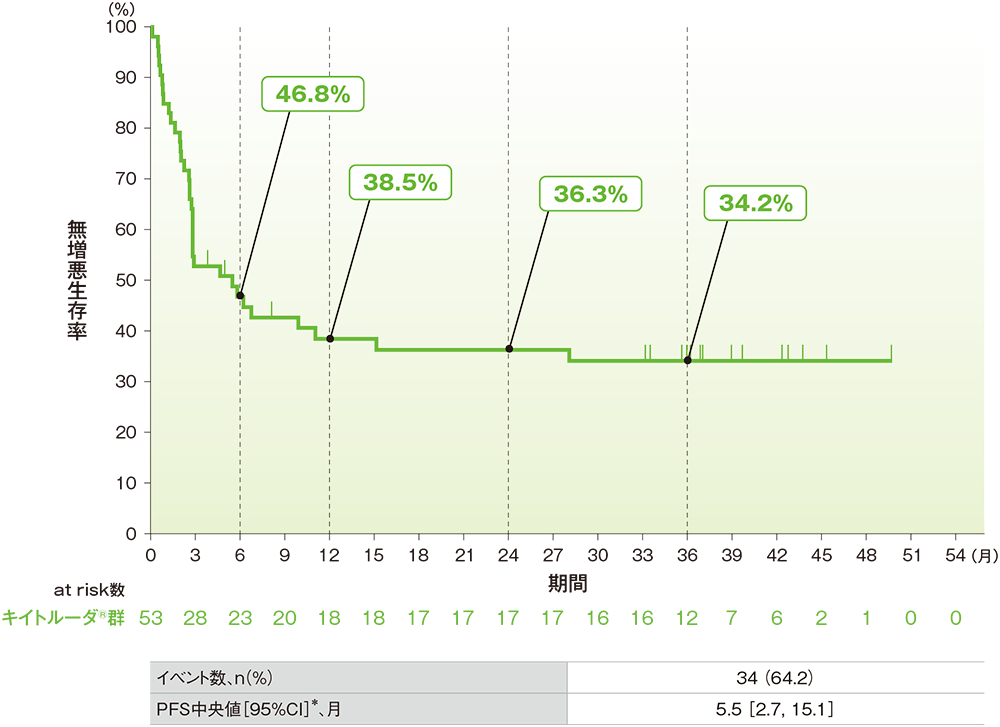
中央判定による評価
* 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
- PFSの中央値は5.5ヵ月であり、24ヵ月及び36ヵ月時点の無増悪生存率はそれぞれ36.3%及び34.2%でした。


治験担当医師判定による評価
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
- PFSの中央値は4.3ヵ月であり、48ヵ月時点の無増悪生存率は33.0%でした。
副次評価項目:全生存期間(OS)(ASaT集団)
■OSのKaplan-Meier曲線

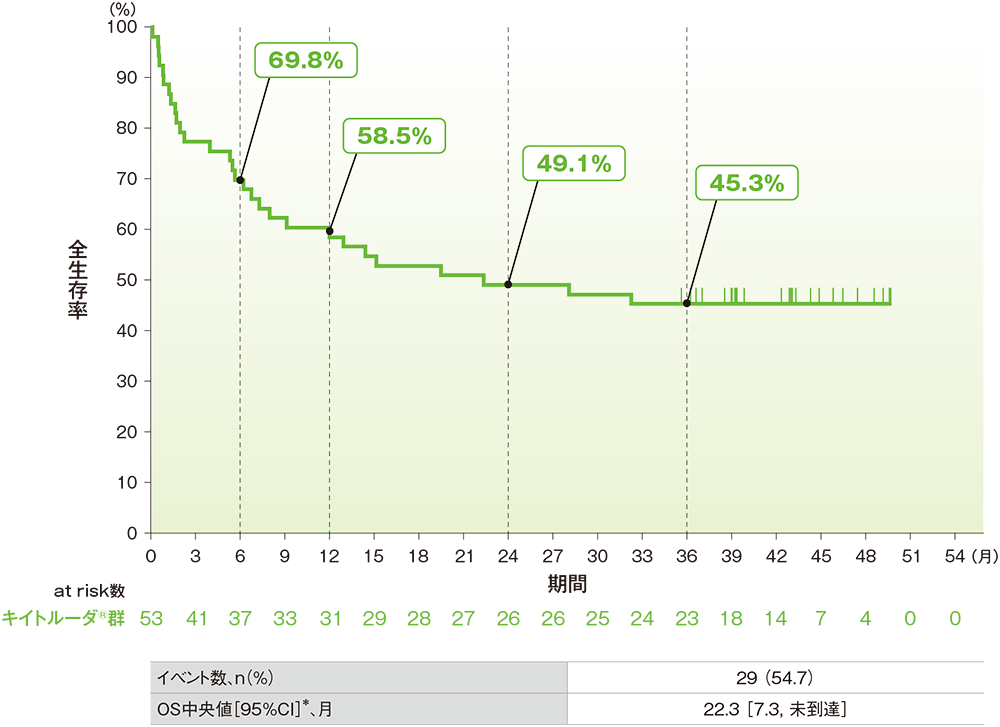
* 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
データカットオフ日:2020年5月7日、追跡期間中央値:22.3ヵ月(範囲:0.1, 50.4)
- OSの中央値は22.3ヵ月であり、24ヵ月及び36ヵ月時点の全生存率はそれぞれ49.1%及び45.3%でした。


*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
- OSの中央値は22.3ヵ月であり、48ヵ月時点の全生存率は45.3%でした。
安全性(ASaT集団)
■主な副作用(発現率5%以上)

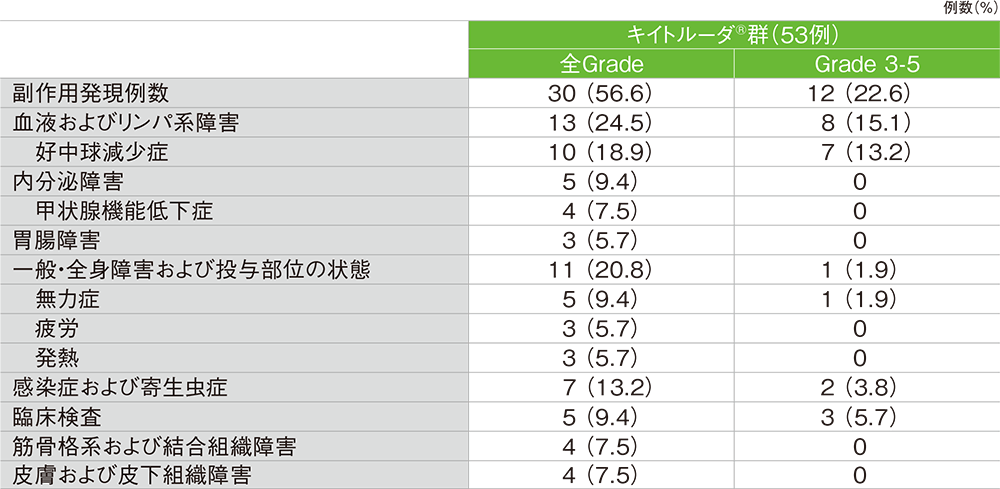
MedDRA/J v23.0、GradeはCTCAE v4.0
■主な副作用(発現2例以上)

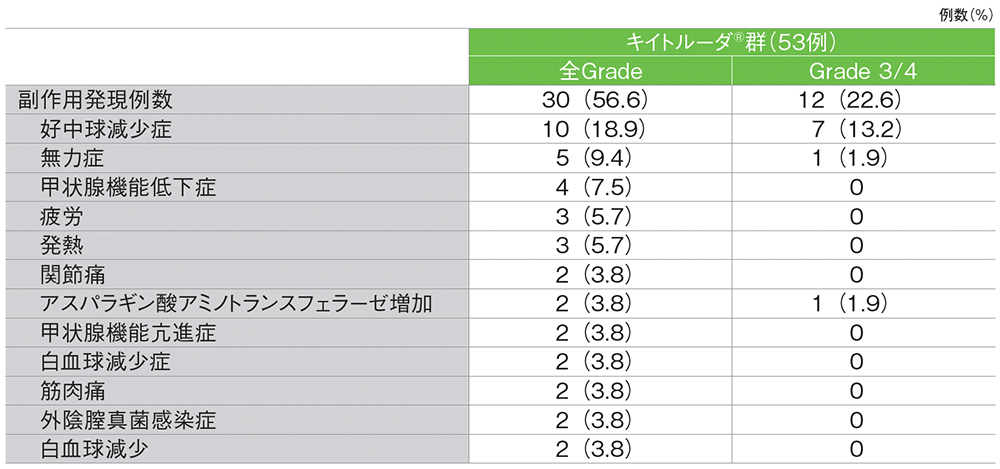
MedDRA/J v23.0
■副作用の概要


副作用:30/53例(56.6%) Grade 3以上の副作用:12例(22.6%)
重篤な副作用:4例(7.5%) 内訳:発熱性好中球減少症、クロストリジウム・ディフィシレ感染、肺炎、アスパラギン酸アミノトランスフェラーゼ増加、肝酵素上昇、静脈血栓症 各1例
副作用による中止:2例(3.8%) 内訳:アスパラギン酸アミノトランスフェラーゼ増加、扁平苔癬 各1例
副作用による死亡:認められなかった
■免疫関連など特に注目すべき有害事象(カテゴリー別で集計)


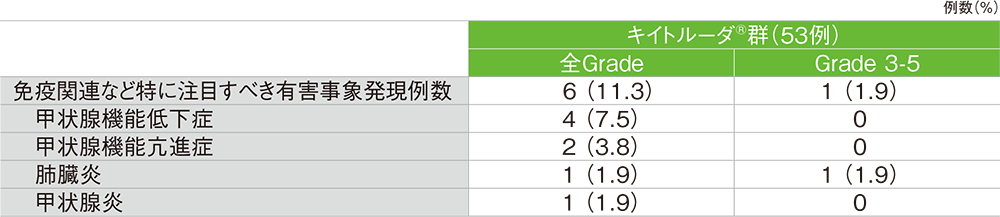
MedDRA/J v23.0、GradeはCTCAE v4.0
■注目すべき事象:キイトルーダ®治療後の同種造血幹細胞移植関連合併症

同種造血幹細胞移植実施:2/53例
移植関連合併症:1例[急性移植片対宿主病(GVHD)が発現し、回復後、慢性GVHDへと移行。その後、疾患進行により死亡]
KEYNOTE-170試験及びKEYNOTE-A33試験の組入れ基準補足
- 2つの臨床試験では、いずれも、自家造血幹細胞移植後に再発が認められた患者、自家造血幹細胞移植後60日以内にCR若しくはPRが得られなかった患者、又は自家造血幹細胞移植に不適格である場合、2種類以上の前治療※を受け、無効若しくは直近の治療後に再発した患者が組入れの対象となりました。
※全身性の治療後に地固め療法として局所放射線療法を受けた場合、局所放射線療法は別の療法とはみなさない。
■主な組入れ患者例
①自家造血幹細胞移植後に再発が認められた患者
②自家造血幹細胞移植後60日以内にCR又はPRが得られなかった患者
③自家造血幹細胞移植に不適格である場合、2種類以上の前治療を受け、無効又は直近の治療後に再発した患者
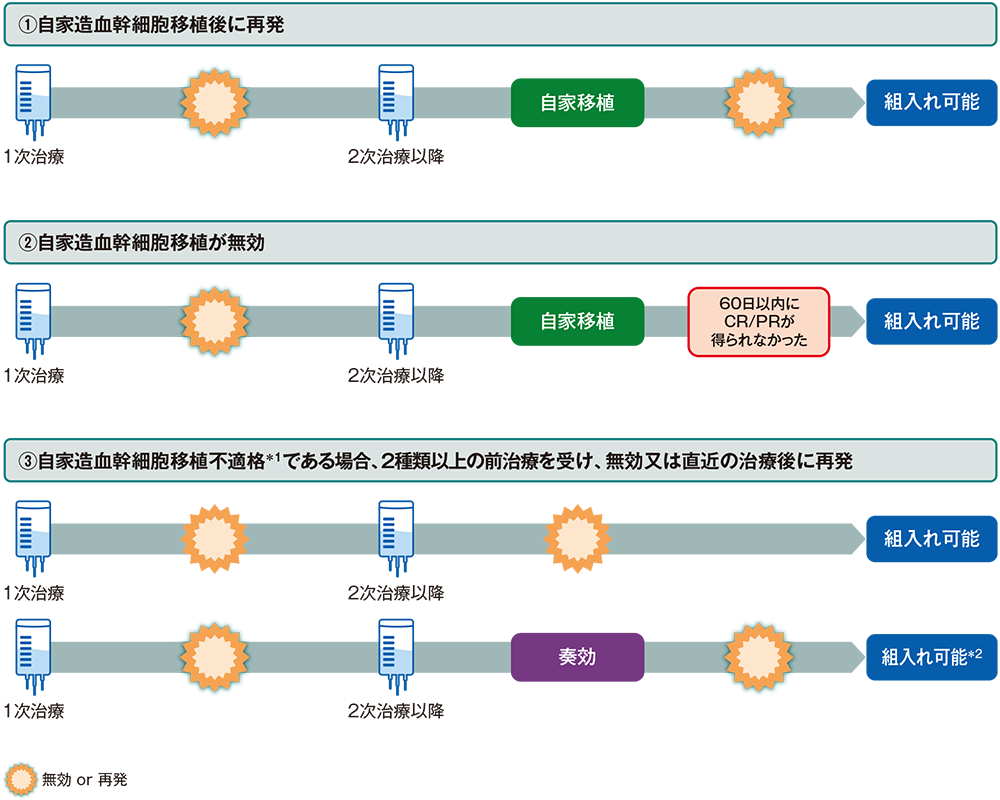
*1 化学療法に対する感受性、年齢、PS、合併症、臓器機能など
*2 年齢、PS、合併症、臓器機能などで自家移植不適格となる場合