〈術後補助療法(単剤)〉国際共同第Ⅲ相試験<KEYNOTE-564試験>
腎細胞癌:国際共同臨床試験成績:国際共同第Ⅲ相試験<KEYNOTE-564試験>1-6)
1)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-564試験)
2)Choueiri TK et al. N Engl J Med 2021; 385: 683-694
3)Choueiri TK et al. N Engl J Med 2021; 385: 683-694 Supplementary Data(Appendix)
KEYNOTE-564試験はMSD社の資金提供により行われた。Toni K. ChoueiriはMSD社から顧問料を受領している。その他の著者にMSD社から顧問料などを受領している者が含まれる。本試験はアカデミックアドバイザーとMSD社の社員によりデザインされた。著者のうち、Rodolfo F. Perini、Pingye Zhang、Kentaro Imai、Jaqueline Willemann-RogerioはMSD社の社員である。
4)Choueiri TK et al. N Engl J Med 2024; 390; 1359-1371
本試験はMSD社の資金提供により行われた。Toni K. ChoueiriはMSD社から顧問料を受領している。その他の著者にMSD社から顧問料などを受領している者が含まれる。著者のうち、Jerry Cornell、Aymen Elfiky、Joseph E. Burgents、Rodolfo F. PeriniはMSD社の社員である。
5)Choueiri TK et al. N Engl J Med 2024; 390; 1359-1371 Supplementary Appendix
6) Choueiri TK et al. N Engl J Med 2024; 390; 1359-1371 protocol
試験概要
【目的】
根治的腎摘除術又は腎部分切除術後の腎細胞癌患者に対するキイトルーダ®の有効性及び安全性を検討する。
【デザイン】
国際共同無作為化二重盲検第Ⅲ相試験[優越性試験]
[第1回中間解析 追跡期間中央値:24.1ヵ月(データカットオフ日:2020年12月14日)、第3回中間解析 追跡期間中央値:57.2ヵ月(データカットオフ日:2023年9月15日)]
【対象】
根治的腎摘除術又は腎部分切除術後の再発リスクが高い*淡明細胞型を有する腎細胞癌患者994例(日本人59例)
【方法】
キイトルーダ®群[キイトルーダ® 200mgを3週間間隔(Q3W)で点滴静注]又はプラセボ群(生理食塩液をQ3Wで点滴静注)に1:1の割合で無作為に割り付けた。再発、許容できない有害事象の発現、治療の継続を妨げる併発疾患、治験治療の不遵守、医師又は患者による中止決定等まで投与を継続した(キイトルーダ®投与は最大17サイクル〔約1年間〕)。無作為化割り付けから12週間毎に画像評価を実施した。17サイクルの治験薬の投与を完了した患者又は疾患再発以外の理由で治験薬投与を中止した患者すべてを対象に、無病生存期間(DFS)の評価のための画像評価によるフォローアップ(1年目は12週間毎、2~4年目は16週間毎、5年目以降は24週間毎)を実施した。
* 以下の(ⅰ)又は(ⅱ)の患者が組み入れられた。
(ⅰ)術後の病理組織学的診断により下記のいずれかに該当する患者(GradeはFuhrman分類)
• pT2、Grade 4又は肉腫様変化を伴う、N0かつM0 • pT3/4、Grade問わず、N0かつM0 • pT問わず、Grade問わず、N1かつM0
(ⅱ)M1 no evidence of disease(M1 NED)であり、原発巣及び遠隔転移巣ともに、腎摘除術時点又は腎摘除術後1年以内のいずれかの時点で完全切除可能であった患者
【評価項目】
主要評価項目:無病生存期間(disease free survival;DFS)※
重要な副次評価項目:全生存期間(overall survival;OS)※
その他の副次評価項目:無作為割り付けから最初の腎細胞癌の局所再発までの期間(disease recurrence specific survival 1;DRSS1)、無作為割り付けから最初の内臓病変を伴う局所再発又は内臓病変を伴う腎癌の遠隔転移の発生のいずれか早い時点までの期間(disease recurrence specific survival 2;DRSS2)、無イベント生存期間(event free survival;EFS)、PD-L1発現別のDFS及びOS、健康関連QOLに関する患者報告アウトカム(patient reported outcome;PRO)、安全性 など
※ 検証的解析項目
【判定基準】
DFS、DRSS1及びDRSS2は治験担当医師が評価した。EFSは盲検下独立判定委員会(blinded independent central review;BICR)が評価した。健康関連QOLに関するPROはEORTC QLQ-C30及びFKSI-DRSを用いて評価した。
【解析計画】
解析対象集団:有効性はITT集団*1、安全性はAPaT集団*2を解析対象とした。
有効性の統計方法:DFS、OS、EFSの生存曲線はKaplan-Meier法を用いて推定した。DFS、OSの主要及び副次仮説は層別ログランク検定により評価し、投与群を共変量とした層別Cox比例ハザードモデルを用いてハザード比及びその95%信頼区間(CI)を推定した。層別ログランク検定及び層別Cox比例ハザードモデルの層別因子には無作為割り付けに用いた層別因子[転移の有無(M0、M1 NED)、M0の患者はさらにECOG PS(0、1)及び米国の患者であるかどうか(Yes、No)で層別]を用いた。投与群を共変量としたCox比例ハザードモデルを用いて年齢(<65歳、≧65歳)、性別(女性、男性)、人種(白人、白人以外)、ECOG PS(0、1)、PD-L1発現(CPS<1、CPS≧1)、地域(米国、米国以外)、転移状況(M0、M1 NED)、腎摘除術歴(腎部分切除術、根治的腎摘除術)別等のサブグループ解析を実施した。日本人集団はITT集団と同様の統計手法にて解析したが、層での調整は行わなかった。
健康関連QOLに関するPRO評価の統計手法:健康関連QOLに関するPROは、無作為化された患者のうち、治験薬を少なくとも1回投与し、患者報告による評価を1回以上行った患者を対象とした。EORTC QLQ-C30の全般的な健康状態/QoLスコア及びEORTC QLQ-C30の身体機能スコアのベースラインからの変化量及びFKSI-DRSスコアのベースラインからの変化量(52週時の最小二乗平均)を解析した。また、補助的な解析として、EORTC QLQ-C30の全般的な健康状態/QoLスコア、EORTC QLQ-C30の身体機能スコア及びFKSI-DRSスコアのベースラインからの平均変化量を経時的に示した。
多重性の調整:本試験では有効性の4回の中間解析及び1回の追加解析と最終解析を計画し、DFSは2回目の中間解析を最終解析とした。Maurer and Bretzの多重性の調整方法を用いて、DFS及びOSに関する全体の有意水準を片側2.5%となるように厳密に制御した。本試験では2つの仮説(仮説1:DFS、仮説2:OS)を設定し、仮説1が有意水準片側2.5%で棄却されれば、OSの帰無仮説について有意水準片側2.5%で評価する仮説構造とした。DFS及びOSの中間解析及び最終解析の有効性の境界値の設定には、Lan-DeMetsによるO’Brien-Fleming型のα消費関数を用いた。
*1 ITT(intention-to-treat)集団:無作為化されたすべての患者
*2 APaT(all participants as treated)集団:無作為化され治験薬を1回以上投与されたすべての患者
4. 効能又は効果(抜粋) 腎細胞癌における術後補助療法
5. 効能又は効果に関連する注意(抜粋)
〈腎細胞癌における術後補助療法〉
5.13 臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.18参照]
KEYNOTE-564試験 再発リスクカテゴリーと患者割合
*1 No evidence of disease:無病状態
*2 キイトルーダ®群では、上記に示した再発リスクカテゴリー以外の患者が1.0%(5例)含まれる
本試験に登録された患者の再発リスクカテゴリー別患者割合
* T2(Grade 3以下) N0 M0又はT1 N0 M0の患者(プロトコール違反)
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-564試験)
患者背景(ITT集団)
*1 CPS(combined positive score):PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた数値
*2 pT2、Grade 4又は肉腫様変化を伴う、N0かつM0、若しくはpT3、Grade問わず、N0かつM0
*3 pT4、Grade問わず、N0かつM0又はpT問わず、Grade問わず、N1かつM0
*4 T2、Grade 3以下、N0、M0又はT1、N0、M0(プロトコール違反)
*5 原発巣及び遠隔転移巣ともに、腎摘除術時点又は腎摘除術後1年以内のいずれかの時点で完全切除可能であった患者

曝露状況
キイトルーダ®群では、488例がキイトルーダ®を投与され、298例(61.1%)が投与を完了し、190例(38.9%)が投与を中止しました。プラセボ群では、496例がプラセボを投与され、365例(73.6%)が投与を完了し、130例(26.2%)が投与を中止し、1例(0.2%)が投与継続中でした。
投与期間の中央値は、キイトルーダ®群(11.1ヵ月、範囲:0.0, 14.3ヵ月)とプラセボ群(11.1ヵ月、範囲:0.0, 15.4ヵ月)でした。
投与状況の要約
投与期間の分布
患者は期間ごとに1回カウントされる。また、投与期間は(最終投与日-初回投与日+1)/30.4367として計算される。
* 腎細胞癌における術後補助療法の場合、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。投与期間は12ヵ月間までとする。
後治療
後治療として抗がん治療を受けた患者は全患者の18.9%で、キイトルーダ®群15.3%、プラセボ群22.5%でした。後治療には、薬物療法、放射線治療及び手術があり、このうち、薬物療法の割合はキイトルーダ®群12.7%、プラセボ群17.3%でした。
後治療として抗PD-1/PD-L1抗体治療(キイトルーダ®*1、アベルマブ、ニボルマブ、アテゾリズマブ*2及びデュルバルマブ*2のいずれか)を受けた患者の割合は、キイトルーダ®群2.8%、プラセボ群9.2%でした。
*1 根治切除不能又は転移性の腎細胞癌に対してキイトルーダ®単剤投与は国内適応外
*2 国内適応外
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-564試験)
6. 用法及び用量(抜粋)
〈根治切除不能又は転移性の腎細胞癌〉
他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
アテゾリズマブの効能又は効果は以下のとおりです。
効能又は効果
〈テセントリク点滴静注1200mg〉
○切除不能な進行・再発の非小細胞肺癌 ○PD-L1陽性の非小細胞肺癌における術後補助療法 ○進展型小細胞肺癌 ○切除不能な肝細胞癌
〈テセントリク点滴静注840mg〉
○PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌
デュルバルマブの効能又は効果は以下のとおりです。
効能又は効果
〇切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法 ○切除不能な進行・再発の非小細胞肺癌 ○進展型小細胞肺癌 ○切除不能な肝細胞癌 ○治癒切除不能な胆道癌

再発が認められた患者において、後治療を受けた患者割合はキイトルーダ®群で161例中128例(79.5%)、プラセボ群で210例中171例(81.4%)でした。下表は、再発の記録がなく後治療を受けた患者がキイトルーダ®群に4例、プラセボ群に1例追加されているデータで、後治療には、薬物療法、放射線治療及び手術があり、このうち、薬物療法を受けた患者の割合はキイトルーダ®群79.5%、プラセボ群84.3%でした。後治療として抗PD-1/PD-L1抗体薬治療(キイトルーダ®、アベルマブ、ニボルマブ、アテゾリズマブ*及びデュルバルマブ*のいずれか)を受けた患者の割合は、キイトルーダ®群41.0%、プラセボ群69.7%でした。
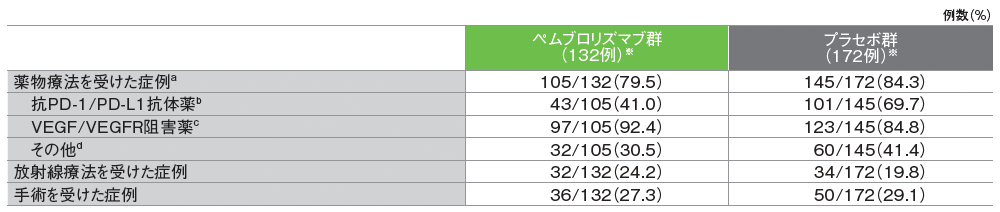
a.各症例は各該当カテゴリにおいて1回カウントされる。複数の後治療を受けている症例が含まれる可能性があるため、各カテゴリの合計は被験者の総数を超える場合がある
b.アテゾリズマブ*、アベルマブ、デュルバルマブ*、ニボルマブ、ペムブロリズマブ
c.アキシチニブ、ベバシズマブ*、カボザンチニブ、レンバチニブ、パゾパニブ、ソラフェニブ、スニチニブ、tivozanib**
d.belzutifan**、エベロリムス、イピリムマブを含むがそれらに限らず
Copyright ©2024 Massachusetts Medical Society. All rights reserved. Translated with permission.
※再発の記録がなく後治療を受けた患者がキイトルーダ®群に4例、プラセボ群に1例追加されているデータ
*本邦適応外、**本邦未承認
各薬剤の電子添文を参照してください。根治切除不能又は転移性の腎細胞癌に対して、ペムブロリズマブ又はレンバチニブの単剤投与は国内適応外です。
Choueiri TK et al. N Engl J Med 2024; 390: 1359-1371
アテゾリズマブの効能又は効果
〈テセントリク点滴静注1200mg〉
○切除不能な進行・再発の非小細胞肺癌 ○PD-L1陽性の非小細胞肺癌における術後補助療法 ○進展型小細胞肺癌 ○切除不能な肝細胞癌
〈テセントリク点滴静注840mg〉
○PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌
デュルバルマブの効能又は効果
〇切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法 ○切除不能な進行・再発の非小細胞肺癌 〇進展型小細胞肺癌 ○切除不能な肝細胞癌 ○治癒切除不能な胆道癌
ベバシズマブの効能又は効果
○治癒切除不能な進行・再発の結腸・直腸癌 ○扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌 ○手術不能又は再発乳癌 ○悪性神経膠腫 ○卵巣癌 ○進行又は再発の子宮頸癌 ○切除不能な肝細胞癌
キイトルーダ®の用法及び用量
6. 用法及び用量(抜粋)
〈根治切除不能又は転移性の腎細胞癌〉
他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
レンビマ®の用法及び用量(抜粋)
根治切除不能又は転移性の腎細胞癌
ペムブロリズマブ(遺伝子組換え)との併用において、通常、成人にはレンバチニブとして1日1回20mgを経口投与する。なお、患者の状態により適宜減量する。
主要評価項目:無病生存期間(DFS)


ITT集団におけるDFS中央値はキイトルーダ®群、プラセボ群で未到達でした。キイトルーダ®群はプラセボ群に対して、DFSを有意に改善しました(ハザード比:0.68、95%CI:0.53, 0.87、p=0.0010、層別ログランク検定[片側]、有意水準 α=0.0114;検証的解析結果)。
無病生存期間(DFS)とは
無作為割り付けから最初に記録された、局所再発、腎癌の遠隔転移の発生、又はあらゆる原因による死亡のいずれか早い時点までの期間をDFSと定義した。
■無病生存期間(DFS)のKaplan-Meier曲線(ITT集団)
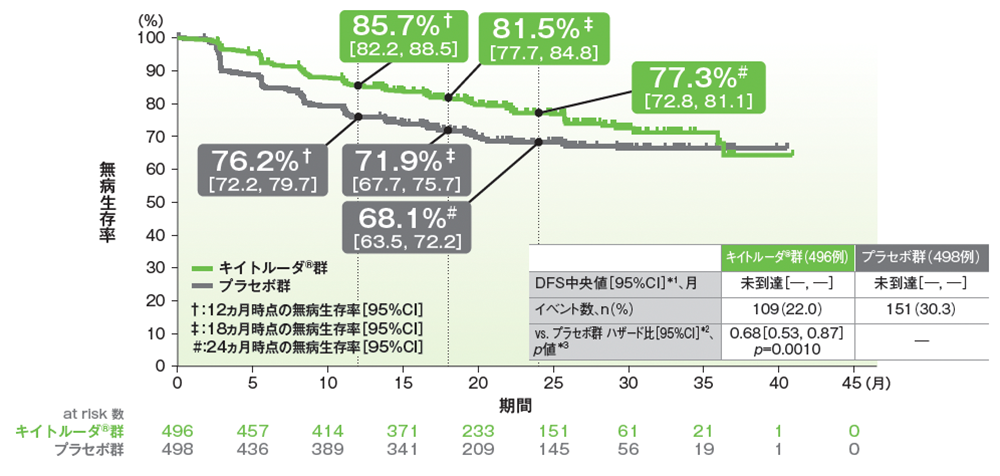
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為割り付けに用いた層別因子[転移の有無(M0、M1 NED)、M0の患者はさらにECOG PS(0、1)及び米国の患者であるかどうか(Yes、No)]で層別した層別Cox比例ハザードモデルに基づく
*3 無作為割り付けに用いた層別因子[転移の有無(M0、M1 NED)、M0の患者はさらにECOG PS(0、1)及び米国の患者であるかどうか(Yes、No)]で層別した層別ログランク検定[片側]、有意水準 α=0.0114(検証的解析結果)
追跡期間中央値:キイトルーダ®群 24.0ヵ月(範囲:2.5, 41.5)、プラセボ群 23.8ヵ月(範囲:3.5, 41.4)、データカットオフ日:2020年12月14日
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-564試験)
サブグループ解析:無病生存期間(DFS)の部分集団解析

■無病生存期間(DFS)のハザード比のフォレストプロット(ITT集団)
* 全例:投与群を共変量とし、無作為化に用いた層別因子[転移の有無(M0、M1 NED)、M0の患者はさらにECOG PS(0、1)、米国の患者であるかどうか(Yes、No)]で層別した層別Cox比例ハザードモデルに基づく、サブグループ:投与群を共変量としたCox比例ハザードモデルに基づく
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-564試験)


キイトルーダ®群のプラセボ群に対するハザード比は0.72(95%CI: 0.59, 0.87)でした。
■無病生存期間(DFS)のKaplan-Meier曲線(ITT集団)
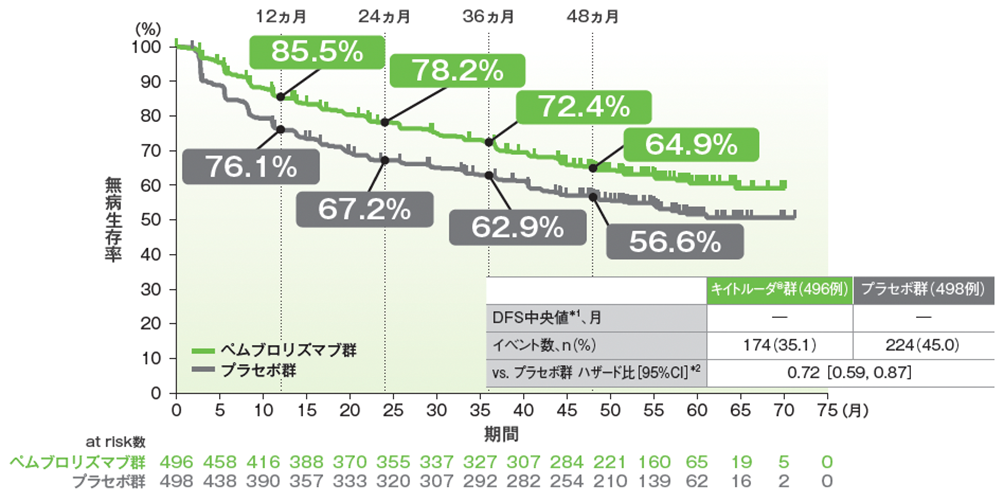
Adapted with permission from the New English Journal of Medicine, Choueiri TK et al, Overall Survival with Adjuvant Pembrolizumab in Renal-Cell Carcinoma, Volume 390, No.15, 1359-1371 Copyright ©2024 Massachusetts Medical Society. Translated with permission.
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為割り付けに用いた層別因子[転移の有無(M0、M1 NED)、M0の患者はさらにECOG PS(0、1)及び米国の患者であるかどうか(Yes、No)]で層別した層別Cox比例ハザードモデルに基づく
Choueiri TK et al. N Engl J Med 2024; 390: 1359-1371
重要な副次評価項目:全生存期間(OS)

ITT集団におけるOS中央値はキイトルーダ®群、プラセボ群で未到達でした。キイトルーダ®群のプラセボ群に対する優越性は検証されませんでした(ハザード比:0.54、95%CI:0.30, 0.96、p=0.0164037、層別ログランク検定[片側]、有意水準 α=9.3×10−6;検証的解析結果)。
■全生存期間(OS)のKaplan-Meier曲線(ITT集団)
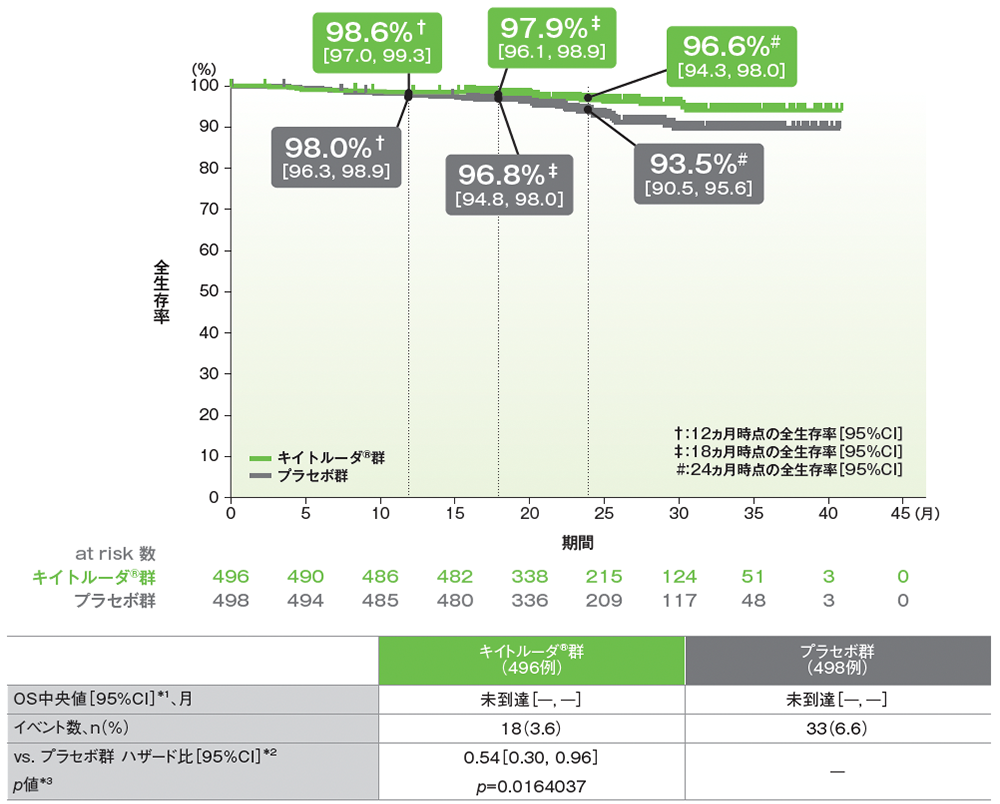
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為割り付けに用いた層別因子[転移の有無(M0、M1 NED)、M0の患者はさらにECOG PS(0、1)及び米国の患者であるかどうか(Yes、No)]で層別した層別Cox比例ハザードモデルに基づく
*3 無作為割り付けに用いた層別因子[転移の有無(M0、M1 NED)、M0の患者はさらにECOG PS(0、1)及び米国の患者であるかどうか(Yes、No)]で層別した層別ログランク検定[片側]、有意水準 α=9.3×10−6(検証的解析結果)
追跡期間中央値:キイトルーダ®群 24.0ヵ月(範囲:2.5, 41.5)、プラセボ群 23.8ヵ月(範囲:3.5, 41.4)、データカットオフ日:2020年12月14日
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-564試験)

キイトルーダ®群のプラセボ群に対するハザード比は0.62であり、プラセボ群に対する優越性が検証されました(95%CI: 0.44, 0.87、 p=0.005、層別ログランク検定[両側]、有意水準 α=0.0144; 検証的解析結果)。
■全生存期間(OS)のKaplan-Meier曲線(ITT集団)
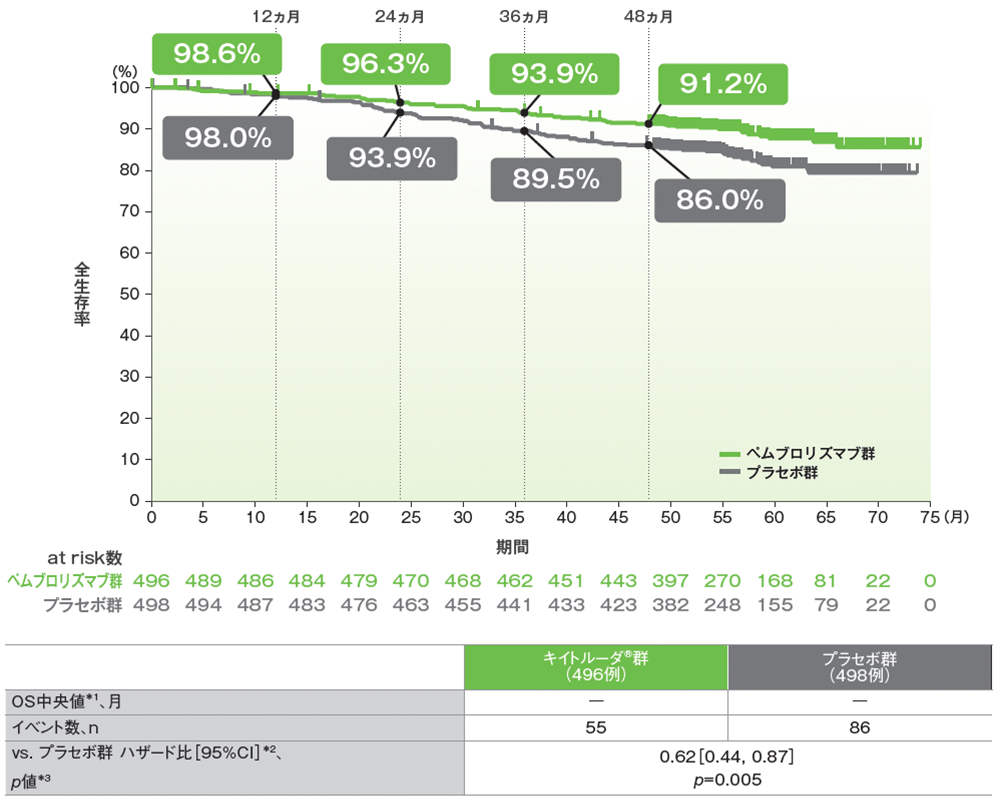
Adapted with permission from the New English Journal of Medicine, Choueiri TK et al, Overall Survival with Adjuvant Pembrolizumab in Renal-Cell Carcinoma, Volume 390, No.15, 1359-1371 Copyright ©2024 Massachusetts Medical Society. Translated with permission.
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為割り付けに用いた層別因子[転移の有無(M0、M1 NED)、M0の患者はさらにECOG PS(0、1)及び米国の患者であるかどうか(Yes、No)]で層別した層別Cox比例ハザードモデルに基づく
*3 無作為割り付けに用いた層別因子[転移の有無(M0、M1 NED)、M0の患者はさらにECOG PS(0、1)及び米国の患者であるかどうか(Yes、No)]で層別した層別ログランク検定[両側]※、有意水準 α=0.0144(検証的解析結果)
※解析計画では片側であるが、掲載誌の方針に従い両側を記載している。
Choueiri TK et al. N Engl J Med 2024; 390: 1359-1371
その他の副次評価項目:無病生存期間(DRSS)


ITT集団における12ヵ月時点のDFSS1率はキイトルーダ®群で1.9%、プラセボ群で5.5%でした。
また、12ヵ月時点のDRSS2率はキイトルーダ®群で12.8%、プラセボ群で21.2%でした。
無病生存期間(DRSS)とは
無作為割り付けから最初の腎細胞癌の局所再発までの期間をDRSS1と定義した。また、無作為割り付けから最初の内臓病変を伴う局所再発又は内臓病変を伴う腎癌の遠隔転移の発生のいずれか早い時点までの期間をDRSS2と定義した。
■DRSS1(ITT集団)
* 腎細胞癌の局所再発をイベントとして集計した
■DRSS2(ITT集団)
* 内臓病変を伴う局所再発又は内臓病変を伴う腎癌の遠隔転移をイベントとして集計した
追跡期間中央値:キイトルーダ®群 24.0ヵ月(範囲:2.5, 41.5)、プラセボ群 23.8ヵ月(範囲:3.5, 41.4)、データカットオフ日:2020年12月14日
その他の副次評価項目:無イベント生存期間(EFS)


ITT集団におけるEFS中央値はキイトルーダ®群、プラセボ群で未到達でした。
無イベント生存期間(EFS)とは
無作為割り付けから、以下のいずれか早い時点までの期間と定義した。
– BICRがベースライン時に無病状態(M0/M1 NED)と評価した患者の場合:最初の局所再発又は腎癌の遠隔転移の発生、又はあらゆる原因による死亡
– BICRがベースライン時に病変を有する(M1)と評価した患者の場合:疾患進行、又はあらゆる原因による死亡
■無イベント生存期間(EFS)のKaplan-Meier曲線(ITT集団)
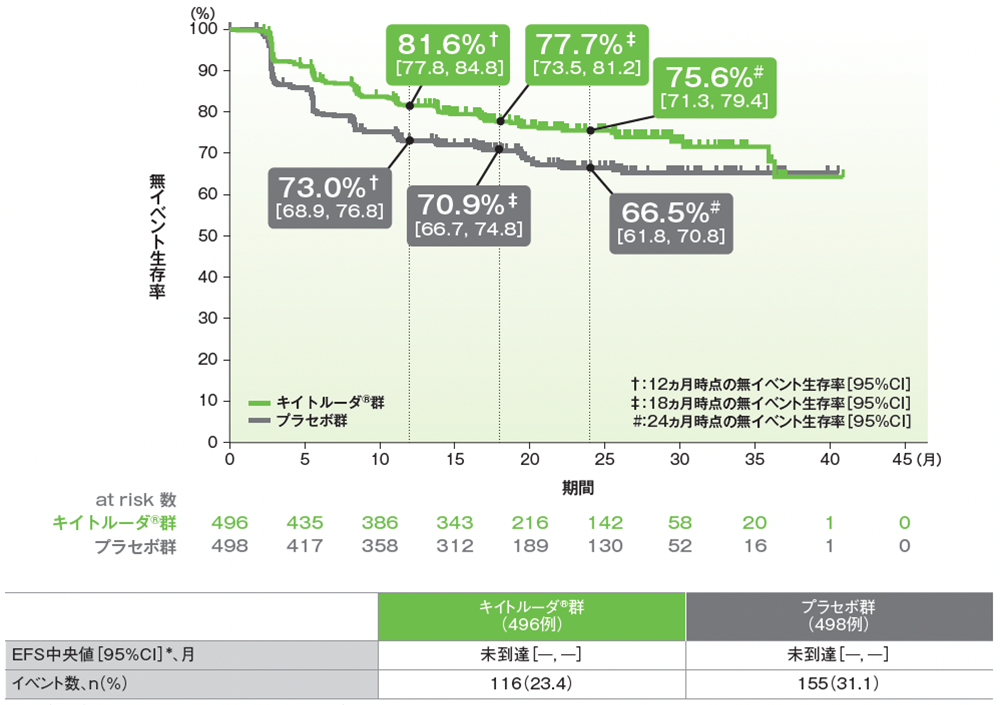
* 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
追跡期間中央値:キイトルーダ®群 24.0ヵ月(範囲:2.5, 41.5)、プラセボ群 23.8ヵ月(範囲:3.5, 41.4)、データカットオフ日:2020年12月14日
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-564試験)
安全性

主な副作用
キイトルーダ®群における副作用は386/488例(79.1%)に認められました。主な副作用(発現率10%以上)は、疲労99例(20.3%)、そう痒症91例(18.6%)、甲状腺機能低下症86例(17.6%)、下痢77例(15.8%)、発疹73例(15.0%)、甲状腺機能亢進症50例(10.2%)でした。重篤な副作用は59例(12.1%)に認められ、発現率1%以上の重篤な副作用は副腎機能不全6例(1.2%)、大腸炎、糖尿病性ケトアシドーシス各5例(1.0%)でした。副作用による投与中止は86例(17.6%)に認められ、発現率1%以上の投与中止に至った副作用はアラニンアミノトランスフェラーゼ増加8例(1.6%)、副腎機能不全、大腸炎各5例(1.0%)でした。本試験において副作用による死亡は認められませんでした。
プラセボ群における副作用は265/496例(53.4%)に認められました。主な副作用(発現率10%以上)は、疲労71例(14.3%)、そう痒症57例(11.5%)、下痢51例(10.3%)でした。重篤な副作用は1例(0.2%)に認められ、内訳は大腸炎1例(0.2%)でした。副作用による投与中止は3例(0.6%)に認められ、内訳は血中クレアチニン増加、関節痛、肝毒性各1例(0.2%)でした。本試験において副作用による死亡は認められませんでした。
■主な副作用(いずれかの投与群で発現率5%以上)(APaT集団)
MedDRA/J v23.1 GradeはCTCAE v 4.0
追跡期間中央値:キイトルーダ®群 24.0ヵ月(範囲:2.5, 41.5)、プラセボ群 23.8ヵ月(範囲:3.5, 41.4)、データカットオフ日:2020年12月14日
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-564試験)

主な副作用
キイトルーダ®群における副作用は386/488例(79.1%)に認められました。
主な副作用(発現率10%以上)は、疲労99例(20.3%)、そう痒症91例(18.6%)、甲状腺機能低下症85例(17.4%)、下痢77例(15.8%)、発疹73例(15.0%)、甲状腺機能亢進症52例(10.7%)でした。無作為化から最終投与90日後までに発現した重篤な副作用は59例(12.1%)に認められ、内訳は論文中に記載されていませんでした。無作為化から治験薬の最終投与後90日の報告期間を超えた期間において、合計10件の重篤な副作用が認められました。その内訳は、大腸炎が2例、副腎機能不全、脱髄性多発ニューロパチー、肝炎、下垂体炎、甲状腺機能低下症、腎炎、膵不全、肺炎が各1例でした。副作用による投与中止は89例(18.2%)に認められ、内訳は論文中に記載されていませんでした。本試験において副作用による死亡は認められませんでした。
プラセボ群における副作用は263/496例(53.0%)に認められました。主な副作用(発現率10%以上)は、疲労71例(14.3%)、そう痒症56例(11.3%)、下痢51例(10.3%)でした。無作為化から最終投与90日後までに発現した重篤な副作用は1例(0.2%)に認められ、内訳は論文中に記載されていませんでした。副作用による投与中止は4例(0.8%)に認められ、内訳は論文中に記載されていませんでした。本試験において副作用による死亡は認められませんでした。
■主な副作用(いずれかの治療群で発現率が5%以上)(APaT集団)
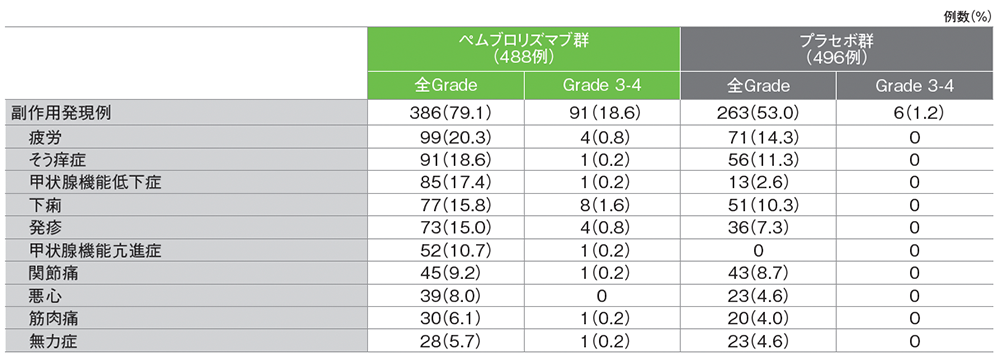
Grade はCTCAE v4.0
Copyright ©2024 Massachusetts Medical Society. All rights reserved. Translated with permission.
Choueiri TK et al. N Engl J Med 2024; 390: 1359-1371 Supplementary Appendix

免疫関連など特に注目すべき有害事象は、キイトルーダ®群で173/488例(35.5%)、プラセボ群で34/496例(6.9%)に認められました。キイトルーダ®群で最も多くみられた免疫関連など特に注目すべき有害事象は甲状腺機能低下症であり、103例(21.1%)に認められました。
免疫関連の有害事象の治療として、キイトルーダ®群の7.4%、プラセボ群の0.6%に高用量の副腎皮質ホルモン剤(40mg以上/日)が投与されました*。
* Choueiri TK et al. N Engl J Med 2021; 385: 683-694
副腎皮質ホルモン剤投与の記載は引用文献に準じる
■免疫関連など特に注目すべき有害事象(APaT集団)
MedDRA/J v23.1 GradeはCTCAE v 4.0
追跡期間中央値:キイトルーダ®群 24.0ヵ月(範囲:2.5, 41.5)、プラセボ群 23.8ヵ月(範囲:3.5, 41.4)、データカットオフ日:2020年12月14日
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-564試験)

免疫関連など特に注目すべき有害事象は、キイトルーダ®群で178/488例(36.5%)、プラセボ群で36/496例(7.3%)に認められました。キイトルーダ®群で最も多くみられた免疫関連など特に注目すべき有害事象は甲状腺機能低下症であり、103例(21.1%)に認められました。
■免疫関連など特に注目すべき有害事象(APaT集団)
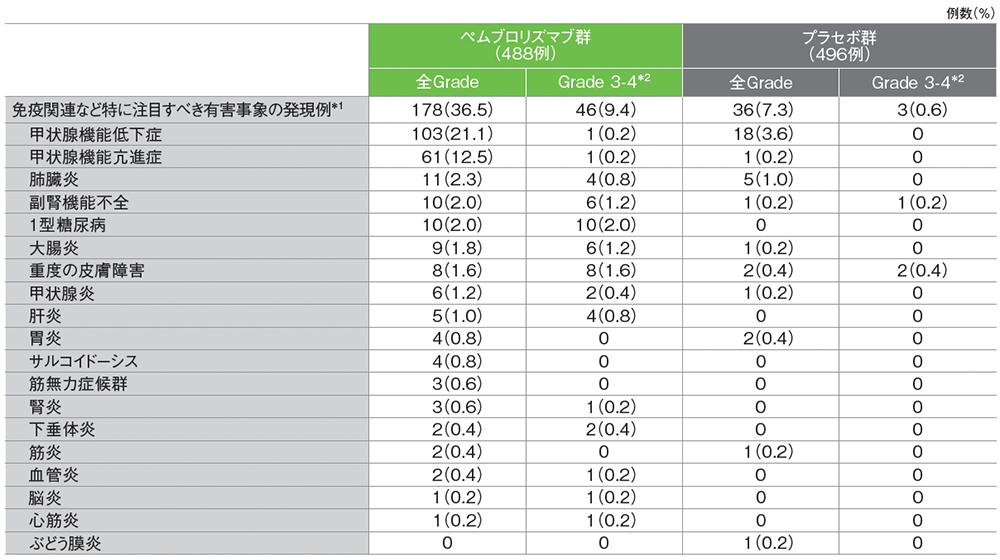
*1 全Grade及びGrade 3のinfusion reactionは、ペムブロリズマブ群でそれぞれ7例(1.4%)と2例(0.4%)に認められた。プラセボ群では全Gradeが5例(1.0%)に認められ、Grade 3の発現は認められなかった。
*2 本試験においてGrade 5の免疫関連有害事象は認められなかった。
Copyright ©2024 Massachusetts Medical Society. All rights reserved. Translated with permission.
GradeはCTCAE v4.0
Choueiri TK et al. N Engl J Med 2024; 390: 1359-1371 Supplementary Appendix

重篤な有害事象は、キイトルーダ®群で101/488例(20.7%)、プラセボ群で57/496例(11.5%)に認められました。キイトルーダ®群で最も多くみられた重篤な有害事象は副腎機能不全、大腸炎、肺炎、急性腎障害であり、各6例(1.2%)に認められました。
■重篤な有害事象(いずれかの治療群で2例以上に発現)(APaT集団)
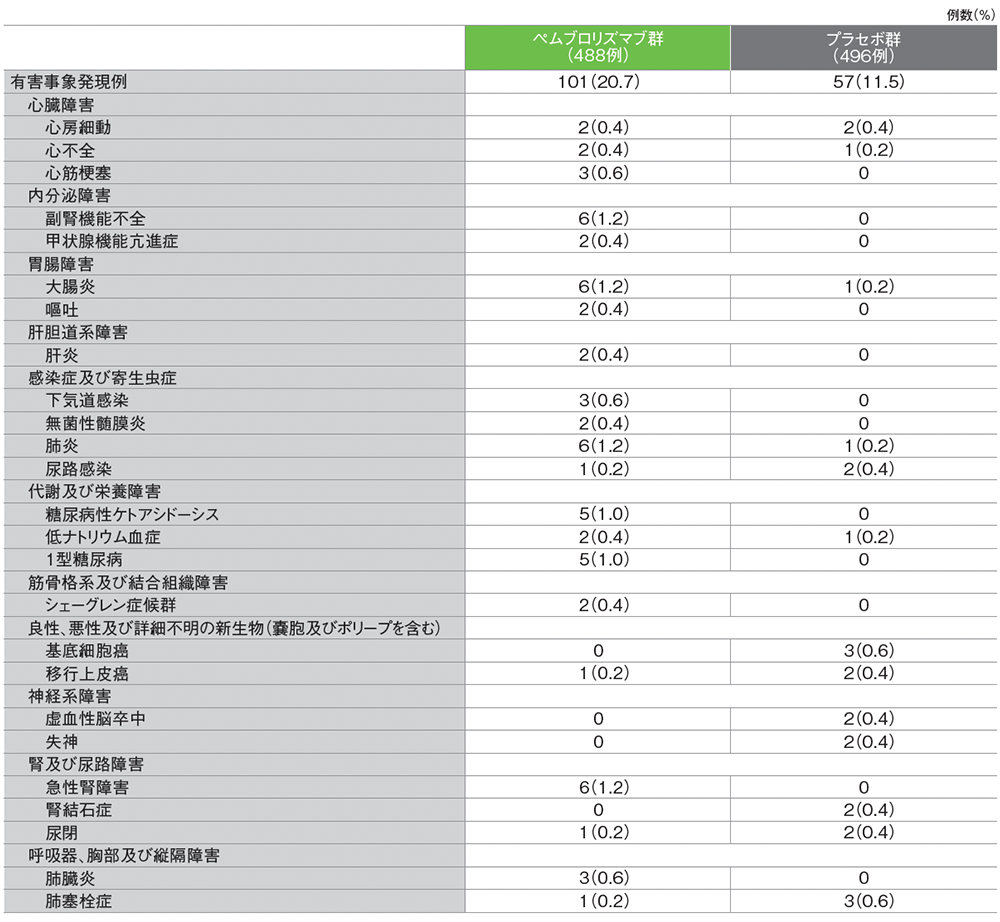
Copyright ©2024 Massachusetts Medical Society. All rights reserved. Translated with permission.
Choueiri TK et al. N Engl J Med 2024; 390: 1359-1371 Supplementary Appendix