〈レンビマ®併用〉国際共同第Ⅲ相試験〈CLEAR試験〉(KEYNOTE-581/307試験)(全集団)
国際共同第Ⅲ相試験〈CLEAR試験(KEYNOTE-581/307試験)〉(全集団)
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-581/E7080-307試験)
Motzer R et al. N Engl J Med 2021; 384: 1289-1300#1
Motzer RJ et al. J Clin Oncol 2024; 42: 1222-1228#2
#1 CLEAR試験(KEYNOTE-581/E7080-307試験)はエーザイ株式会社・MSD社の資金提供により行われた。Robert Motzerはエーザイ株式会社・MSD社から顧問料などを受領している。その他の著者に同社から顧問料などを受領している者が含まれる。本試験はアカデミックアドバイザーとエーザイ株式会社・MSD社の社員によりデザインされた。著者のうち、Rodolfo F. PeriniはMSD社、Alan D. Smith、Corina E. Dutcus、Lea Dutta、Kalgi Mody、Dongyuan Xingはエーザイ株式会社の社員である。
#2 最終解析はエーザイ株式会社・MSD社の資金提供により行われた。Robert J. Motzerはエーザイ株式会社・MSD社から研究費などを受領している。その他の著者に同社から研究費などを受領している者が含まれる。著者のうち、Karla Rodriguez-Lopez、Joseph BurgentsはMSD社、Cixin He、Chinyere E. Okpara、Jodi McKenzieはエーザイ株式会社の社員である。
本併用療法は、一部承認外の効能又は効果、用法及び用量による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。本試験におけるレンビマ®+エベロリムス併用群のデータは国内未承認のため削除しています。
試験概要
【目的】
化学療法未治療の根治切除不能又は転移性腎細胞癌患者におけるキイトルーダ®+レンビマ®併用又はレンビマ®+エベロリムス併用とスニチニブ単独の有効性及び安全性を比較検討する。
【デザイン】
国際共同無作為化非盲検第Ⅲ相試験[優越性検証試験]
[第1回中間解析結果(データカットオフ日:2018年12月6日)、第2回中間解析結果(データカットオフ日:2019年11月15日)、第3回中間解析結果(データカットオフ日:2020年8月28日)、第4回中間解析結果(データカットオフ日:2021年3月31日)、最終解析結果(データカットオフ日:2022年7月31日)]
【対象】
化学療法未治療の根治切除不能又は転移性腎細胞癌患者1,069例
【方法】
キイトルーダ®+レンビマ®※併用群[キイトルーダ®200mgを3週間間隔(Q3W)で点滴静注とレンビマ®※20mgを1日1回(QD)で経口投与]、レンビマ®+エベロリムス併用群注)[レンビマ®18mgQDで経口投与とエベロリムス5mgQDで経口投与]又はスニチニブ群[50mgQDで4週間経口投与後、2週間休薬]に1:1:1の割合で無作為に割り付けた。無作為化後、盲検下独立中央判定を8週間毎に実施し、抗腫瘍効果を評価した。盲検下独立中央判定による進行(PD)の確定、許容できない毒性の発現、患者の要望、同意撤回、キイトルーダ®35回投与の完了又は治験依頼者による治験中止まで治験薬の投与を継続した。
※レンビマ®の効能又は効果、用法及び用量は以下のとおりです(一部抜粋)。
4. 効能又は効果(抜粋)
根治切除不能又は転移性の腎細胞癌
6. 用法及び用量(抜粋)
<根治切除不能又は転移性の腎細胞癌>
ペムブロリズマブ(遺伝子組換え)との併用において、通常、成人にはレンバチニブとして1日1回20mgを経口投与する。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意(抜粋)
<根治切除不能又は転移性の腎細胞癌>
7.6 副作用があらわれた場合は、症状、重症度等に応じて以下の基準を考慮して、本剤を減量、休薬又は中止すること。減量して投与を継続する場合には、1日1回14mg、10mg、8mg又は4mgに減量すること。
減量、休薬及び中止基準
【評価項目】
主要評価項目:無増悪生存期間(progression free survival;PFS)#
副次評価項目:全生存期間(overall survival;OS)#及び奏効率(overall response rate;ORR)#、次治療におけるPDまでの無増悪生存期間(progression free survival during next-line therapy; PFS2)健康関連QoL(HRQoL)、安全性 など
その他の評価項目:奏効期間(duration of response;DOR)、病勢コントロール率(disease control rate;DCR)など
#検証的解析項目
【判定基準】
PFS、ORR、DORについて、RECISTガイドライン1.1版に基づき盲検下独立中央判定により評価した。PFS2は、RECISTガイドライン1.1版に基づき治験責任医師判定により評価した。HRQoLへの影響をFunctional Assessment of Cancer Therapy Kidney Symptom Index-Disease-Related Symptoms(FKSI-DRS)、European Organization for Research and Treatment of Cancer Quality of Life Questionnaire for Patients With Cancer-Core 30(EORTC QLQ-C30)及びEQ-5D-3L with the associated EuroQoL Visual Analogue Scale(EQ-VAS)を用いて評価した。
【解析計画】
解析対象集団:有効性はITT集団*5、安全性は安全性解析対象集団*6を解析対象とした。
統計手法:OS、PFS、PFS2はKaplan-Meier法を用いて推定した。OS、PFS、PFS2の群間比較は地域(西欧及び北米又はその他)及びMSKCCリスク分類(favorable、intermediate又はpoor)を層とした層別ログランク検定により評価した。ハザード比と95%信頼区間の算出は、投与群を共変量とし、地域及びMSKCCリスク分類で層別した層別Cox比例ハザードモデルにより評価した。ORRの群間差は、地域及びMSKCCリスク分類を層としたCochran-Mantel-Haenszel検定により評価した。また、年齢(<65歳、≧65歳)、性別(男性、女性)、人種(白人、アジア人)、地域(西欧及び北米、その他)、MSKCCリスク分類(favorable、intermediate、poor)、IMDCリスク分類(favorable、intermediate、poor)、ベースライン時のKPSスコア(100-90、80-70)、転移臓器数(1、2、≧3)、ベースライン時の骨転移(あり、なし)、ベースライン時の肝転移(あり、なし)、ベースライン時の肺転移(あり、なし)、PD-L1発現(CPS≧1、CPS<1)、腎摘除術歴(あり、なし)、肉腫様成分(あり、なし)についてのPFS、OS及びORRの部分集団解析を実施した。
日本人集団については、治験実施計画書に記載されていないが、OS、PFS、ORR、DORについても算出し、評価資料として承認時に評価された。
多重性の調整:本試験において、PFSは1回の中間解析及び最終解析、OSは3回の中間解析及び最終解析、ORRは1回の中間解析及び最終解析を事前に計画した。ORRの1回目の中間解析時の推定における両側0.0001の有意水準を差し引き、PFS、OS及びORRの検定の手順全体の有意水準を両側0.0499となるように厳密に制御した。これらの多重性の調整には、Maurer & Bretzのgraphical approachを用いた。他の副次及び探索的な評価項目に関しては多重性の調整は実施しない。最初に割り当てられた有意水準0.045(又は0.0049)にてPFSの帰無仮説が棄却された場合、この有意水準0.045(又は0.0049)に示される重みに従い、他の検定に再配分した。PFS、OSの中間解析及び最終解析の有意水準の配分はα消費関数にて決定した。
検定手順:
*1 MSKCC(Memorial Sloan Kettering Cancer Center)リスク分類: 5つのリスク因子[Karnofsky PS80%未満、初診から治療開始までの期間(本試験の無作為化までの期間)が1年未満、ヘモグロビン値が正常範囲の下限未満、乳酸脱水素酵素が正常値上限の1.5倍超、補正血清カルシウム値が10.0mg/dL超]で構成され、MSKCCスコア0をfavorable、1-2をintermediate、3以上をpoorに分類
*2 副作用管理を目的として、段階的な減量(14mg、10mg、8mg)を可能とした
*3 4週間連日投与後、2週間休薬
*4 副作用管理を目的として、段階的な減量(37.5mg QD、25mg QD)を可能とした
*5 ITT(intention-to-treat)集団:無作為化されたすべての患者
*6 安全性解析対象集団:治験薬が1回以上投与されたすべての患者
患者背景(ITT集団)
*1 MSKCC(Memorial Sloan Kettering Cancer Center)リスク分類:5つのリスク因子[Karnofsky PS80%未満、初診から治療開始までの期間(本試験の無作為化までの期間)が1年未満、ヘモグロビン値が正常範囲の下限未満、乳酸脱水素酵素が正常値上限の1.5倍超、補正血清カルシウム値が10.0mg/dL超]で構成され、MSKCCスコア0をfavorable、1-2をintermediate、3以上をpoorに分類
*2 IMDC(International Metastatic Renal Cell Carcinoma Database Consortium)リスク分類:6つのリスク因子[Karnofsky PS80未満、初診から治療開始までの期間(本試験の無作為化までの期間)が1年未満、ヘモグロビン値が正常範囲の下限未満、補正血清カルシウム値が正常範囲の上限超、好中球数が正常範囲の上限超、血小板数が正常範囲の上限超]で構成され、IMDCスコア0をfavorable、1-2をintermediate、3-6をpoorに分類
*3 immunohistochemistry 22C3 pharmDxを用いて、CPS[combined positive score:PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた数値]1以上を陽性とした
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-581/E7080-307試験)
主要評価項目:無増悪生存期間(PFS)
キイトルーダ®+レンビマ®併用群はスニチニブ群に対して、PFSを有意に延長しました(ハザード比:0.39、95%CI:0.32, 0.49、p<0.0001、層別ログランク検定[両側]、有意水準α=0.0411;検証的解析結果)。
PFS中央値はキイトルーダ®+レンビマ®併用群で23.9ヵ月(95%CI:20.8, 27.7)、スニチニブ群で9.2ヵ月(95%CI:6.0, 11.0)であり、6ヵ月時点の無増悪生存率はそれぞれ84.9%(95%CI:80.6, 88.3)、57.0%(95%CI:51.1, 62.5)、12ヵ月時点の無増悪生存率はそれぞれ70.6%(95%CI:65.3, 75.2)、38.4%(95%CI:32.4, 44.3)、18ヵ月時点の無増悪生存率はそれぞれ57.4%(95%CI:51.5, 62.8)、31.2%(95%CI:25.4, 37.2)、24ヵ月時点の無増悪生存率はそれぞれ48.9%(95%CI:42.7, 54.9)、20.7%(95%CI:15.0, 26.9)でした。
■無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
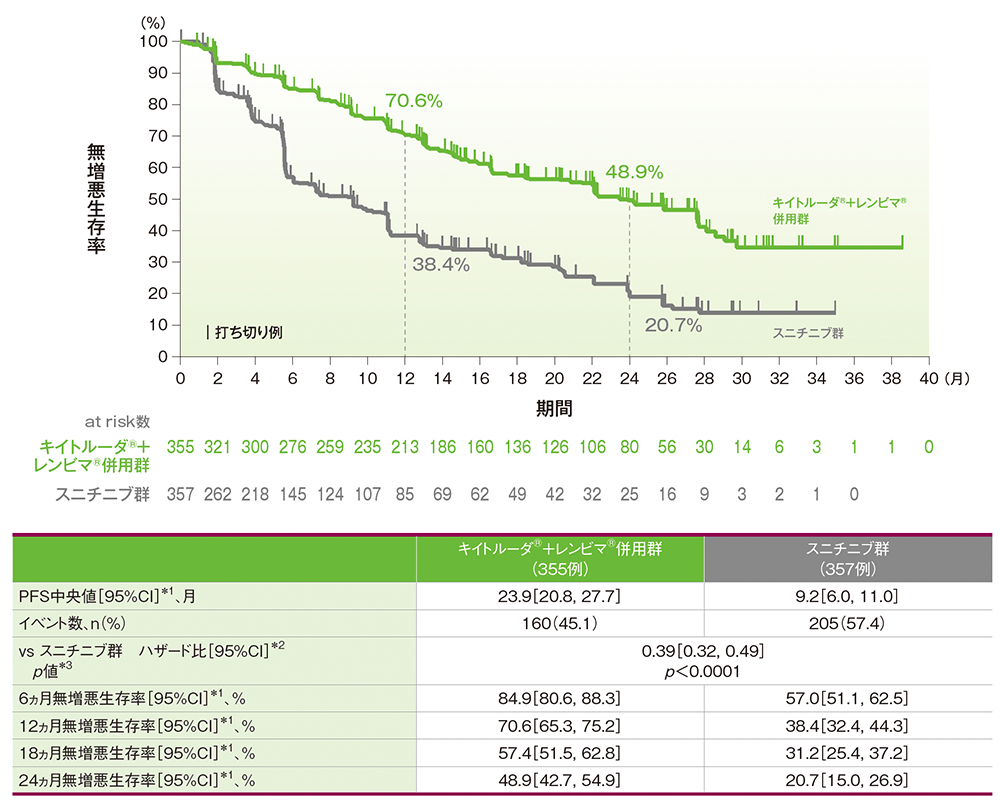
RECISTガイドライン1.1版に基づく盲検下独立中央判定
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、地域(西欧及び北米、その他)及びMSKCCリスク分類(favorable、intermediate、poor)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[両側](層別因子は無作為化に用いた層別因子)、有意水準α=0.0411
[追跡期間(PFSの打ち切りイベントを反転させたデータを用いKaplan-Meier推定法で算出)中央値(95%CI) キイトルーダ®+レンビマ®併用群:22.3(21.1, 25.6)ヵ月、スニチニブ群:16.6(13.1, 18.5)ヵ月]
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-581/E7080-307試験)
サブグループ解析:部分集団因子別の無増悪生存期間(PFS)
■PFSのハザード比のフォレストプロット(ITT集団)
RECISTガイドライン1.1版に基づく盲検下独立中央判定
* 投与群を共変量とし、地域(西欧及び北米、その他)及びMSKCCリスク分類(favorable、intermediate、poor)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-581/E7080-307試験)

PFS中央値はキイトルーダ®+レンビマ®併用群で23.9ヵ月(95%CI:20.8, 27.7)、スニチニブ群で9.2ヵ月(95%CI:6.0, 11.0)でした。
■無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
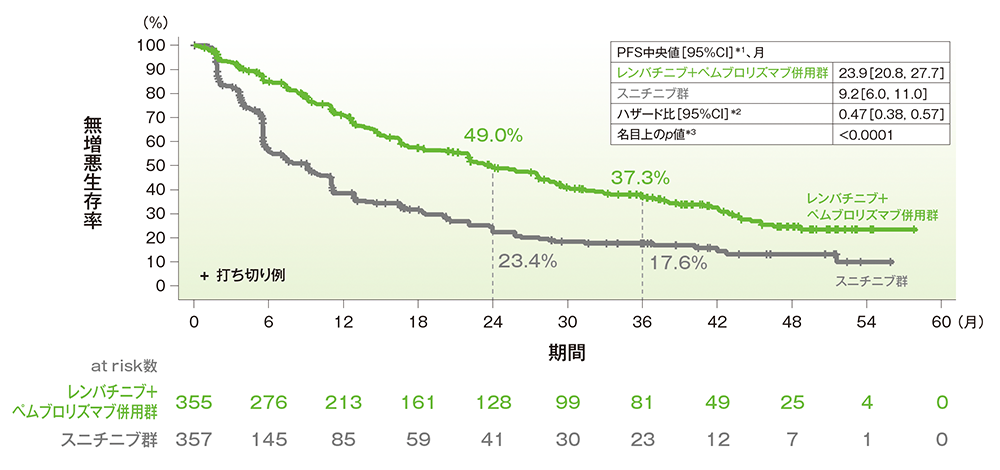
Borrowed with permission from[ Motzer RJ et al, Lenvatinib Plus Pembrolizumab Versus Sunitinib in First-Line Treatment of Advanced Renal Cell Carcinoma: Final Prespecified Overall Survival Analysis of CLEAR, a Phase III Study, J Clin Oncol 2024; 42(11):1222-1228. https://ascopubs.org/journal/jco]
©American Society of Clinical Oncology.

RECISTガイドライン1.1版に基づく盲検下独立中央判定
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、地域(西欧及び北米、その他)及びMSKCCリスク分類(favorable、intermediate、poor)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定(層別因子は無作為化に用いた層別因子)
[追跡期間(PFSの打ち切りイベントを反転させたデータを用いKaplan-Meier推定法で算出)中央値(四分位範囲) レンバチニブ+ペムブロリズマブ併用群:39.2(22.1, 48.5)ヵ月、スニチニブ群:20.6(5.5, 41.2)ヵ月]
Motzer RJ et al. J Clin Oncol 2024; 42: 1222-1228
(本試験はエーザイ株式会社・MSD社の資金提供により行われた。)

■サブグループ解析:PFSのハザード比のフォレストプロット(ITT集団)
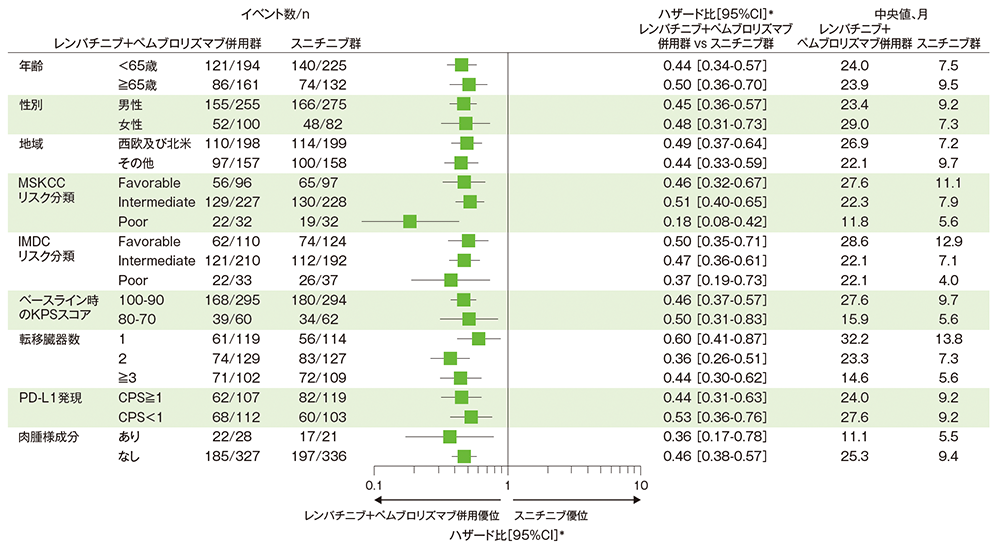
RECISTガイドライン1.1版に基づく盲検下独立中央判定
* 投与群を共変量とし、地域(西欧及び北米、その他)及びMSKCCリスク分類(favorable、intermediate、poor)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
Motzer RJ et al. J Clin Oncol 2024; 42: 1222-1228
(本試験はエーザイ株式会社・MSD社の資金提供により行われた。)
副次評価項目:全生存期間(OS)
キイトルーダ®+レンビマ®併用群はスニチニブ群に対して、OSを有意に延長しました(ハザード比:0.66、95%CI:0.49, 0.88、p=0.0049、層別ログランク検定[両側]、有意水準α=0.0161;検証的解析結果)。
OS中央値はキイトルーダ®+レンビマ®併用群及びスニチニブ群ともに未到達であり、12ヵ月時点の全生存率はそれぞれ91.4%(95%CI:87.9, 93.9)、80.2%(95%CI:75.5, 84.1)、18ヵ月時点の全生存率はそれぞれ87.1%(95%CI:83.1, 90.3)、74.4%(95%CI:69.3, 78.8)、24ヵ月時点の全生存率はそれぞれ79.2%(95%CI:74.1, 83.3)、70.4%(95%CI:65.0, 75.2)でした。
■全生存期間(OS)のKaplan-Meier曲線(ITT集団)

*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、地域(西欧及び北米、その他)及びMSKCCリスク分類(favorable、intermediate、poor)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[両側](層別因子は無作為化に用いた層別因子)、有意水準α=0.0161
[追跡期間(OSの打ち切りイベントを反転させたデータを用いKaplan-Meier推定法で算出)中央値(95%CI) キイトルーダ®+レンビマ®併用群:26.7(25.9, 27.4)ヵ月、スニチニブ群:26.3(25.4, 27.2)ヵ月]
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-581/E7080-307試験)

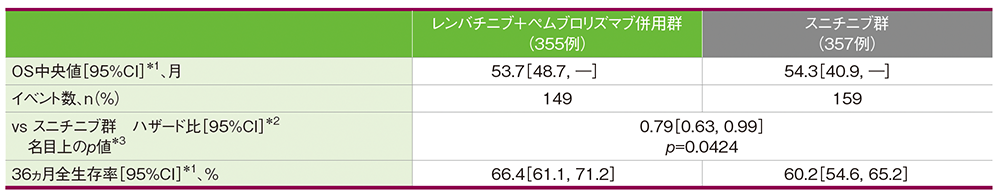
OS中央値はキイトルーダ®+レンビマ®併用群で53.7ヵ月(95%CI:48.7, 未到達)、スニチニブ群で54.3ヵ月(95%CI:40.9, 未到達)でした。
■ 全生存期間(OS)の/Kaplan-Meier曲線(ITT集団)
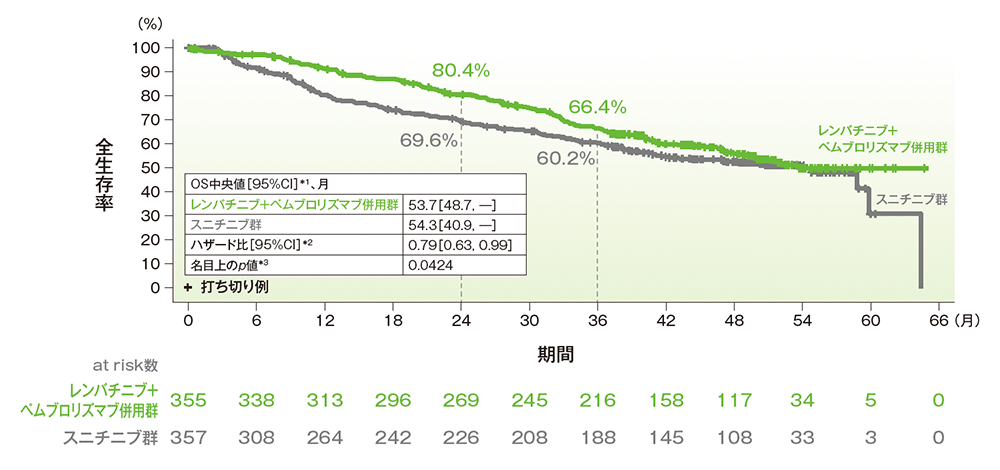
Borrowed with permission from[ Motzer RJ et al, Lenvatinib Plus Pembrolizumab Versus Sunitinib in First-Line Treatment of Advanced Renal Cell Carcinoma: Final Prespecified Overall Survival Analysis of CLEAR, a Phase III Study, J Clin Oncol 2024; 42(11):1222-1228. https://ascopubs.org/journal/jco]
©American Society of Clinical Oncology.
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、地域(西欧及び北米、その他)及びMSKCCリスク分類(favorable、intermediate、poor)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定(層別因子は無作為化に用いた層別因子)
[追跡期間(OSの打ち切りイベントを反転させたデータを用いKaplan-Meier推定法で算出)中央値(四分位範囲) レンバチ
ニブ+ペムブロリズマブ併用群:49.8(41.4 , 53.1)ヵ月、スニチニブ群:49.4(41.6, 52.8)ヵ月]
Motzer RJ et al. J Clin Oncol 2024; 42: 1222-1228
(本試験はエーザイ株式会社・MSD社の資金提供により行われた。)
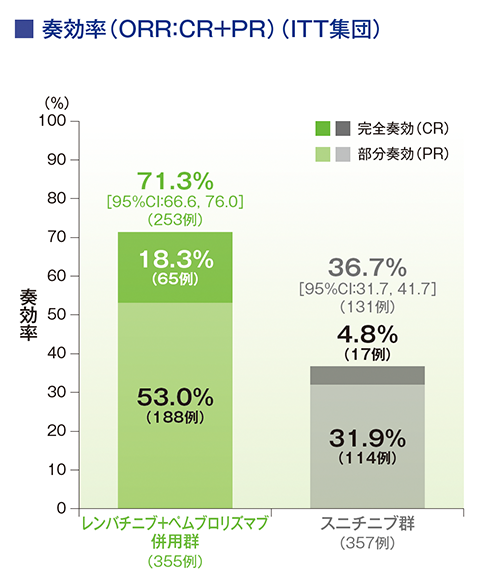
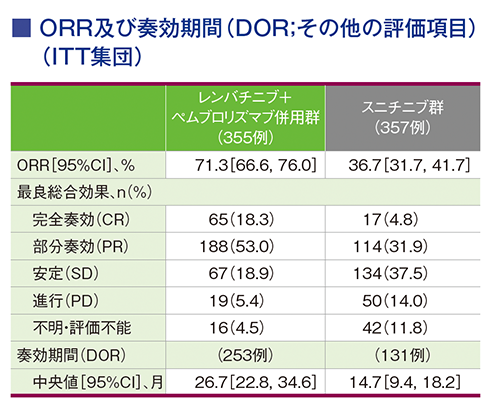
副次評価項目:奏効率(ORR)
第2回中間解析におけるORRはキイトルーダ®+レンビマ®併用群67.3%(95%CI:62.4, 72.2)、スニチニブ群35.0%(95%CI:30.1, 40.0)でした(群間差:32.3、95%CI:25.4, 39.3、p<0.0001、層別Cochran-Mantel-Haenszel検定[両側]、有意水準α=0.0045;検証的解析結果)。また、第3回中間解析におけるORRはキイトルーダ®+レンビマ®併⽤群71.0%(95%CI:66.3, 75.7)、スニチニブ群36.1%(95%CI:31.2, 41.1)でした。
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-581/E7080-307試験)

ORRはキイトルーダ®+レンビマ®併用群で71.3%(95%CI:66.6, 76.0)、スニチニブ群で36.7%(95%CI:31.7, 41.7)でした。
Motzer RJ et al. J Clin Oncol 2024; 42: 1222-1228 より作成
(本試験はエーザイ株式会社・MSD社の資金提供により行われた。)
安全性
キイトルーダ®+レンビマ®併用群
キイトルーダ®+レンビマ®併用群における副作用は341/352例(96.9%)に認められました。主な副作用(発現率20%以上)は下痢192例(54.5%)、高血圧184例(52.3%)、甲状腺機能低下症150例(42.6%)、食欲減退123例(34.9%)、口内炎及び疲労 各113例(32.1%)、手掌・足底発赤知覚不全症候群99例(28.1%)、蛋白尿97例(27.6%)、悪心94例(26.7%)、発声障害87例(24.7%)、発疹77例(21.9%)、無力症71例(20.2%)でした。
重篤な副作用は119例(33.8%)に認められ、2例以上にみられた重篤な副作用は下痢10例(2.8%)、肺臓炎8例(2.3%)、副腎機能不全、嘔吐及び高血圧 各7例(2.0%)、急性心筋梗塞及び膵炎 各5例(1.4%)、心筋梗塞、悪心、免疫性肝炎及び急性腎障害 各4例(1.1%)、食欲減退、腎炎及び腎不全 各3例(0.9%)、心筋炎、甲状腺機能低下症、腹痛、大腸炎、発熱、肺炎、アミラーゼ増加、リパーゼ増加、体重減少、可逆性後白質脳症症候群、精神状態変化及び発疹 各2例(0.6%)でした。
副作用によるキイトルーダ®及びレンビマ®の投与中止は34例(9.7%)に認められ、2例以上に発現したキイトルーダ®及びレンビマ®の投与中止に至った副作用は急性腎障害、蛋白尿、肺臓炎及び発疹 各2例(0.6%)でした。副作用によるキイトルーダ®の投与中止は88例(25.0%)に認められ、2例以上に発現したキイトルーダ®の投与中止に至った副作用は肺臓炎10例(2.8%)、発疹6例(1.7%)、下痢及びアラニンアミノトランスフェラーゼ増加 各4例(1.1%)、アスパラギン酸アミノトランスフェラーゼ増加、血中クレアチニン増加、急性腎障害及び腎不全 各3例(0.9%)、急性心筋梗塞、心筋炎、甲状腺機能低下症、大腸炎、高トランスアミナーゼ血症、免疫性肝炎、体重減少及び蛋白尿 各2例(0.6%)でした。
副作用によるレンビマ®の投与中止は65例(18.5%)に認められ、2例以上に発現したレンビマ®の投与中止に至った副作用は下痢5例(1.4%)、急性心筋梗塞及び蛋白尿 各4例(1.1%)、心筋梗塞、急性腎障害及び発疹 各3例(0.9%)、肺臓炎及び高血圧クリーゼ 各2例(0.6%)でした。
副作用による死亡は4例(1.1%)で、その内訳は血中クレアチニン増加、高血圧クリーゼ及び筋無力症候群 各1例(0.3%)、自己免疫性肝炎、心筋炎、腎炎及び肺臓炎の4件1例(0.3%)でした。
スニチニブ群
スニチニブ群の副作用は313/340例(92.1%)に認められました。主な副作用(発現率20%以上)は下痢151例(44.4%)、高血圧133例(39.1%)、口内炎127例(37.4%)、手掌・足底発赤知覚不全症候群122例(35.9%)、疲労109例(32.1%)、悪心94例(27.6%)、味覚不全88例(25.9%)、食欲減退84例(24.7%)、甲状腺機能低下症79例(23.2%)でした。
重篤な副作用は51例(15.0%)に認められ、2例以上にみられた重篤な副作用は発熱5例(1.5%)、血小板減少症及び脱水 各3例(0.9%)、下痢、無力症、疲労、尿路感染、駆出率減少、低ナトリウム血症及び高血圧 各2例(0.6%)でした。
副作用によるスニチニブの投与中止は34例(10.0%)に認められ、2例以上に発現したスニチニブの投与中止に至った副作用は悪心、無力症及び疲労 各3例(0.9%)、口内炎2例(0.6%)でした。
副作用による死亡は1例(0.3%)に死亡を認めました。
■主な副作用(いずれかの投与群で発現率5%以上)
(安全性解析対象集団)
MedDRA/J v23.0、GradeはNCI CTCAE v4.03
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-581/E7080-307試験)

キイトルーダ®+レンビマ®併用群における副作用は341/352例(96.9%)に認められました。
重篤な副作用は127例(36.1%)に認められました。副作用による投与中止は128例(36.4%)に認められ、副作用によるキイトルーダ®及びレンビマ®の投与中止は34例(9.7%)、副作用によるキイトルーダ®の投与中止は92例(26.1%)、副作用によるレンビマ®の投与中止は83例(23.6%)でした。副作用による死亡は4例(1.1%)で、その内訳は血中クレアチニン増加、高血圧クリーゼ及び筋無力症候群各1例、自己免疫性肝炎、心筋炎、腎炎及び肺臓炎の4件1例でした。
スニチニブ群の副作用は313/340例(92.1%)に認められました。重篤な副作用は53例(15.6%)に認められました。副作用によるスニチニブの投与中止は38例(11.2%)に認められました。副作用による死亡は、一般・全身障害及び投与部位の状態の事象が1例認められました。
主な副作用の例数、発現率及び事象名、投与中止に至った副作用及び重篤な副作用の事象名は文献に記載されていませんでした。安全性情報についてはDIページをご参照ください。
Motzer RJ et al. J Clin Oncol 2024; 42: 1222-1228
(本試験はエーザイ株式会社・MSD社の資金提供により行われた。)
免疫関連など特に注目すべき有害事象
キイトルーダ®+レンビマ®併用群における免疫関連など特に注目すべき有害事象は214/352例(60.8%)に認められました。主な免疫関連など特に注目すべき有害事象(発現率10%以上)は甲状腺機能低下症166例(47.2%)でした。重篤な免疫関連など特に注目すべき有害事象は44例(12.5%)に認められ、2例以上にみられた重篤な免疫関連など特に注目すべき有害事象は肺臓炎9例(2.6%)、副腎機能不全及び膵炎 各7例(2.0%)、肝炎6例(1.7%)、大腸炎及び重度の皮膚障害 各4例(1.1%)、甲状腺機能低下症及び腎炎 各3例(0.9%)、脳炎、下垂体炎及び心筋炎 各2例(0.6%)でした。免疫関連など特に注目すべき有害事象によるキイトルーダ®の投与中止は36例(10.2%)に認められ、2例以上にみられたキイトルーダ®の投与中止に至った免疫関連など特に注目すべき有害事象は肺臓炎10例(2.8%)、重度の皮膚障害5例(1.4%)、大腸炎及び膵炎 各3例(0.9%)、肝炎、甲状腺機能低下症、心筋炎及び筋炎 各2例(0.6%)でした。免疫関連など特に注目すべき有害事象による死亡は2例(0.6%)に認められ、その内訳は筋無力症候群1例(0.3%)、自己免疫性肝炎、心筋炎、腎炎及び肺臓炎の4件1例(0.3%)でした。
スニチニブ群における免疫関連など特に注目すべき有害事象は105/340例(30.9%)に認められました。主な免疫関連など特に注目すべき有害事象(発現率10%以上)は甲状腺機能低下症90例(26.5%)でした。重篤な免疫関連など特に注目すべき有害事象は1例(0.3%)に膵炎を認めました。本試験において、免疫関連など特に注目すべき有害事象によるスニチニブの投与中止、免疫関連など特に注目すべき有害事象による死亡は認められませんでした。
■免疫関連など特に注目すべき有害事象(安全性解析対象集団)
MedDRA/J v23.0、GradeはNCI CTCAE v4.03
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-581/E7080-307試験)

最終解析における免疫関連など特に注目すべき有害事象については、論文に記載されていませんでした。
安全性情報についてはDIページをご参照ください。
Motzer RJ et al. J Clin Oncol 2024; 42: 1222-1228
(本試験はエーザイ株式会社・MSD社の資金提供により行われた。)
キイトルーダ®+レンビマ®の投与期間中は、下記の検査スケジュールを参考に患者さんの状態を観察してください
■キイトルーダ®200mgを3週間間隔及びレンビマ®20mgを1日1回投与したCLEAR試験(KEYNOTE-581/307試験)における検査スケジュール(キイトルーダ®は最大35回投与)
※1 3サイクル目以降、15日目の血圧モニタリング/尿検査は必要に応じて実施
※2 妊娠の可能性がある女性では、治療開始前72時間以内に実施
Motzer R et al. N Engl J Med 2021; 384: 1289-1300(protocol)より作表
(本試験はエーザイ株式会社・MSD社の資金提供により行われた。)
■CLEAR試験(KEYNOTE-581/307試験)における具体的な検査項目
Motzer R et al. N Engl J Med 2021; 384: 1289-1300(protocol)より作表
(本試験はエーザイ株式会社・MSD社の資金提供により行われた。)