1次治療:KEYNOTE-052試験(海外データ)
本試験には、国内で承認された効能又は効果と異なる成績が含まれていますが、承認時に評価された試験成績のため紹介しています。
海外第Ⅱ相試験:KEYNOTE-052試験(海外データ)
承認時評価資料:海外第Ⅱ相試験(KEYNOTE-052試験)
社内資料:海外第Ⅱ相試験(KEYNOTE-052試験)(安全性)
試験概要
【目的】
シスプラチンを含む化学療法に不適格な未治療の根治切除不能な尿路上皮癌患者を対象にキイトルーダ®単剤療法の有効性及び安全性を評価する。
【デザイン】
海外非無作為化非盲検第Ⅱ相試験
データカットオフ日:2018年9月26日(追跡期間中央値:11.4ヵ月)
データカットオフ日:2020年9月26日(追跡期間中央値:56.3ヵ月)
【対象】
シスプラチンを含む化学療法に不適格な未治療の根治切除不能な尿路上皮癌患者374例
【方法】
キイトルーダ® [200mgを3週間間隔(Q3W)で点滴静注]は、最大35サイクルまで投与可能とした。患者が臨床的ベネフィットを継続して示し、安定している場合には、治験担当医師の判断でRECISTガイドライン1.1版に基づく疾患進行が認められた後も継続投与可能とした。キイトルーダ®の初回投与9週間後(±1週間)、以降は6週間(±1週間)毎に、投与開始12ヵ月以降は12週間(±1週間)毎に抗腫瘍効果を評価した。
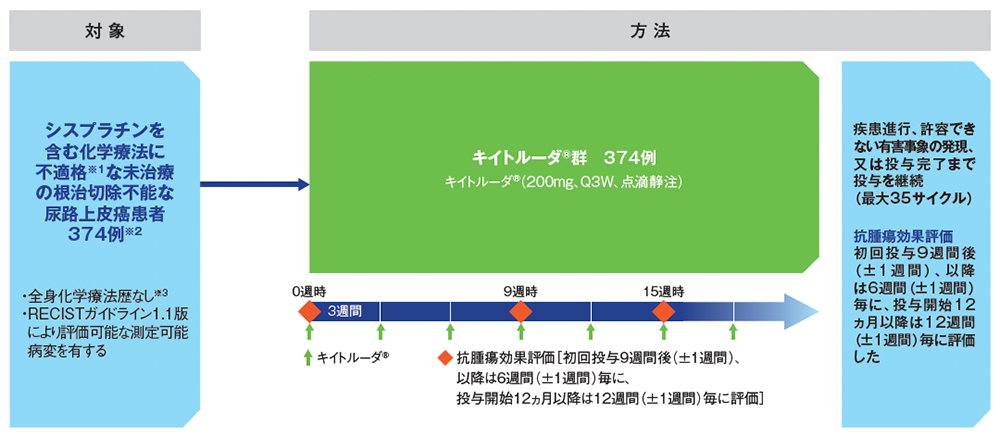
※1 シスプラチンを含む化学療法に不適格な患者(全体集団)(374例)
以下の基準の①~⑤のうち1つ以上を満たす場合、シスプラチン不適格とみなした
①ECOG PS 2、②30≦CrCL<60mL/分(計算又は実測値)、③NCI CTCAE v.4.0 Grade 2以上の難聴、④NCI CTCAE v.4.0 Grade 2以上の末梢性ニューロパチー、⑤NYHAクラスⅢの心不全
※2 プラチナ製剤を含む化学療法に不適格な患者(サブグループ集団)(143例)を含む
以下の基準の①に加え、②~④のうち1つ以上を満たす場合、プラチナ製剤不適格とみなした
①ECOG PS 2、②内臓転移あり、③腎機能障害(ベースライン時のCrCL<60mL/分)、④80歳以上
※3 プラチナ製剤を含む術前/術後化学療法を受けた場合、治療終了後12ヵ月を超えて再発した患者は組入れ可能とした
【評価項目】
主要評価項目:奏効率(objective response rate:ORR)
副次評価項目:奏効期間(duration of response:DOR)、無増悪生存期間(progression free survival:PFS)、全生存期間(overall survival:OS)、6ヵ月及び12ヵ月時点の無増悪生存率及び全生存率、安全性など
【判定基準】
ORR、DOR、PFSは、RECISTガイドライン1.1版に基づき盲検下の独立判定委員会(blinded independent central review:BICR)の判定により評価した。
【解析計画】
解析対象集団:有効性及び安全性の解析はAPaT集団※1を対象として実施した。
有効性評価の統計手法:ORRの95%信頼区間(95%CI)は、Clopper-Pearson法による二項分布に基づく正確な方法で算出した。仮説検定は実施しなかった。DORの中央値は、Kaplan-Meier法を用いて推定した。PFS及びOSの中央値並びに6ヵ月及び12ヵ月時点の無増悪生存率及び全生存率は、Kaplan-Meier法を用いて推定した。治験実施計画書に記載されていないが、プラチナ製剤を含む化学療法に不適格な患者集団からなるサブグループ集団のORR、DOR、PFS、OSを算出し、評価資料として承認時に評価された。
【患者集団】
シスプラチンを含む化学療法に不適格な患者(全体集団)
以下の基準の①~⑤のうち1つ以上を満たす場合、シスプラチン不適格とみなした。
①ECOG PS 2、 ②30≦CrCL<60mL/分(計算又は実測値)、③Grade 2※2以上の難聴、④Grade 2※2
以上の末梢性ニューロパチー、⑤NYHAクラスⅢの心不全
プラチナ製剤を含む化学療法に不適格な患者(サブグループ集団)
以下の基準の①に加え、②~④のうち1つ以上を満たす場合、プラチナ製剤不適格とみなした。
①ECOG PS 2、②内臓転移あり、③腎機能障害(ベースライン時のCrCL<60mL/分)、④80歳以上
※1 APaT集団(All Participants as Treated):治験薬を1回以上投与されたすべての患者
※2 NCI CTCAE v.4.0
キイトルーダ®の電子添文は以下のとおりです。
4. 効能又は効果(抜粋)根治切除不能な尿路上皮癌
5. 効能又は効果に関連する注意(抜粋)
5.6 本剤の手術の補助療法としての有効性及び安全性は確立していない。
5.7 白金系抗悪性腫瘍剤を含む化学療法の適応とならない化学療法未治療患者への本剤単独投与については、他の治療の実施についても慎重に検討すること。
6. 用法及び用量(抜粋)
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
7. 用法及び用量に関連する注意(抜粋)
7.4 白金系抗悪性腫瘍剤を含む化学療法の適応となる化学療法未治療患者に対する本剤単独投与の有効性及び安全性は確立していない。
患者背景(APaT集団)
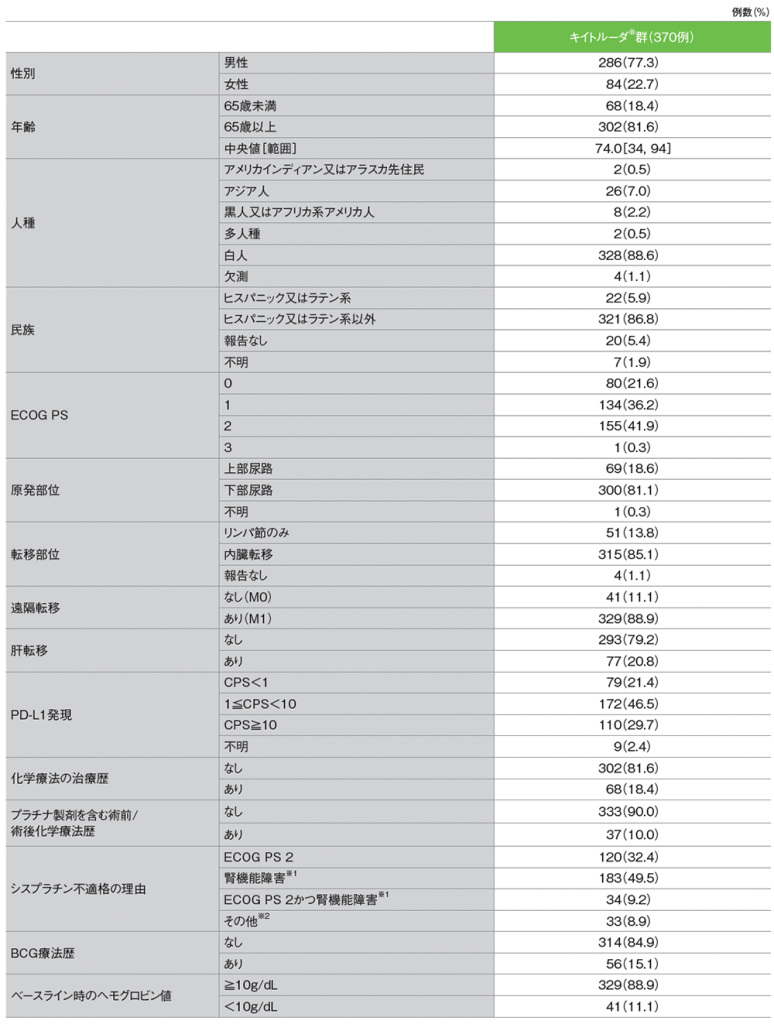
※1 ベースライン時のCrCL<60mL/分
※2 NYHAクラスⅢの心不全、Grade 2以上の末梢性ニューロパチー、Grade 2以上の難聴
全体集団であるシスプラチンを含む化学療法に不適格な患者集団の解析は、国内で承認された効能又は効果と異なる成績が含まれていますが、承認時に評価された試験成績のため掲載しています。
主要評価項目 奏効率:ORR:CR+PR
シスプラチンを含む化学療法に不適格な患者におけるORR(APaT集団)

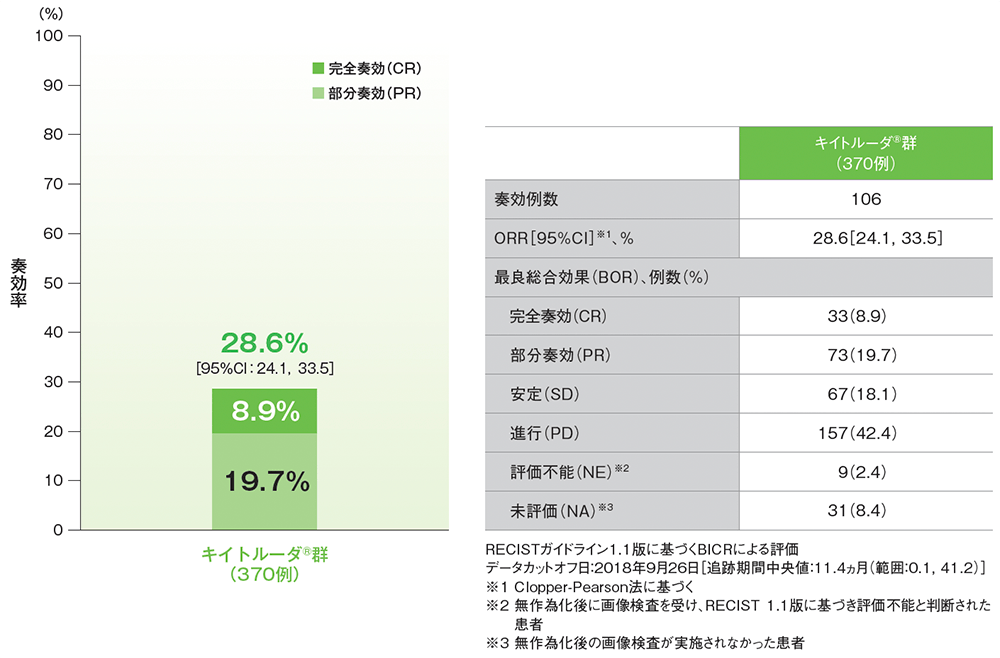
- 追跡期間中央値11.4ヵ月でのORRは28.6%(95%CI: 24.1, 33.5)でした。
キイトルーダ®の電子添文は以下のとおりです。
5. 効能又は効果に関連する注意(抜粋)
5.7 白金系抗悪性腫瘍剤を含む化学療法の適応とならない化学療法未治療患者への本剤単独投与については、他の治療の実施についても慎重に検討すること。
7. 用法及び用量に関連する注意(抜粋)
7.4 白金系抗悪性腫瘍剤を含む化学療法の適応となる化学療法未治療患者に対する本剤単独投与の有効性及び安全性は確立していない。
副次評価項目 奏効期間:DOR
シスプラチンを含む化学療法に不適格な患者におけるDORのKaplan-Meier曲線(APaT集団)

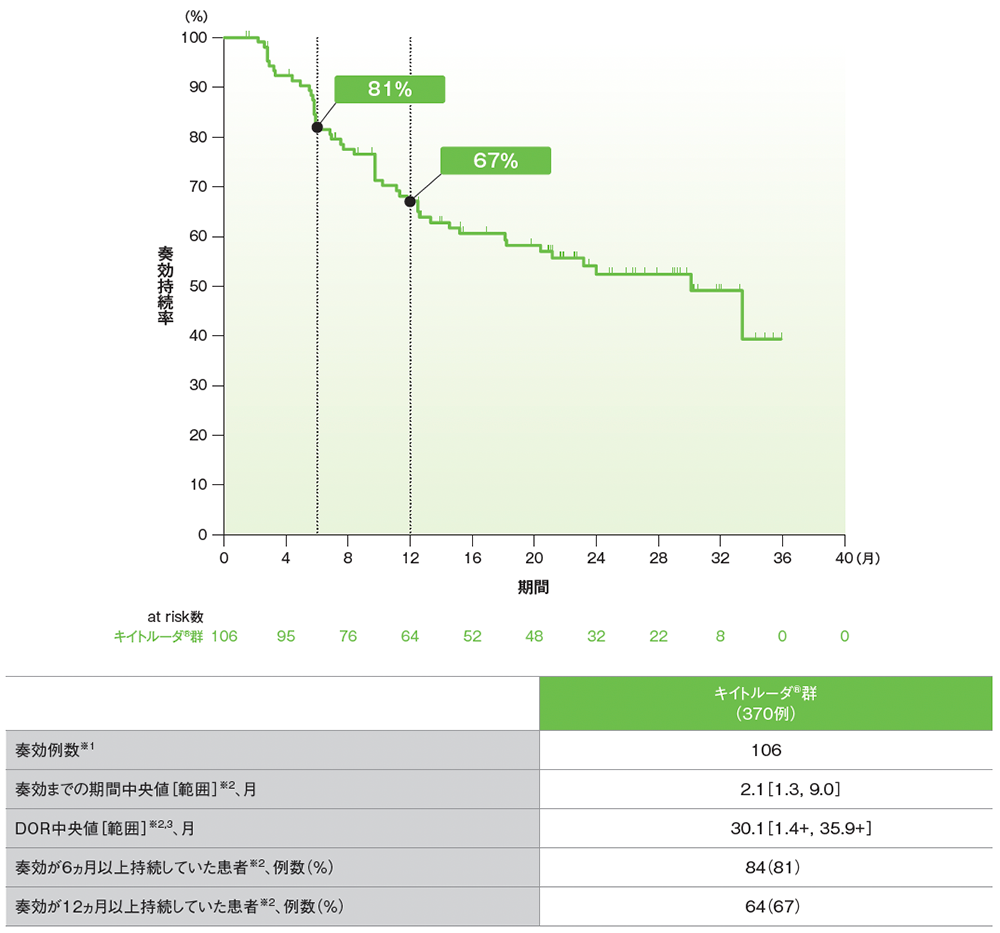
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2018年9月26日[追跡期間中央値:11.4ヵ月(範囲:0.1, 41.2)]
※1 CR又はPRが認められた患者数
※2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※3 「+」は最後の疾患評価までにPDがみられなかったことを示す
- 追跡期間中央値11.4ヵ月でのDOR中央値は30.1ヵ月(範囲: 1.4+, 35.9+)でした。
- 奏効が12ヵ月以上持続した割合は67%でした。
副次評価項目 無増悪生存期間:PFS
シスプラチンを含む化学療法に不適格な患者におけるPFSのKaplan-Meier曲線(APaT集団)

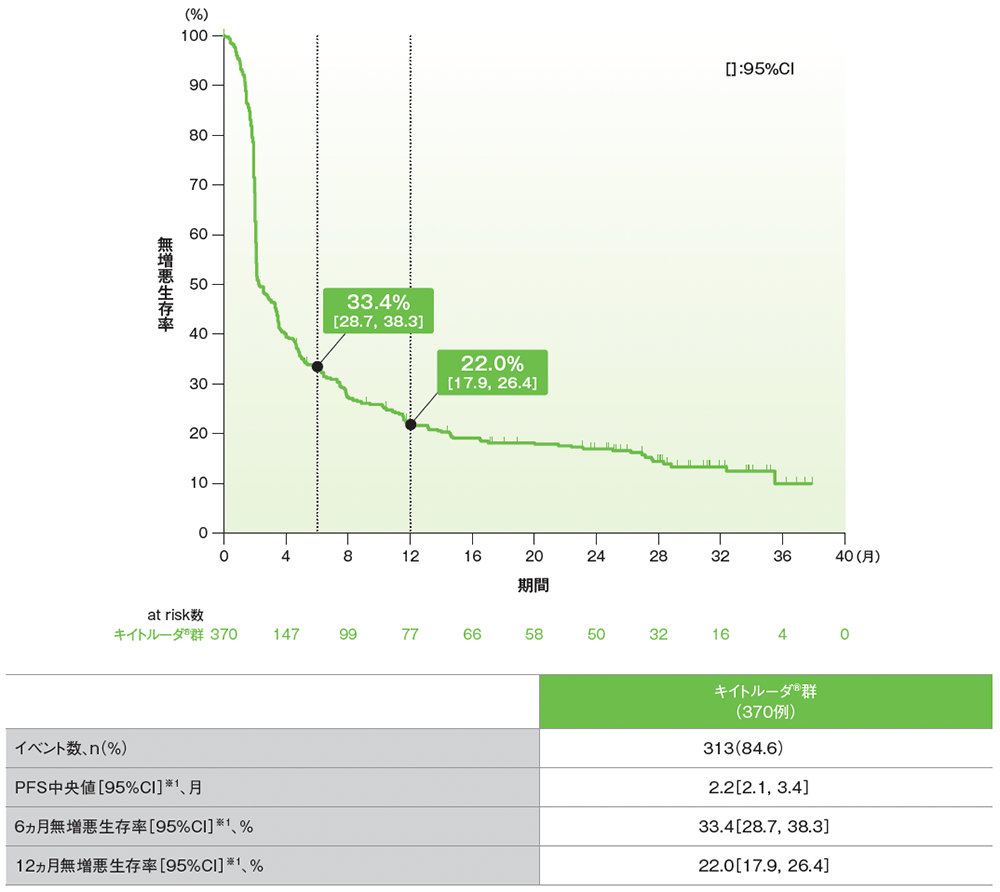
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2018年9月26日[追跡期間中央値:11.4ヵ月(範囲:0.1, 41.2)]
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
- 追跡期間中央値11.4ヵ月でのPFS中央値は2.2ヵ月(95%CI: 2.1, 3.4)でした。
副次評価項目 全生存期間:OS
シスプラチンを含む化学療法に不適格な患者におけるOSのKaplan-Meier曲線(APaT集団)


データカットオフ日:2018年9月26日[追跡期間中央値:11.4ヵ月(範囲:0.1, 41.2)]
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
- 追跡期間中央値11.4ヵ月でのOS中央値は11.3ヵ月(95%CI: 9.7, 13.1)でした。
安全性
シスプラチンを含む化学療法に不適格な患者における副作用

キイトルーダ®群の副作用は249/370例(67.3%)に認められました。
主な副作用(発現率10%以上)は、疲労67例(18.1%)、そう痒症66例(17.8%)、発疹43例(11.6%)、食欲減退40例(10.8%)、甲状腺機能低下症37例(10.0%)でした。
重篤な副作用は43例(11.6%)で認められました。2例以上に認められた重篤な副作用は肺臓炎5例(1.4%)、発熱3例(0.8%)、急性腎障害、副腎機能不全、関節炎、自己免疫性肝炎、大腸炎、糖尿病性ケトアシドーシス、肝炎、高カルシウム血症、心筋炎、尿細管間質性腎炎、1型糖尿病 各2例(0.5%)でした。
投与中止に至った副作用は34例(9.2%)に認められ、その内訳は肺臓炎6例(1.6%)、大腸炎4例(1.1%)、下痢、尿細管間質性腎炎 各2例(0.5%)、急性腎障害、アジソン病、関節痛、アスパラギン酸アミノトランスフェラーゼ増加、自己免疫性肝炎、自己免疫性ニューロパチー、血中ビリルビン増加、肝炎、下垂体炎、下垂体機能低下症、肝損傷、心筋炎、筋炎、浮腫、そう痒症、全身性そう痒症、発疹、腎不全、脂漏性皮膚炎、トランスアミナーゼ上昇、体重減少各1例(0.3%)でした。
死亡に至った副作用は1例(0.3%)で、その内訳は筋炎1例(0.3%)でした。
シスプラチンを含む化学療法に不適格な患者における主な副作用(発現割合5%以上)
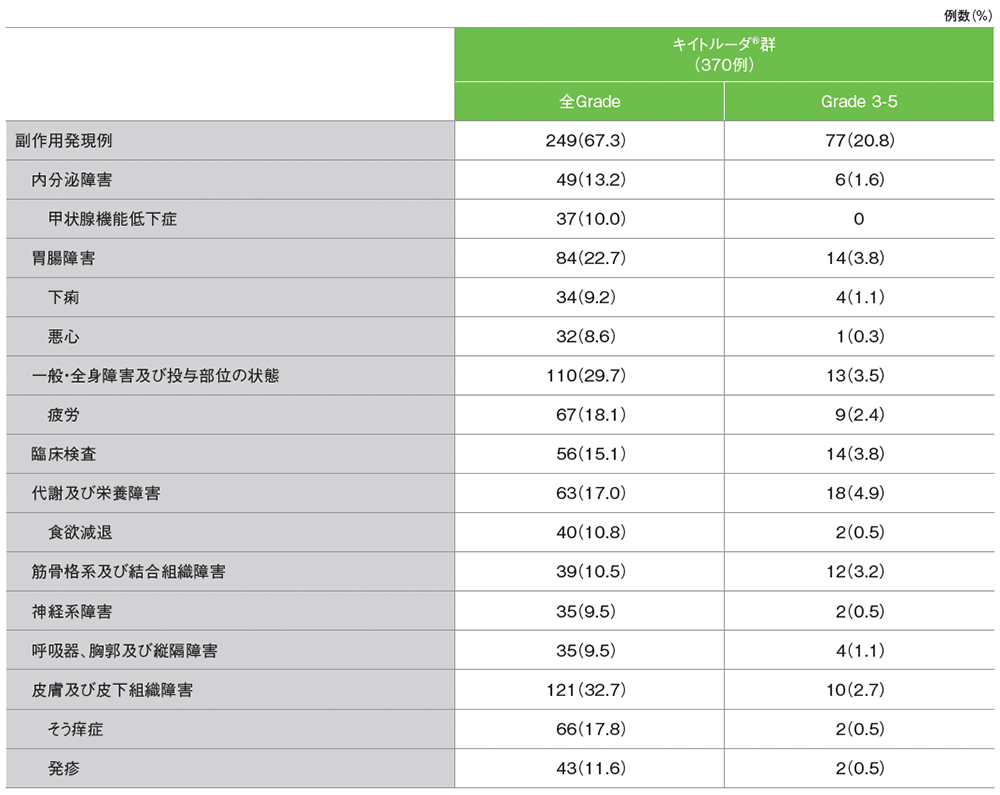
データカットオフ日:2018年9月26日[追跡期間中央値:11.4ヵ月(範囲:0.1, 41.2)]
MedDRA v21.0、GradeはCTCAE v4.0
免疫関連など特に注目すべき有害事象(APaT集団)
キイトルーダ®群の免疫関連など特に注目すべき有害事象は96/370例(25.9%)に認められました。主な免疫関連など特に注目すべき有害事象(発現率3%以上)は、甲状腺機能低下症42例(11.4%)、肺臓炎17例(4.6%)、甲状腺機能亢進症、大腸炎 各11例(3.0%)でした。
シスプラチンを含む化学療法に不適格な患者における免疫関連など特に注目すべき有害事象

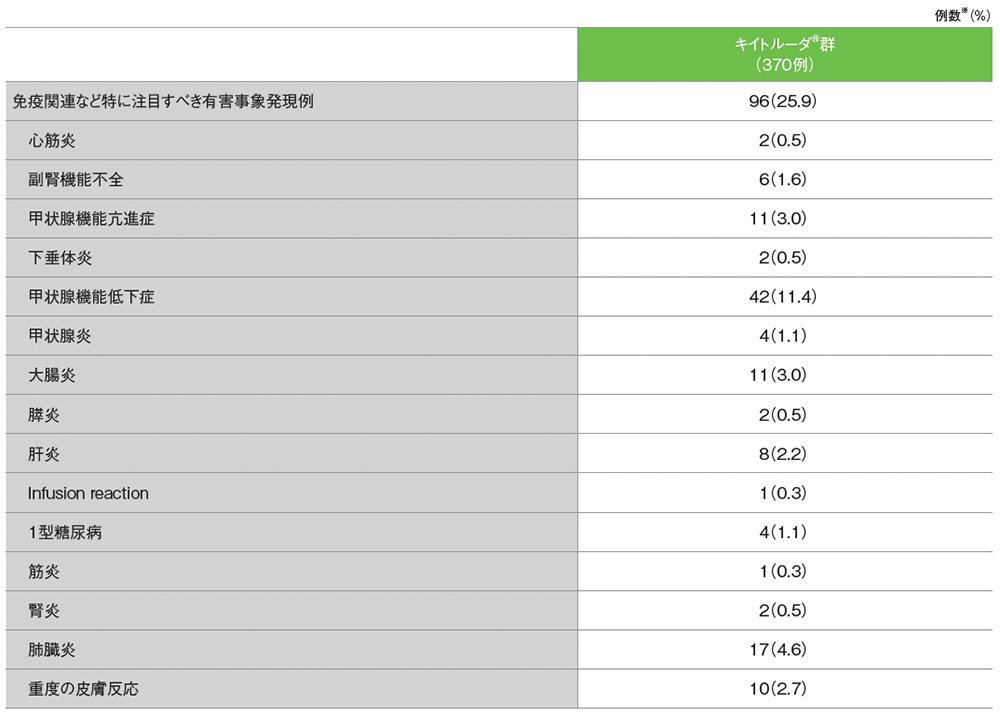
データカットオフ日:2018年9月26日[追跡期間中央値:11.4ヵ月(範囲:0.1, 41.2)]
MedDRA v21.0
※ カテゴリー別で集計
主要評価項目 奏効率:ORR:CR+PR
シスプラチンを含む化学療法に不適格な患者におけるORR(APaT集団)


- 追跡期間中央値56.3ヵ月でのORRは28.9%(95%CI: 24.3, 33.8)でした。
サブグループ集団であるプラチナ製剤を含む化学療法に不適格な患者集団の解析は、治験実施計画書に記載されていませんが、評価資料として承認時に評価されたため掲載しています。
サブグループ解析 奏効率:ORR:CR+PR
プラチナ製剤を含む化学療法に不適格な患者におけるORR(サブグループ集団)

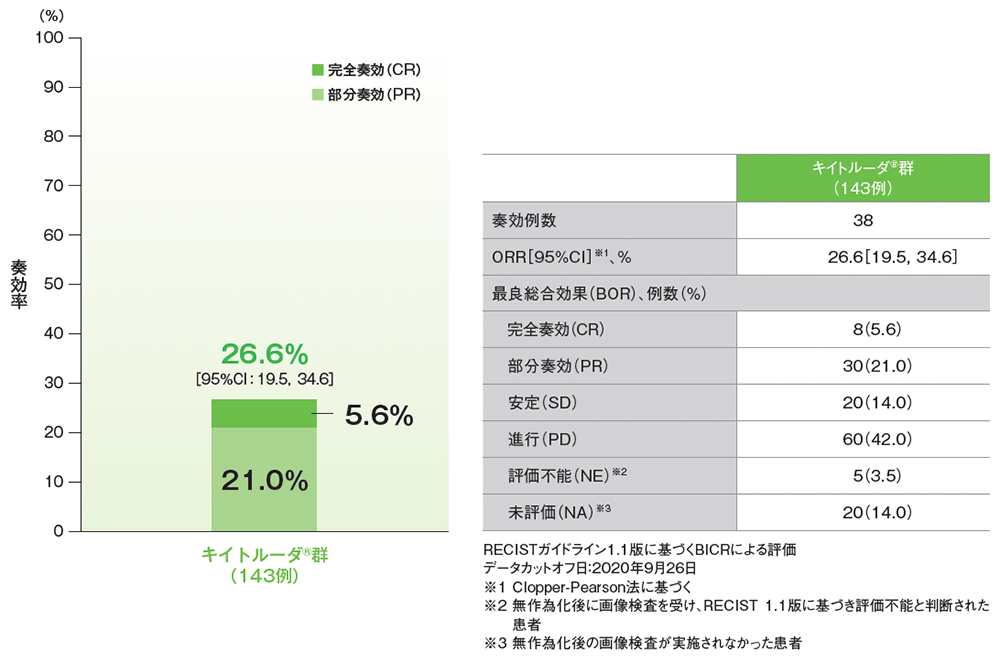
- 追跡期間中央値56.3ヵ月でのプラチナ製剤を含む化学療法に不適格な患者におけるORRは26.6%(95%CI: 19.5, 34.6)でした。
副次評価項目 奏効期間:DOR
シスプラチンを含む化学療法に不適格な患者におけるDORのKaplan-Meier曲線(APaT集団)

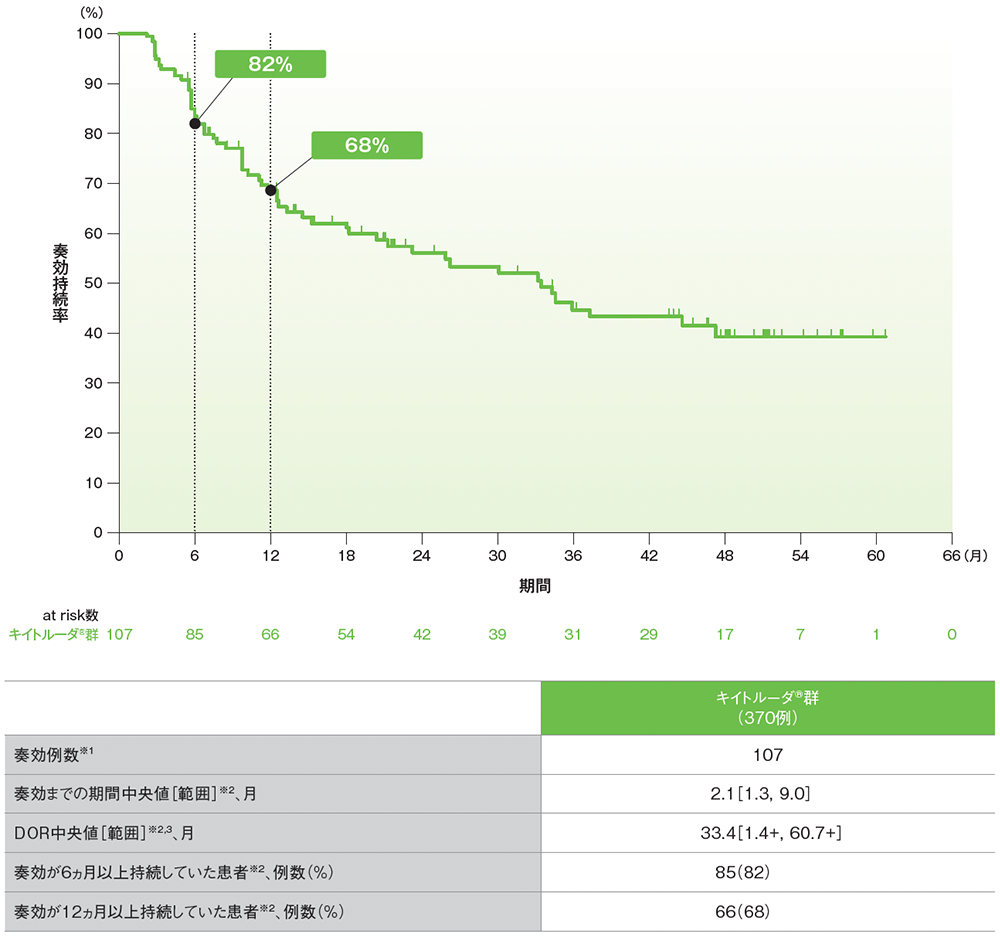
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2020年9月26日[追跡期間中央値:56.3ヵ月(範囲:51.2, 65.3)]
※1 CR又はPRが認められた患者数
※2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※3「+」は最後の疾患評価までにPDがみられなかったことを示す
- 追跡期間中央値56.3ヵ月でのDOR中央値は33.4ヵ月(範囲:1.4+, 60.7+)でした。
- 奏効が12ヵ月以上持続した割合は68%でした。
サブグループ解析 奏効期間:DOR
プラチナ製剤を含む化学療法に不適格な患者におけるDORのKaplan-Meier曲線(サブグループ集団)

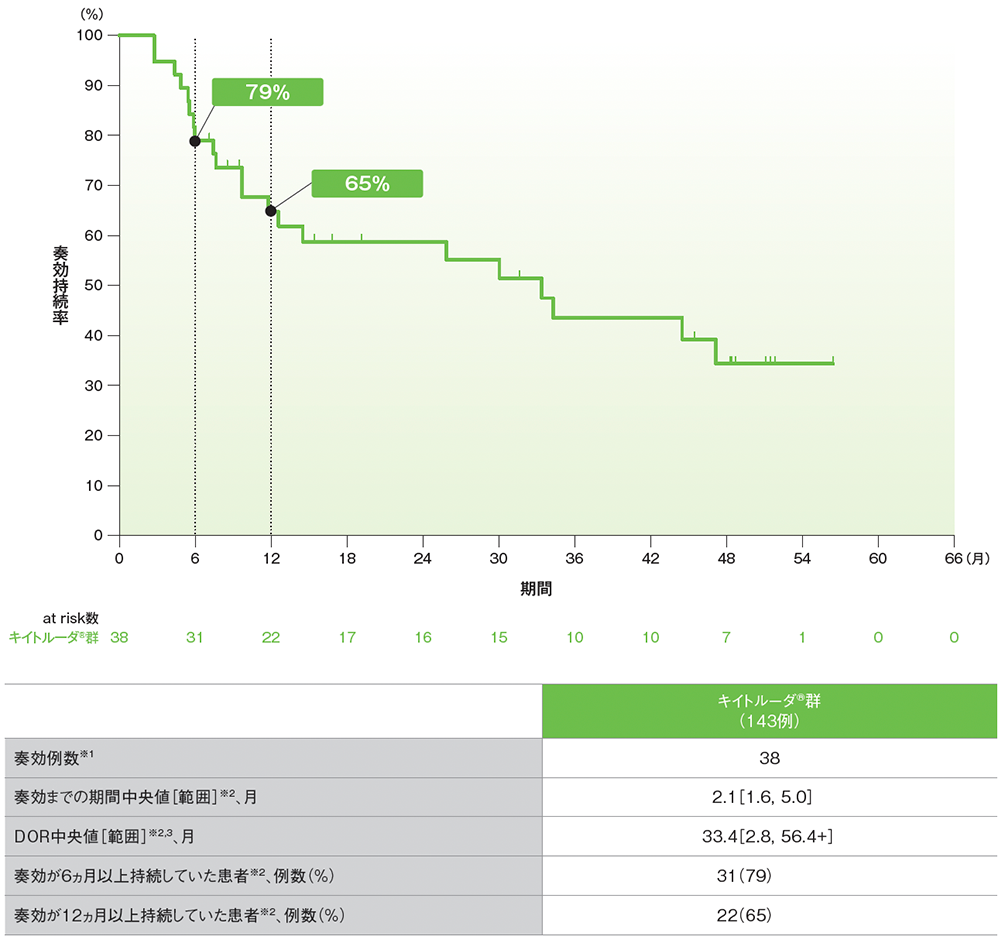
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2020年9月26日
※1 CR又はPRが認められた患者数
※2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※3 「+」は最後の疾患評価までにPDがみられなかったことを示す
- 追跡期間中央値56.3ヵ月でのプラチナ製剤を含む化学療法に不適格な患者におけるDOR中央値は33.4ヵ月(範囲:2.8, 56.4+)でした。
- 奏効が12ヵ月以上持続した割合は65%でした。
副次評価項目 無増悪生存期間:PFS
シスプラチンを含む化学療法に不適格な患者におけるPFSのKaplan-Meier曲線(APaT集団)

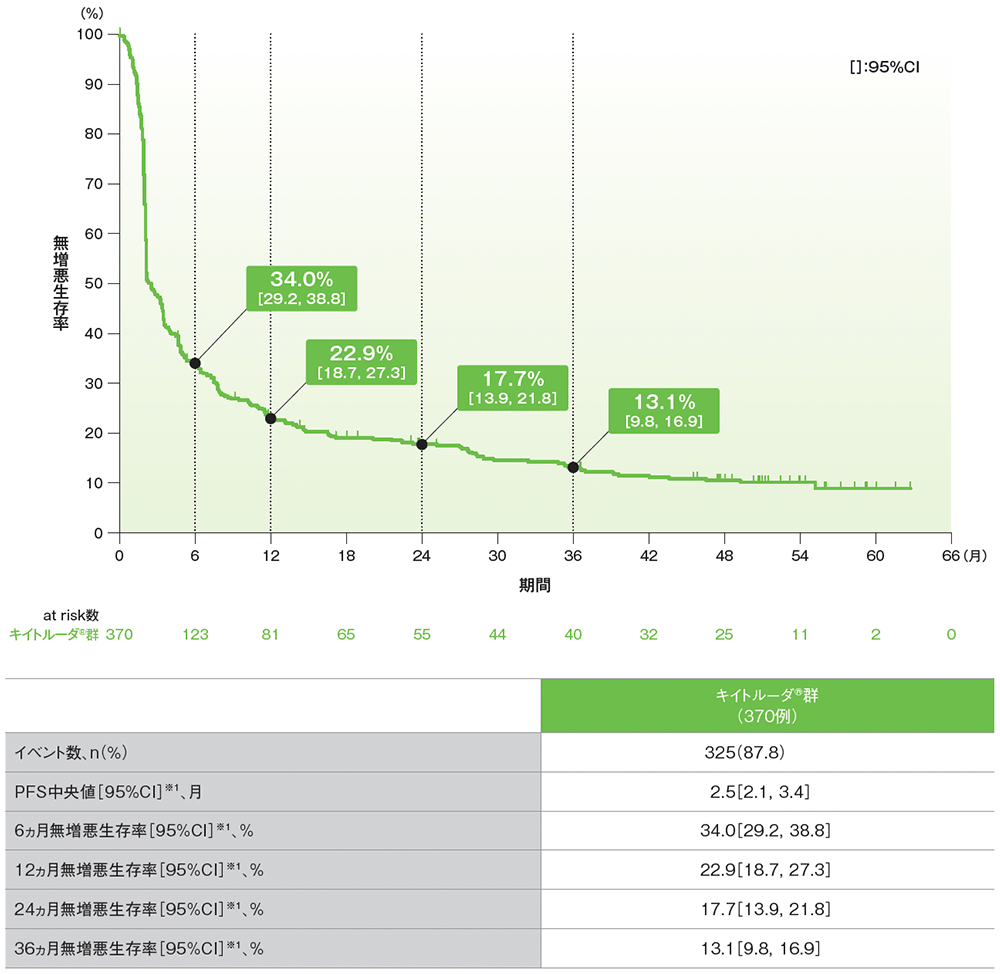
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2020年9月26日[追跡期間中央値:56.3ヵ月(範囲:51.2, 65.3)]
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
- 追跡期間中央値56.3ヵ月でのPFS中央値は2.5ヵ月(95%CI: 2.1, 3.4)でした。
サブグループ解析 無増悪生存期間:PFS
プラチナ製剤を含む化学療法に不適格な患者におけるPFSのKaplan-Meier曲線(サブグループ集団)

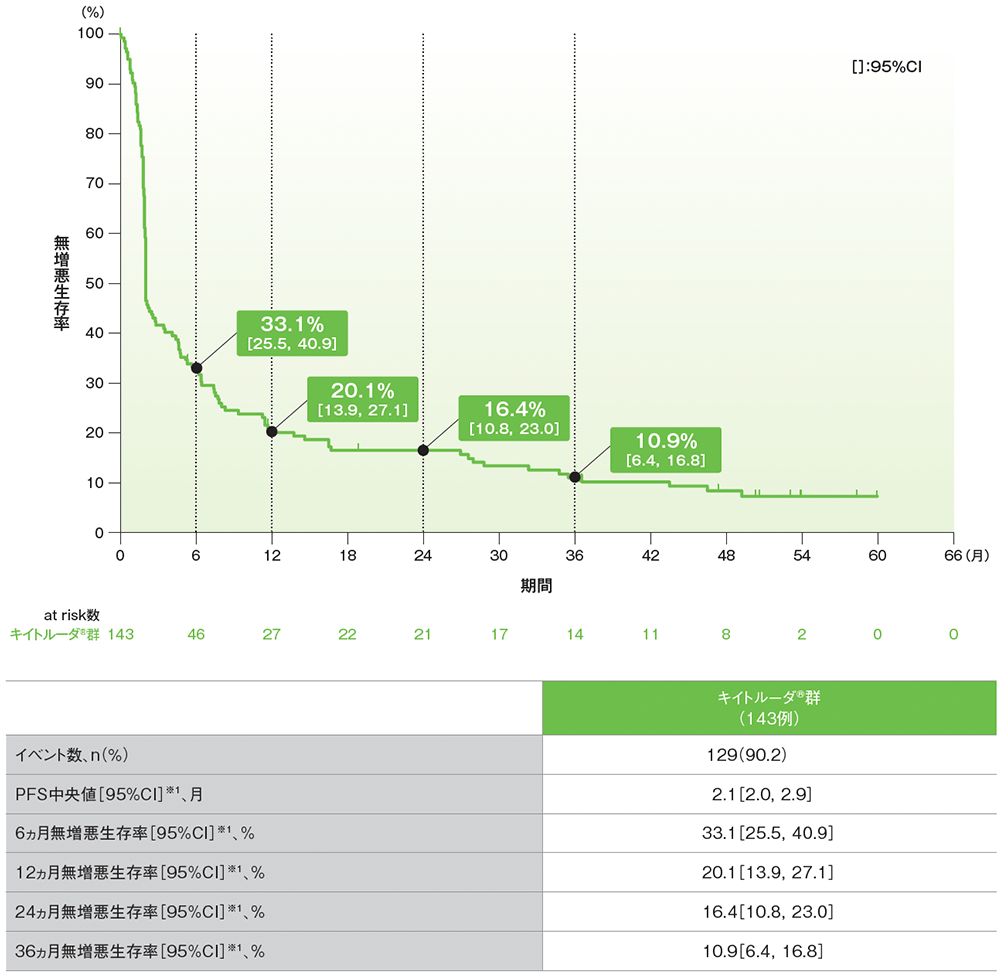
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2020年9月26日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
- 追跡期間中央値56.3ヵ月でのプラチナ製剤を含む化学療法に不適格な患者におけるPFS中央値は2.1ヵ月(95%CI: 2.0, 2.9)でした。
副次評価項目 全生存期間:OS
シスプラチンを含む化学療法に不適格な患者におけるOSのKaplan-Meier曲線(APaT集団)

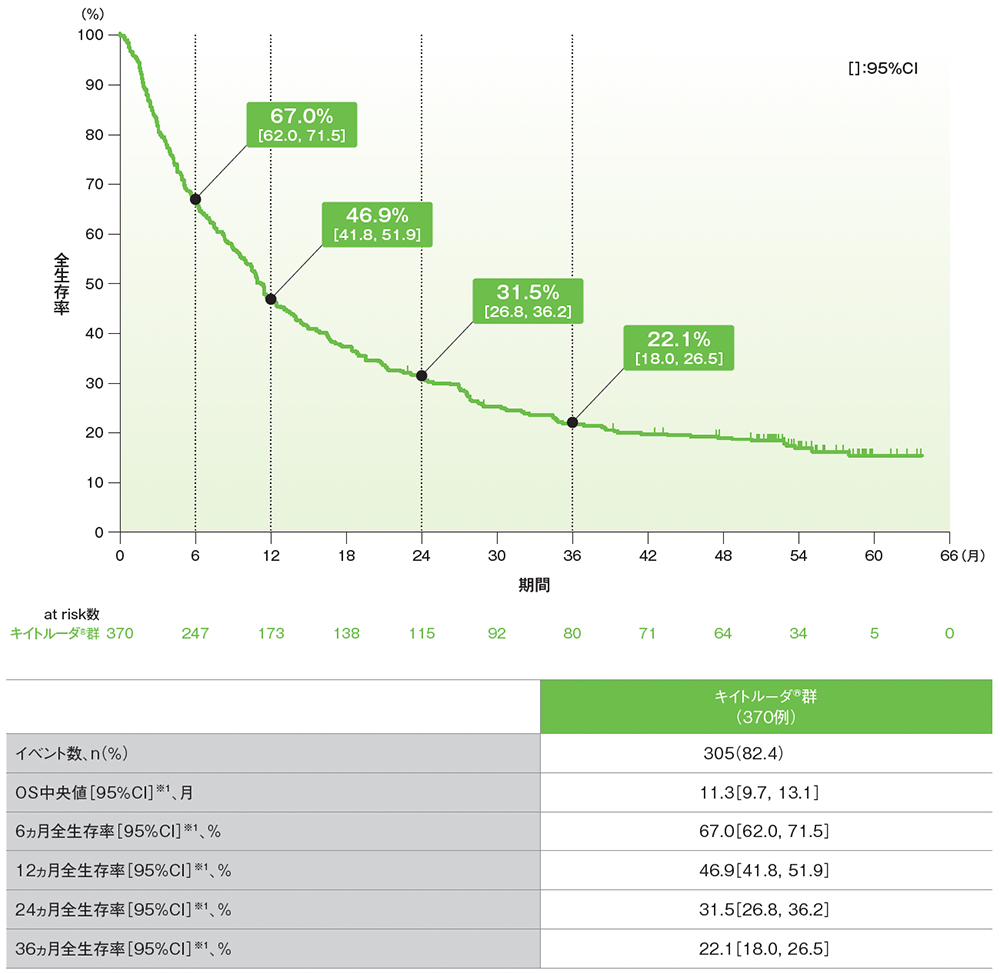
データカットオフ日:2020年9月26日[追跡期間中央値:56.3ヵ月(範囲:51.2, 65.3)]
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
- 追跡期間中央値56.3ヵ月でのOS中央値は11.3ヵ月(95%CI: 9.7, 13.1)でした。
サブグループ解析 全生存期間:OS
プラチナ製剤を含む化学療法に不適格な患者におけるOSのKaplan-Meier曲線(サブグループ集団)

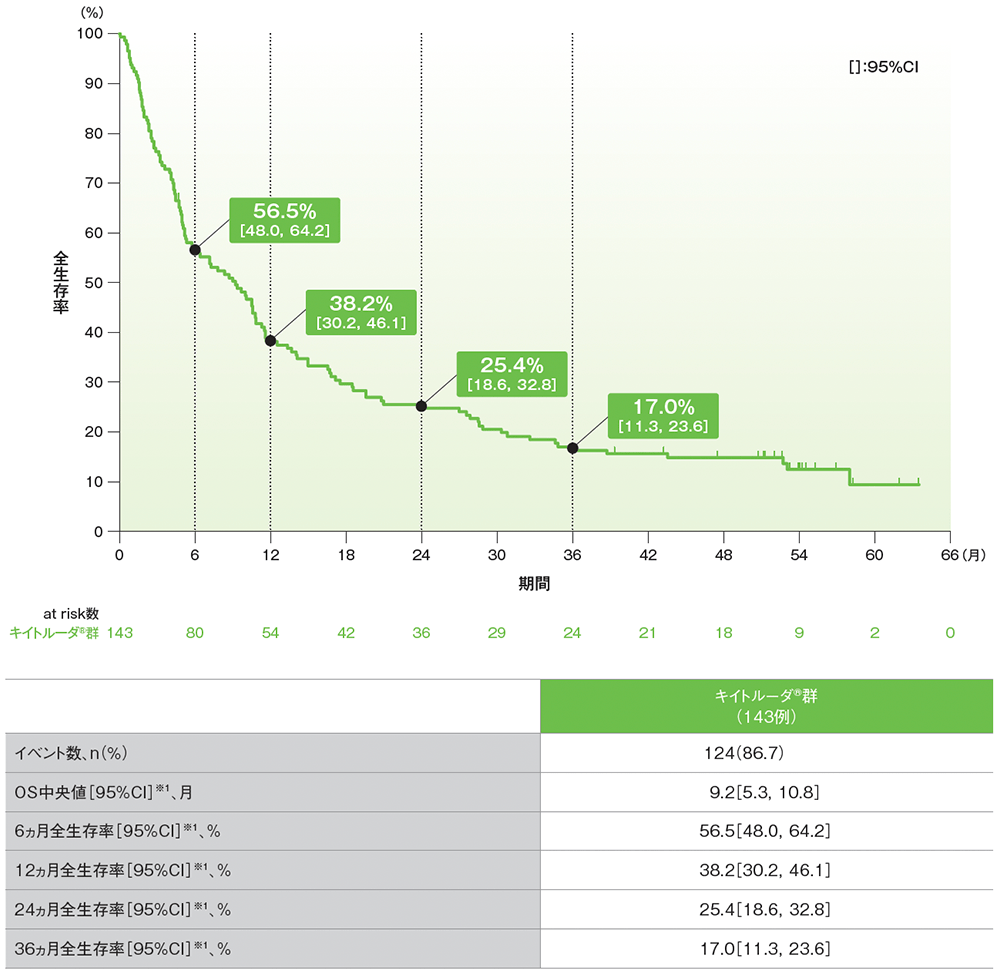
データカットオフ日:2020年9月26日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
- 追跡期間中央値56.3ヵ月でのプラチナ製剤を含む化学療法に不適格な患者におけるOS中央値は9.2ヵ月(95%CI: 5.3, 10.8)でした。
安全性
シスプラチンを含む化学療法に不適格な患者における副作用

キイトルーダ®群の副作用は249/370例(67.3%)に認められました。
主な副作用(発現割合5%以上)は、そう痒症68例(18.4%)、疲労67例(18.1%)、発疹45例(12.2%)、食欲減退40例(10.8%)、甲状腺機能低下症37例(10.0%)、下痢34例(9.2%)、悪心32例(8.6%)でした。
重篤な副作用は43例(11.6%)で認められました。 2例以上に認められた重篤な副作用は、肺臓炎5例(1.4%)、発熱3例(0.8%)、心筋炎、副腎機能不全、大腸炎、自己免疫性肝炎、肝炎、糖尿病性ケトアシドーシス、高カルシウム血症、1型糖尿病、関節炎、急性腎障害、尿細管間質性腎炎 各2例(0.5%)でした。
投与中止に至った副作用は35例(9.5%)に認められ、その内訳は肺臓炎6例(1.6%)、大腸炎4例(1.1%)、関節痛、尿細管間質性腎炎、そう痒症 各2例(0.5%)、心筋炎、アジソン病、下垂体炎、下垂体機能低下症、下痢、浮腫、自己免疫性肝炎、肝炎、肝損傷、アスパラギン酸アミノトランスフェラーゼ増加、血中ビリルビン増加、リパーゼ増加、トランスアミナーゼ上昇、体重減少、筋炎、自己免疫性ニューロパチー、急性腎障害、腎不全、発疹、脂漏性皮膚炎 各1例(0.3%)でした。
死亡に至った副作用は1例(0.3%)で、その内訳は筋炎1例(0.3%)でした。
シスプラチンを含む化学療法に不適格な患者における主な副作用(発現割合5%以上)
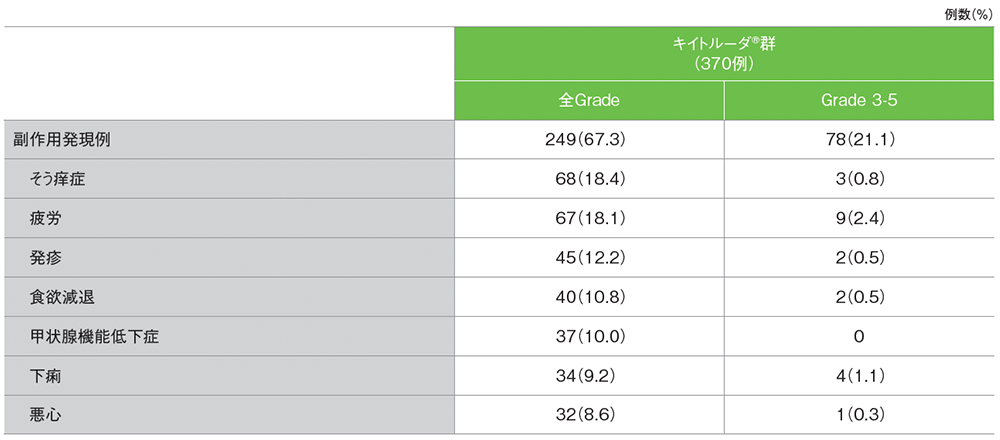
データカットオフ日:2020年9月26日[追跡期間中央値:56.3ヵ月(範囲:51.2, 65.3)]
GradeはCTCAE v4.0
MedDRA v23.1
免疫関連など特に注目すべき有害事象(APaT集団)
キイトルーダ®群の免疫関連など特に注目すべき有害事象は98/370例(26.5%)に認められました。主な免疫関連など特に注目すべき有害事象(発現率3%以上)は、甲状腺機能低下症42例(11.4%)、肺臓炎17例(4.6%)、甲状腺機能亢進症、大腸炎、重度の皮膚反応 各11例(3.0%)でした。
シスプラチンを含む化学療法に不適格な患者における免疫関連など特に注目すべき有害事象


データカットオフ日:2020年9月26日[追跡期間中央値:56.3ヵ月(範囲:51.2, 65.3)]
MedDRA v23.1
※ カテゴリー別で集計
キイトルーダ®の投与期間中は、以下の検査スケジュールを参考に患者さんの状態を観察してください。
キイトルーダ®200mgを3週間間隔で投与したKEYNOTE-052試験における検査スケジュール
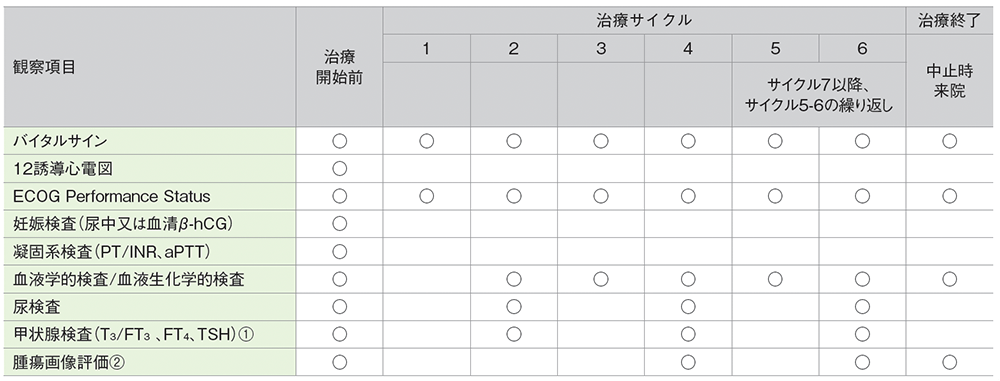
バイタルサイン:体温、脈拍、呼吸数、体重、血圧
妊娠検査:妊娠の可能性がある女性の場合に、治療開始前72時間以内に実施
血液学的検査:ヘマトクリット、ヘモグロビン、血小板数、白血球数、白血球分画、赤血球数、好中球絶対数、リンパ球絶対数
血液生化学的検査:総蛋白、アルブミン、ALT(GPT)、AST(GOT)、ALP、HCO3‒、総ビリルビン、直接ビリルビン、BUN、クレアチニン、尿酸、Na、K、Cl、Ca、P、血糖値
尿検査:潜血、糖、蛋白、比重、顕微鏡検査(異常値の場合)
①:6週毎 ②:9週以降6週毎、12ヵ月経過後は12週毎