1次治療:KEYNOTE-869試験/EV-103試験(海外データ)
海外第Ⅰb/Ⅱ相試験:KEYNOTE-869試験/EV-103試験(海外データ)
承認時評価資料:海外第Ⅰb/Ⅱ相試験(KEYNOTE-869試験/EV-103試験)
Hoimes CJ, et al. J Clin Oncol 2023; 41(1): 22-31
本試験はMSD社の資金提供により行われた。Christopher J. Hoimesは同社から顧問料等を受領している。
その他の著者に同社から顧問料等を受領している者が含まれる。著者のうち、Blanca Homet MorenoはMSD社の社員である。
O’Donnell PH et al. J Clin Oncol 2023; 41: 4107-4117
本試験はMSD社の資金提供により行われた。Peter H. O’Donnellは同社から謝礼金等を受領している。
その他の著者に同社から顧問料などを受領している者が含まれる。著者のうち、Blanca Homet MorenoはMSD社の社員である。
試験概要
【目的】
局所進行性又は転移性尿路上皮癌患者を対象としキイトルーダ®とエンホルツマブ ベドチン(EV)を併用投与した際の以下について評価・検討する。
用量漸増コホート:安全性及び忍容性の評価、用量制限毒性(DLT)の評価に基づくEVの推奨用量決定
拡大コホートA:安全性及び忍容性の評価、抗腫瘍効果の検討
無作為化コホートK:抗腫瘍効果の検討
【デザイン】
海外第Ⅰb/Ⅱ相試験[非盲検、マルチコホート]
データカットオフ日:2022年6月10日(追跡期間中央値:拡大コホートAで44.6ヵ月、無作為化コホートKのキイトルーダ®+EV併用群で14.8ヵ月、EV群で15.0ヵ月)
【対象】
用量漸増コホート:局所進行性又は転移性尿路上皮癌患者のうち、未治療かつシスプラチン不適格の患者(一次治療)又はプラチナ製剤を含む化学療法後に増悪した患者(二次治療)10例
拡大コホートA:未治療かつシスプラチン不適格の局所進行性又は転移性尿路上皮癌患者(一次治療)40例
無作為化コホートK:未治療かつシスプラチン不適格の局所進行性又は転移性尿路上皮癌患者(一次治療)151例
【方法】
用量漸増コホート:3+3デザインによる用量漸増法を用いて2用量のEV(1.00mg/kg、1.25mg/kg)とキイトルーダ®の併用療法のDLTを評価した。3週間を1サイクルとし、各サイクルの1日目及び8日目にEV 1.00mg/kg又は1.25mg/kgを投与し、1日目はEVの投与を終えてからキイトルーダ® 200mgを点滴静注した。
拡大コホートA:用量漸増コホートで決定したEVの推奨用量(1.25mg/kg)とキイトルーダ®を併用投与した際の有効性、並びに追加の安全性及び忍容性を評価した。3週間を1サイクルとし、各サイクルの1日目及び8日目にEV 1.25mg/kgを投与し、1日目はEVの投与を終えてからキイトルーダ® 200mgを点滴静注した。
無作為化コホートK:キイトルーダ®+EV併用群[3週間を1サイクルとし、各サイクルの1日目及び8日目にEV 1.25mg/kgを投与し、1日目はEVの投与を終えてからキイトルーダ® 200mgを点滴静注]、又はEV群[3週間を1サイクルとし、各サイクルの1日目及び8日目にEV 1.25mg/kgを点滴静注]に1:1の割合で無作為に割り付けた。無作為化に用いた層別因子は、肝転移(あり、なし)、ECOG PS(0、1-2)であった。
治験薬(キイトルーダ®及びEV)の投与は、投与中止基準に抵触するまで継続した。キイトルーダ®の投与は治験担当医師が患者に臨床的有用性及び忍容性があると判断した場合、RECISTガイドライン1.1版で定義された疾患進行後も継続可能とした。初回のCR(完全奏効)判定以降、2回以上のキイトルーダ®投与を含む2サイクル以上の治験薬の併用投与を受けた患者のうち、確定されたCRと判定され、かつ8サイクル(24週間)以上投与された患者は、キイトルーダ®の投与を中止可能とした。この場合、EVの投与は継続可能であった。キイトルーダ®は最大35サイクルまで投与可能とした。抗腫瘍効果判定はRECISTガイドライン1.1版に従い、初回投与後1年までは9週間毎に、その後は12週間毎に実施した。疾患進行の前に治験薬の投与を中止した患者には抗腫瘍効果判定を継続した。疾患進行が疑われる場合は画像検査を実施した。
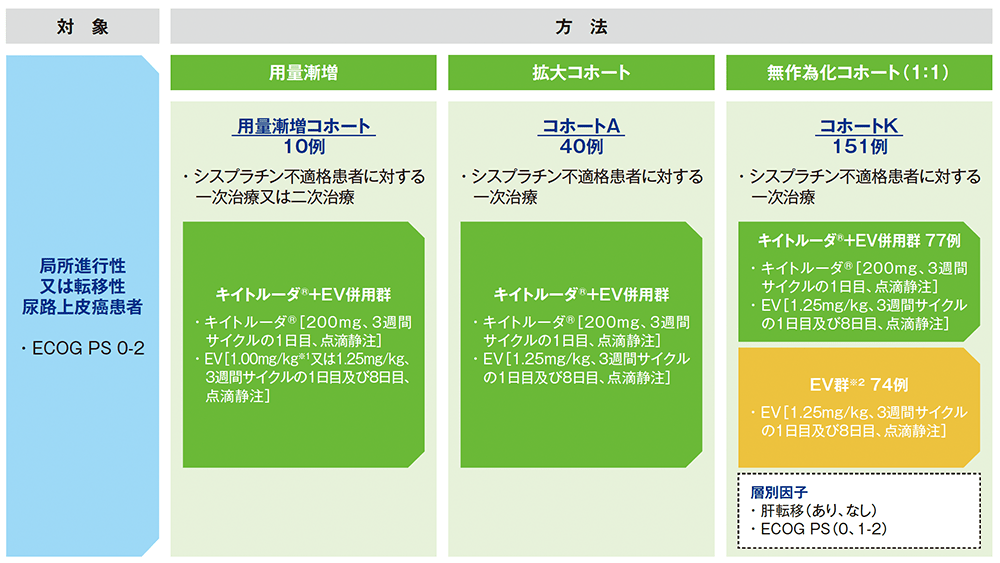
※1 電子添文では1.00mg/kgは1段階減量の投与量である
※2 EV単剤療法の、尿路上皮癌に対する一次治療での使用及び3週間サイクルの1日目及び8日目投与は国内適応外
【評価項目】
用量漸増コホート:【主要評価項目】 安全性及び忍容性 【副次評価項目】 DLT ※1など
拡大コホートA:【主要評価項目】 安全性及び忍容性 【副次評価項目】 奏効率(objective response rate; ORR)(BICR判定※2)など
無作為化コホートK:【主要評価項目】ORR(BICR判定※2) 【副次評価項目】安全性及び忍容性など
【判定基準】
用量漸増コホートのDLTは、投与1サイクル目(21日間)で評価した。DLTの定義は、評価期間中に発現した以下に示す有害事象のうち、EV、又はキイトルーダ®及びEVの両方と関連性ありと判定された場合とした。なお、有害事象の発現がキイトルーダ®のみと関連性ありと判定された場合はDLTとはみなさなかった。
- Grade 3以上の臨床的に重要な非血液学的有害事象
- Grade 3以上の発熱性好中球減少症
- 3日間を超えて持続するGrade 4の好中球減少症
- Grade 4の血小板減少症、又は出血を伴い医学的処置を要する及び/又は血小板輸血を要するGrade 3の血小板減少症
- 原疾患とは関係のないGrade 4の貧血
拡大コホートAの副次評価項目であるORR及び無作為化コホートKの主要評価項目であるORRは、RECISTガイドライン1.1版に基づきBICRの判定※2により評価した。
【解析計画】
解析対象集団:有効性はFAS集団※3、安全性はASaT集団※4、DLTはDLT評価解析対象集団※5を解析対象とした。
有効性評価の統計手法:拡大コホートA及び無作為化コホートKのORR(BICR判定※2)を計算し、95%信頼区間(95%CI)はClopper-Pearson法を用いて算出した。なお、無作為化コホートK において、2群間比較の正式な統計解析は実施しなかった。
※1 DLT(Dose Limiting Toxicity):用量制限毒性
※2 BICR(blinded independent central review):盲検下独立判定委員会
※3 FAS集団(Full Analysis Set):投与量に関わらず治験薬の投与を受けたすべての患者
※4 ASaT集団(all subjects as treated):投与量に関わらず治験薬の投与を受けたすべての患者
※5 DLT評価解析対象集団:各用量のサイクル1で想定される治験薬の投与量の75%以上が投与された患者のうち、DLT評価期間(最初の21日間)を完了した又はDLT評価期間中にDLTを認めたすべての患者
エンホルツマブ ベドチンの電子添文は以下のとおりです。
4. 効能又は効果 根治切除不能な尿路上皮癌
5. 効能又は効果に関連する注意(抜粋)
5.1 がん化学療法後に増悪した根治切除不能な尿路上皮癌に対して、本剤を単独で投与する場合には、臨床試験に組み入れられた患者の前治療歴等について、「17 .臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で適応患者の選択を行うこと。[17.1.1参照]
6. 用法及び用量
通常、成人には、エンホルツマブ ベドチン(遺伝子組換え)として1回1.25mg/kg(体重)を30分以上かけて点滴静注し、週1回投与を3週連続し、4週目は休薬する。これを1サイクルとして投与を繰り返す。ただし、1回量として125mgを超えないこと。なお、患者の状態により適宜減量する。
ペムブロリズマブ(遺伝子組換え)と併用する場合は、通常、成人には、エンホルツマブ ベドチン(遺伝子組換え)として1回1.25mg/kg(体重)を30分以上かけて点滴静注し、週1回投与を2週連続し、3週目は休薬する。これを1サイクルとして投与を繰り返す。ただし、1回量として125mgを超えないこと。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意(抜粋)
7.2 PD-1/PD-L1阻害剤による治療歴のない患者における本剤単独投与の有効性及び安全性は確立していない。
患者背景(FAS集団)
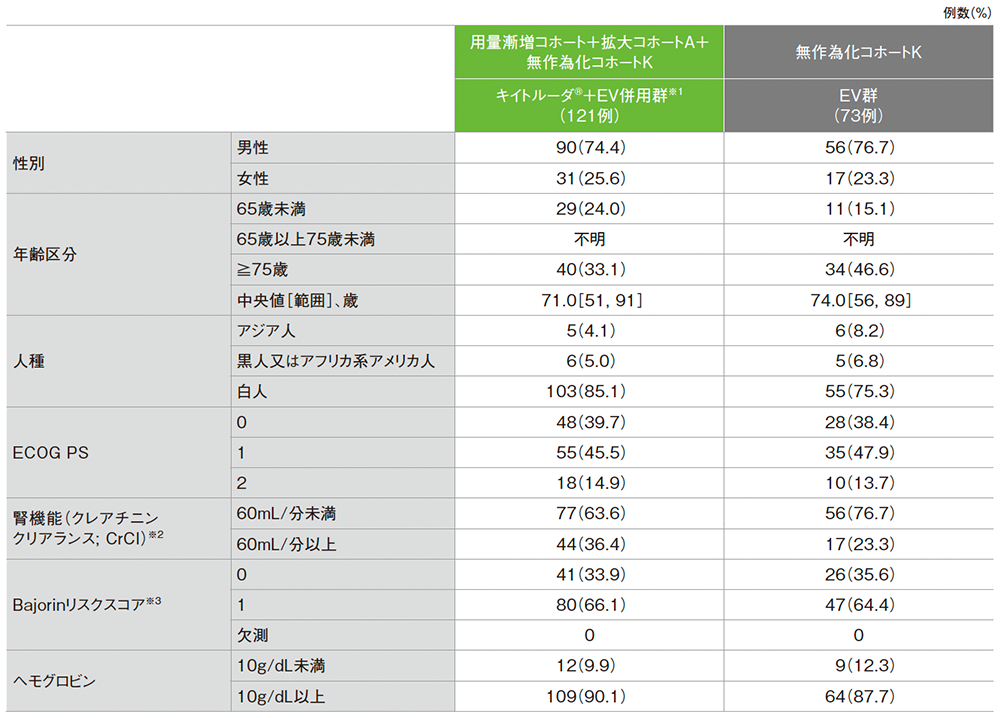
※1 一次治療としてキイトルーダ®とEV1.25mg/kgの併用投与を受けた患者(用量漸増コホート:5例、コホートA:40例、コホートK:76例)
※2 CrClは治験薬初回投与前の最後の欠測のない血清クレアチニン測定値に基づきCockcroft-Gault式を用いて推定した
※3 リスク因子には、内臓転移(骨、肺、又は肝臓)、ECOG PS>2を含む。本試験ではECOG PS>2の患者は対象とならなかった
主要評価項目[用量漸増コホート]
副作用の概要(ASaT集団)
副作用は10例中9例(90.0%)に認められました。Grade 3以上の副作用は10例中6例(60.0%)、重篤な副作用は10例中4例(40.0%)に認められました。
キイトルーダ®又はEVのいずれかの薬剤の投与中止に至った副作用は10例中2例(20.0%)、キイトルーダ®のみ投与中止に至った副作用は10例中1例(10.0%)、キイトルーダ®及びEVの両方の投与中止に至った副作用は10例中1例(10.0%)に認められました。
EVの減量に至った副作用は10例中2例(20.0%)に認められました。
用量漸増コホートにおいて、死亡に至った副作用は認められませんでした。
副次評価項目[用量漸増コホート]
DLT評価(DLT評価解析対象集団)
用量漸増コホートに組み入れられた10例のうち、DLT評価期間中に治験薬(キイトルーダ®+EV 1.25mg/kg)の投与を休薬した1例を除く合計9例(キイトルーダ®+EV 1.00mg/kg:3例又はキイトルーダ®+EV 1.25mg/kg:6例)でDLTを評価した結果、いずれの用量でもDLTはみられませんでした。
副次評価項目[拡大コホートA]/主要評価項目[無作為化コホートK]
奏効率(ORR:CR+PR)(FAS集団)
奏効率(ORR:CR+PR)(FAS集団)[拡大コホートA]
![ORR(ORR:CR+PR)(FAS集団)[拡大コホートA]](https://www.msdconnect.jp/wp-content/uploads/sites/5/2024/11/uroth-keynote-869_03.png?w=1000)
RECISTガイドライン1.1版に基づくBICRによる評価、データカットオフ日:2022年6月10日
※BORは最初の奏効から28日以上あけて評価した
奏効率(ORR:CR+PR)(FAS集団)[無作為化コホートK]
![ORR(ORR:CR+PR)(FAS集団)[無作為化コホートK]](https://www.msdconnect.jp/wp-content/uploads/sites/5/2024/11/uroth-keynote-869_04.png?w=1000)
RECISTガイドライン1.1版に基づくBICRによる評価、データカットオフ日:2022年6月10日
※BORは最初の奏効から28日以上あけて評価した
主要評価項目[拡大コホートA]/副次評価項目[無作為化コホートK]
安全性(ASaT集団)
●主な副作用※(ASaT集団)
■主な副作用(ASaT集団)[拡大コホートA]
副作用は40例中39例(97.5%)に認められました。発現割合30%以上のものは、末梢性感覚ニューロパチー24例(60.0%)、脱毛症21例(52.5%)、疲労20例(50.0%)、下痢18例(45.0%)、食欲減退15例(37.5%)、味覚不全、そう痒症 各14例(35.0%)、悪心、斑状丘疹状皮疹 各12例(30.0%)でした。
■主な副作用(ASaT集団)[無作為化コホートK]
キイトルーダ®+EV併用群では、副作用は76例中76例(100.0%)に認められました。発現割合30%以上のものは、疲労43例(56.6%)、末梢性感覚ニューロパチー39例(51.3%)、脱毛症、斑状丘疹状皮疹 各35例(46.1%)、そう痒症30例(39.5%)、味覚不全、体重減少 各23例(30.3%)でした。
EV群では、副作用は73例中68例(93.2%)に認められました。発現割合30%以上のものは、末梢性感覚ニューロパチー32例(43.8%)、疲労29例(39.7%)、食欲減退28例(38.4%)、脱毛症26例(35.6%)、味覚不全、悪心 各25例(34.2%)でした。
※ 一次治療としてキイトルーダ®200mgとEV1.25mg/kgを併用投与された121例(用量漸増コホート5例、拡大コホートA40例、無作為化コホートK76例)で発現割合5%以上の副作用を示した
MedDRA v24.0、データカットオフ日:2022年6月10日
主要評価項目[拡大コホートA]
安全性(ASaT集団)
●有害事象(ASaT集団)
■重篤な有害事象※
重篤な有害事象は19例(47.5%)に認められ、発現割合5%以上のものは、急性腎障害、尿路感染 各4例(10.0%)、尿路性敗血症、低血圧、譫妄 各2例(5.0%)でした。
■死亡に至った有害事象
死亡に至った有害事象は2例(5.0%)に認められ、その内訳は、心停止、多臓器機能不全症候群 各1例(2.5%)でした。なお、多臓器機能不全症候群の1例はキイトルーダ®及びEVの両治験薬と関連性ありと判断されました。
■投与中止に至った有害事象※
キイトルーダ®又はEVのいずれかの薬剤の投与中止に至った有害事象は20例(50.0%)に認められ、発現割合5%以上のものは、末梢性感覚ニューロパチー8例(20.0%)、末梢性運動ニューロパチー3例(7.5%)、肺臓炎、下痢 各2例(5.0%)でした。
EVのみ投与中止に至った有害事象は8例(20.0%)に認められ、発現割合5%以上のものは、末梢性感覚ニューロパチー4例(10.0%)、末梢性運動ニューロパチー2例(5.0%)でした。
キイトルーダ®のみ投与中止に至った有害事象は6例(15.0%)に認められ、発現割合5%以上のものは肺臓炎2例(5.0%)でした。
キイトルーダ®及びEVの両方で投与中止に至った有害事象は9例(22.5%)に認められ、発現割合5%以上のものは末梢性感覚ニューロパチー4例(10.0%)でした。
※ KEYNOTE-869試験/EV-103試験(用量漸増コホート、拡大コホートA及び無作為化コホートK)でキイトルーダ®+EV併用療法を受けた患者の1%超に発現した有害事象
MedDRA v24.0、データカットオフ日:2022年6月10日
副次評価項目[無作為化コホートK]
安全性(ASaT集団)
●有害事象(ASaT集団)
■重篤な有害事象※
キイトルーダ®+EV併用群では、重篤な有害事象は36例(47.4%)に認められ、発現割合5%以上のものは、急性腎障害、尿路感染、血尿、肺臓炎 各4例(5.3%)でした。
EV群では、重篤な有害事象は30例(41.1%)に認められ、発現割合5%以上のものは、急性腎障害6例(8.2%)、尿路感染5例(6.8%)でした。
■死亡に至った有害事象
キイトルーダ®+EV併用群では、死亡に至った有害事象は5例(6.6%)に認められ、その内訳は、水頭症、肺臓炎、呼吸不全、敗血症、敗血症性ショック 各1例(1.3%)でした。
なお、肺臓炎は両治験薬と関連性あり、呼吸不全はキイトルーダ®と関連性あり、敗血症はEVと関連性ありと判断されました。
EV群では、死亡に至った有害事象は5例(6.8%)に認められ、その内訳は、呼吸不全、敗血症、多臓器機能不全症候群、塞栓症、肺敗血症 各1例(1.4%)でした。
■投与中止に至った有害事象※
キイトルーダ®+EV併用群では、キイトルーダ®又はEVのいずれかの薬剤の投与中止に至った有害事象は38例(50.0%)に認められました。発現割合5%以上のものは、末梢性感覚ニューロパチー9例(11.8%)、斑状丘疹状皮疹6例(7.9%)、肺臓炎4例(5.3%)でした。
EVのみ投与中止に至った有害事象は19例(25.0%)に認められ、発現割合5%以上のものは、末梢性感覚ニューロパチー9例(11.8%)、斑状丘疹状皮疹4例(5.3%)でした。
キイトルーダ®のみ投与中止に至った有害事象は17例(22.4%)に認められ、発現割合3%以上のものは肺臓炎3例(3.9%)でした。
キイトルーダ®及びEVの投与中止に至った有害事象は6例(7.9%)に認められ、発現割合1%以上のものは、末梢性運動ニューロパチー1例(1.3%)でした。
EV群では、EVの投与中止に至った有害事象は18例(24.7%)に認められました。発現割合5%以上のものは、末梢性感覚ニューロパチー4例(5.5%)でした。
※ KEYNOTE-869試験/EV-103試験(用量漸増コホート、拡大コホートA及び無作為化コホートK)でキイトルーダ®+EV併用療法を受けた患者の1%超に発現した有害事象
MedDRA v24.0、データカットオフ日:2022年6月10日