1次治療:KEYNOTE-A39試験/EV-302試験
国際共同第Ⅲ相試験:KEYNOTE-A39試験/EV-302試験
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-A39試験/EV-302試験)
Powles T, et al. N Engl J Med. 2024; 390(10): 875-888
Powles T, et al. N Engl J Med. 2024; 390(10): 875-888(supplementary appendix)
本試験はMSD社の資金提供により行われた。T.B. Powlesは同社から顧問料等を受領している。その他の著者に同社から顧問料等を受領している者が含まれる。著者のうち、B. Homet Morenoは同社の社員である。
試験概要
【目的】
未治療の局所進行性又は転移性尿路上皮癌患者を対象にプラチナ製剤を含む化学療法(ゲムシタビン及びシスプラチン又はカルボプラチン)に対するキイトルーダ®とEV併用療法の有効性及び安全性を比較検討する。
【デザイン】
国際共同無作為化非盲検第Ⅲ相試験[優越性検証試験]
解析時点1[データカットオフ日:2023年8月8日(追跡期間中央値:17.2ヵ月)]
【対象】
未治療の根治切除不能な局所進行性又は転移性尿路上皮癌患者886例(日本人患者40例を含む)
【方法】
キイトルーダ®とEV併用群[以下、キイトルーダ®+EV併用群:3週間を1サイクルとし、各サイクルの1日目及び8日目にEV1.25mg/kgを投与し、1日目はEVの投与を終えてからキイトルーダ® 200mgを点滴静注]又はプラチナ製剤を含む化学療法群[以下、化学療法群:3週間を1サイクルとし、各サイクルの1日目及び8日目にゲムシタビン1000mg/m2及び1日目にシスプラチン70mg/m2又はカルボプラチン※1(AUC 4.5又はAUC 5に相当する量、各国のガイドラインに従う)を点滴静注]に1:1の割合で無作為に割り付けた。キイトルーダ®は最大35サイクル、化学療法は最大6サイクルまで投与可能とし、EVの投与サイクル数には上限を設けず、疾患進行又は許容できない有害事象が認められるまで継続した。また、化学療法の終了及び/又は中止後に維持療法(アベルマブ等)の開始を可能とした。画像診断は、原則として無作為割り付けから18ヵ月後までは9週間(±1週間)毎に、その後は12週間(±1週間)毎に実施した。
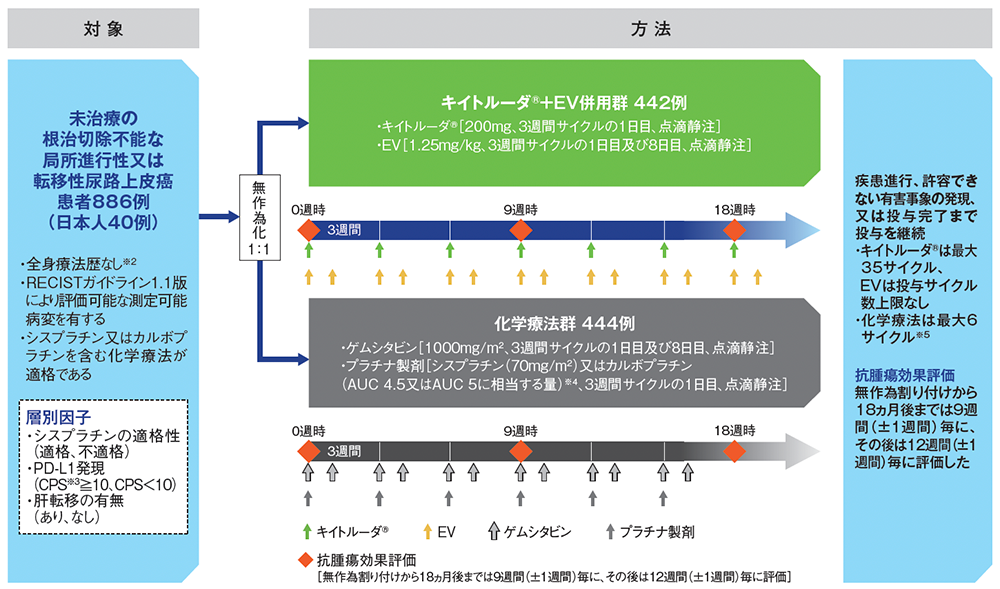
※1 カルボプラチンの尿路上皮癌への使用は国内適応外
※2 術前又は術後補助化学療法が行われた場合は、終了後12ヵ月超を経過した後に再発した患者が対象とされた
※3 CPS(combined positive score):PD-L1発現陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた数値
※4 カルボプラチンの投与量は各国のガイドラインに従った
※5 化学療法後の維持療法としてアベルマブ等の投与を許容した
【評価項目】
主要評価項目:無増悪生存期間(progression free survival:PFS)#、全生存期間(overall survival:OS)#
副次評価項目:奏効率(objective response rate:ORR)、奏効期間(duration of response:DOR)、病勢コントロール率(disease control rate:DCR)、安全性、痛みの増悪までの期間(time to pain progression:TTPP)、26週目の最も強い痛みにおけるベースラインからの平均変化量、健康関連QOLに関する患者報告アウトカム(patient reported outcome:PRO)など
# 検証的解析項目
【判定基準】
主要評価項目のPFS、及び副次評価項目のORR、DOR、DCRは、RECISTガイドライン1.1版に基づき盲検下の独立判定委員会(blinded independent central review:BICR)の判定により評価した。TTPPはBPI-SF質問3(最も強い痛み)及び質問7(痛みに使用した薬剤)、 26週目の最も強い痛みにおけるベースラインからの平均変化量はBPI-SF質問3を用いて評価した。PROはEORTC QLQ-C30、EQ-5D-5Lの平均値及びベースラインからの変化量を評価した。
【解析計画】
解析対象集団:PFS、OSの主要解析はITT集団※1、ORR、DOR、DCRの主要解析は奏効評価対象集団※2、安全性の解析はASaT集団※3、PROの解析はPRO解析対象集団※4を対象として実施した。
有効性評価の統計手法:PFS、OSの生存曲線及び中央値はKaplan-Meier法を用いて推定し、95%信頼区間(95% CI)は二重対数変換に基づき算出した。PFS、OSは層別ログランク検定を用いて群間を比較した。PFS、OSのハザード比(HR)及び95%CIは投与群を共変量とした層別Cox比例ハザードモデルを用いて算出した。ORRは層別Cochran-Mantel-Haenszel(CMH)検定を用いて群間を比較し、ORRの95%CIはClopper-Pearson法を用いて算出した。DOR中央値はKaplan-Meier法を用いて推定し、95%CIは二重対数変換を用いて算出した。無作為化に用いた層別因子[シスプラチンの適格性※5(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を解析の層別因子とした。
PFS、OS、ORRのサブグループ解析は、無作為化に用いた層別因子及びベースライン時の背景因子[年齢(<65歳、≧65歳)、人種(白人、その他)、地域(北米、欧州、その他)、性別(男性、女性)、ECOG PS(0、1-2)、原発部位(上部尿路、下部尿路)、転移部位(内臓転移、リンパ節のみ)、腎機能※6(正常、軽度低下、中等度低下、重度低下)]を対象とした。本サブグループ解析は、投与群を共変量として無作為化に用いた層別因子による層別Cox比例ハザードモデルを用いた。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した。十分な例数がいない場合、2つ以上のサブグループ変数を併合することとした。日本人集団については、治験実施計画書に記載されていないが、PFS、OS、ORR、DORを算出し、評価資料として申請時に評価された。
PRO評価の統計手法:TTPPのHR及び95%CIは無作為化に用いた層別因子及び年齢、性別、地域で調整したCox比例ハザードモデルを用い計算し、層別ログランク検定を用いて群間を比較した。26週目の最も強い痛みにおけるベースラインからの変化量は、反復測定混合モデル(MMRM法)を用いて、各群の平均値及び平均値の群間差を推定した。MMRM法として時点(週)、ベースライン時の因子(年齢、性別、地域、最大疼痛スコア、オピオイド鎮痛薬の使用、無作為化に用いた層別因子)、及び投与と時点の交互作用で調整し、分散構造としてunstructuredを用いた。EORTC QLQ-C30、EQ-5D-5L及びBPI-SFについて、実測値及びベースラインからの変化量の要約統計量を算出した。
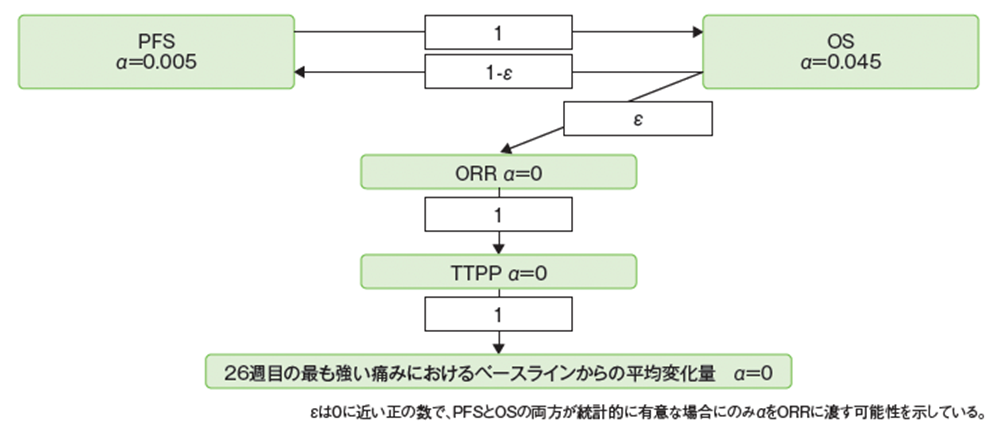
多重性の調整:本試験では2回の解析を事前に計画し、解析時点1でPFSの最終解析及びOSの中間解析、解析時点2でOSの最終解析を実施することとした。Maurer & Bretzの群逐次型のグラフィカルアプローチにより、OS、PFS、ORR、TTPP、26週目の最も強い痛みにおけるベースラインからの平均変化量に関連する複数の仮説について、全体の有意水準(α)を両側5%に厳密に制御した。主要評価項目であるPFSとOSの最初の有意水準の割り当ては、それぞれ0.5%と4.5%とした。ある主要評価項目が指定された水準で統計的に有意である場合、有意水準を再利用し、もう一方の主要評価項目は5%の有意水準で評価することとした。OSの中間解析と最終解析の有効性の境界値は、Lan-DeMetsの消費関数により計算したO‘Brien-Fleming型の境界値に従って決定することとした。主要評価項目のPFS及びOSの帰無仮説がともに棄却された場合、ゲートキーピング法により、BICR判定によるORR→TTPP→26週目の最も強い痛みにおけるベースラインからの平均変化量の順に検定することとした。各検定は、先行するすべての帰無仮説が棄却される限り、有意水準を両側5%とした。
※1 ITT集団(intention to treat):無作為化されたすべての患者
※2 奏効評価対象集団:ベースライン時にRECISTガイドライン1.1版に基づく測定可能な病変を有する無作為化されたすべての患者
※3 ASaT集団(all subjects as treated):治験薬(又は併用療法のいずれかの薬剤)を1回以上投与された無作為化されたすべての患者
※4 PRO解析対象集団(patient reported outcomes full analysis set):治験薬投与を1回以上受け、1回以上の患者アンケート(PRO)の評価を実施したすべての患者
※5 以下の基準のうち1つ以上を満たす場合、シスプラチン不適格とみなし、カルボプラチンを投与する
①30≦GFR<60mL/分(Cockcroft-Gault式、MDRD式、又は24時間蓄尿による測定)GFR≧50mL/分で他のシスプラチン不適格基準に該当しない者は、治験担当医師の臨床的判断に基づきシスプラチン適格とみなされる場合がある、②ECOG PS又はWHOのPSが2、③NCI CTCAE Grade 2以上の聴力低下、④NYHAクラスⅢの心不全
※6 腎機能(CrCL)は、初回投与前の血清クレアチニン値に基づいて、Cockcroft-Gault式で推定された
正常:90mL/分≦CrCL、軽度低下:60mL/分≦CrCL<90mL/分、中等度低下:30mL/分≦CrCL<60mL/分、重度低下:15mL/分≦CrCL<30mL/分
ゲムシタビン塩酸塩の用法及び用量は以下のとおりです。
6. 用法及び用量(抜粋)〈尿路上皮癌〉
通常、成人にはゲムシタビンとして1回1000mg/m2を30分かけて点滴静注し、週1回投与を3週連続し、4週目は休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
シスプラチンの効能又は効果、用法及び用量は以下のとおりです。
4. 効能又は効果(抜粋)
○シスプラチン通常療法
睾丸腫瘍、膀胱癌、腎盂・尿管腫瘍、前立腺癌、卵巣癌、頭頸部癌、非小細胞肺癌、食道癌、子宮頸癌、神経芽細胞腫、胃癌、小細胞肺癌、骨肉腫、胚細胞腫瘍(精巣腫瘍、卵巣腫瘍、性腺外腫瘍)、悪性胸膜中皮腫、胆道癌
以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
悪性骨腫瘍、子宮体癌(術後化学療法、転移・再発時化学療法)、再発・難治性悪性リンパ腫、小児悪性固形腫瘍(横紋筋肉腫、神経芽腫、肝芽腫その他肝原発悪性腫瘍、髄芽腫等)
6. 用法及び用量(抜粋)
〈シスプラチン通常療法〉
(1)睾丸腫瘍、膀胱癌、腎盂・尿管腫瘍、前立腺癌には、A法を標準的用法・用量とし、患者の状態によりC法を選択する。
A法:シスプラチンとして15~20mg/m2(体表面積)を1日1回、5日間連続投与し、少なくとも2週間休薬する。これを1クールとし、投与を繰り返す。
C法:シスプラチンとして25~35mg/m2(体表面積)を1日1回投与し、少なくとも1週間休薬する。これを1クールとし、投与を繰り返す。
カルボプラチンの効能又は効果は以下のとおりです。
4. 効能又は効果(抜粋)
○頭頸部癌、肺小細胞癌、睾丸腫瘍、卵巣癌、子宮頸癌、悪性リンパ腫、非小細胞肺癌、乳癌
○ 以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
小児悪性固形腫瘍(神経芽腫・網膜芽腫・肝芽腫・中枢神経系胚細胞腫瘍、再発又は難治性のユーイング肉腫ファミリー腫瘍・腎芽腫)
患者背景(ITT集団)
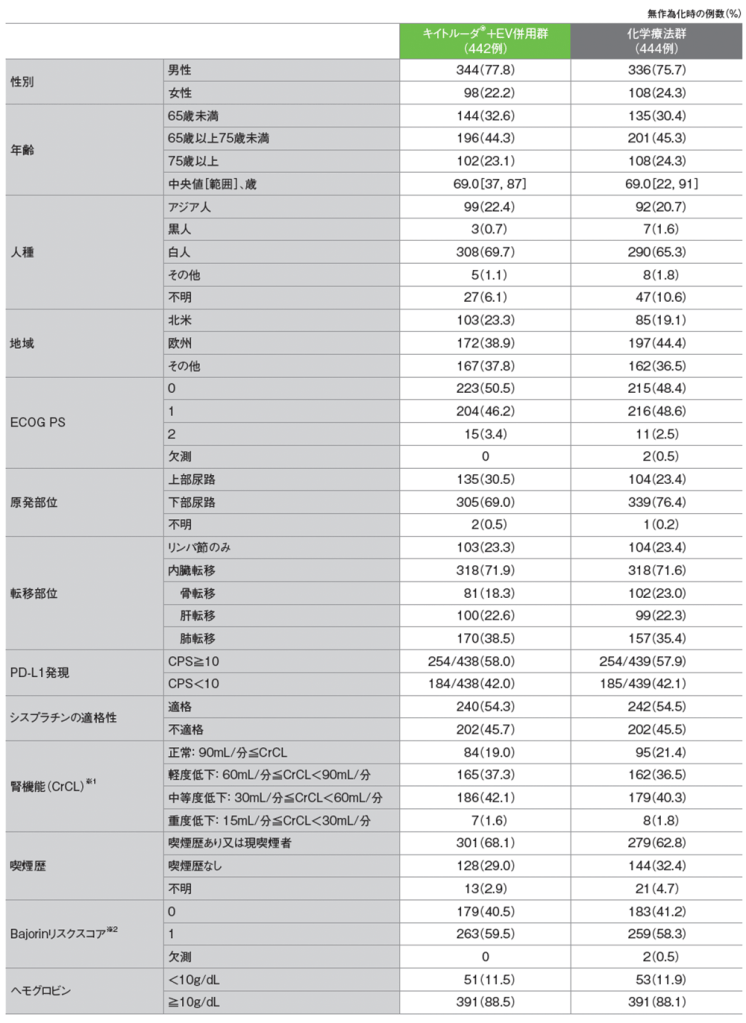
※1 CrCL(クレアチニンクリアランス)は、初回投与前の血清クレアチニン値に基づいて、Cockcroft-Gault式で推定された
※2 リスク因子には、内臓転移(骨、肺、肝臓)及びECOG PS>2を含む。ただし、本試験ではECOG PS>2の患者は対象とならなかった
患者の内訳
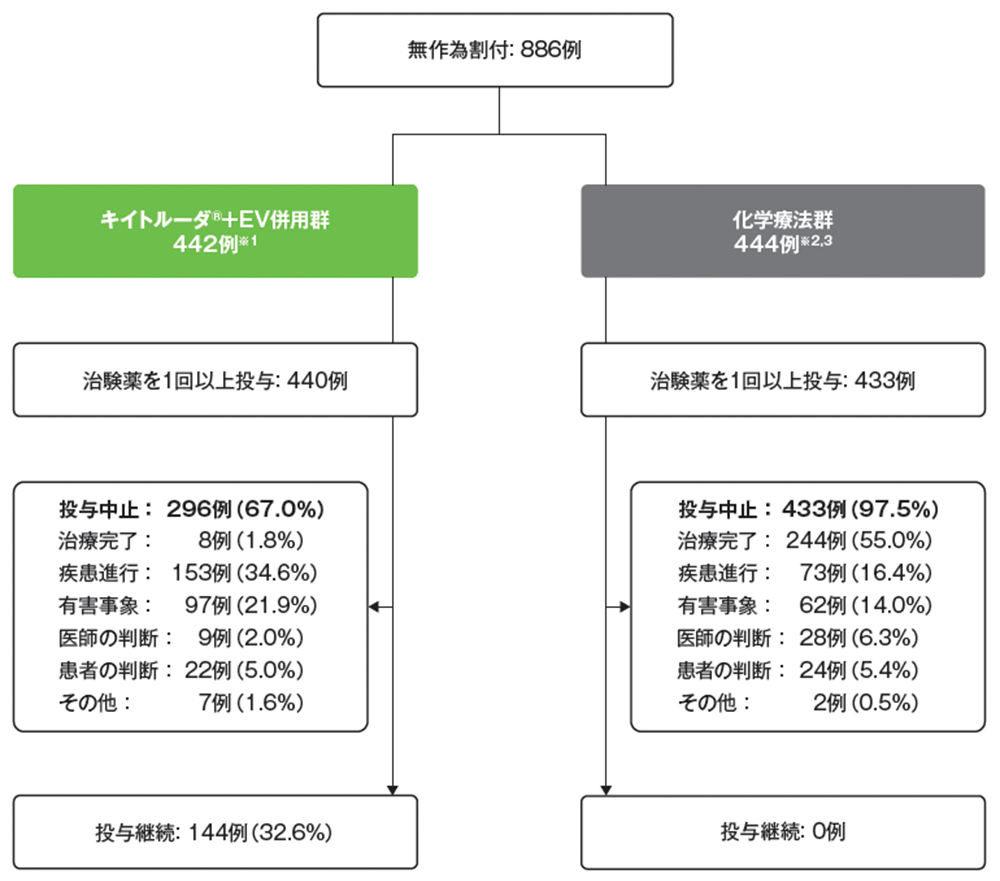
データカットオフ日: 2023年8月8日
※1 キイトルーダ®+EV併用群に割り付けられた患者のうち2例は、誤って割り付けられた(1例)、黄疸性胆汁うっ滞(Grade 3)及び重度の血小板減少症(1例)の理由から治験薬の投与を受けなかった
※2 化学療法群に割り付けられた患者のうち11例は、クレアチニンクリアランスのガイドラインを満たしていなかった(1例)、誤って割り付けられた(1例)、医師の判断(1例)、疾患進行(1例)、同意撤回(7例)の理由から治験薬の投与を受けなかった
※3 シスプラチン適格患者234例の内訳は、最初のサイクルでシスプラチン投与を受けた患者が220例(94.0%)、カルボプラチン投与を受けた患者が8例、治療を受けなかった患者が6例であった
シスプラチン不適格患者210例の内訳は、最初のサイクルでカルボプラチン投与を受けた患者が205例(97.6%)、治療を受けなかった患者が5例であった
主要評価項目 無増悪生存期間(PFS)【検証的解析結果】

PFSのKaplan-Meier曲線(ITT集団)
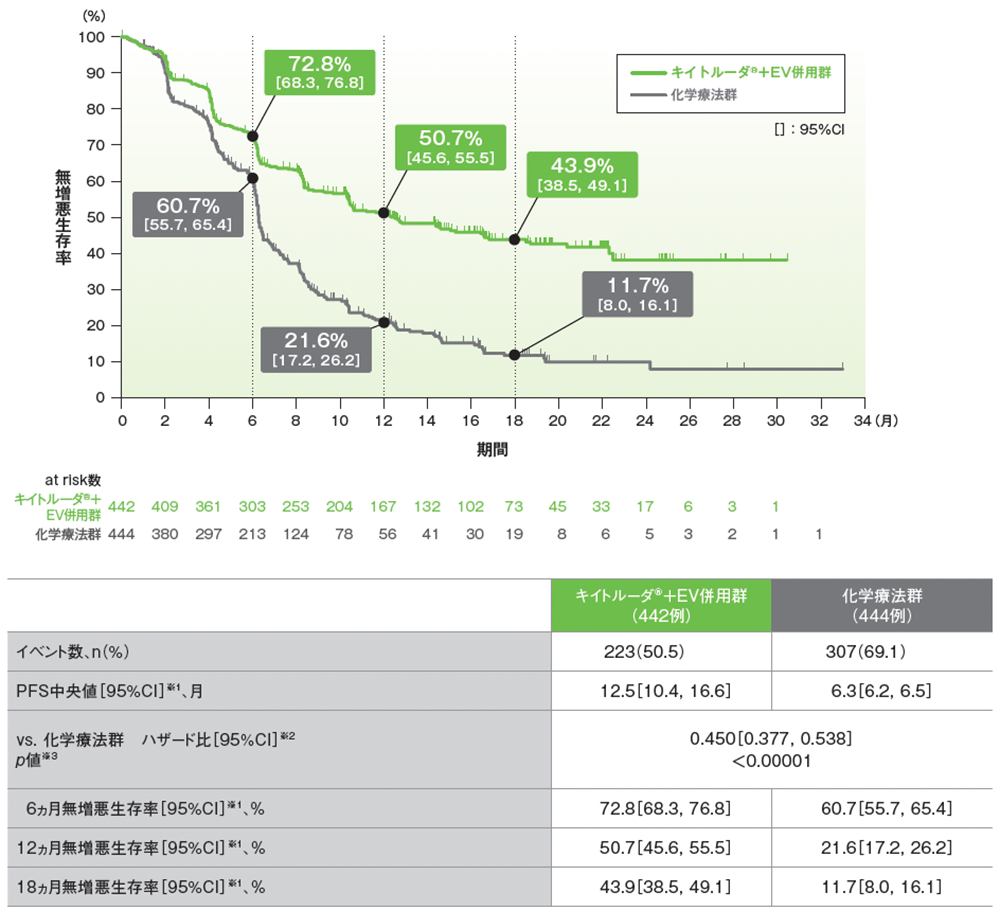
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年8月8日
※1 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく
※3 無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別ログランク検定[両側]、有意水準α=0.005; 検証的解析結果
- 追跡期間中央値17.2ヵ月において、キイトルーダ®+EV併用群は、化学療法群に対してPFSを有意に延長しました(ハザード比: 0.450[95%CI: 0.377, 0.538]、p<0.00001、層別ログランク検定[両側]、有意水準α=0.005; 検証的解析結果)。
- PFS中央値は、キイトルーダ®+EV併用群で12.5ヵ月(95%CI: 10.4, 16.6)、化学療法群で6.3ヵ月(95%CI: 6.2, 6.5)でした。
サブグループ解析 無増悪生存期間(PFS)

PFSのハザード比のフォレストプロット(ITT集団)
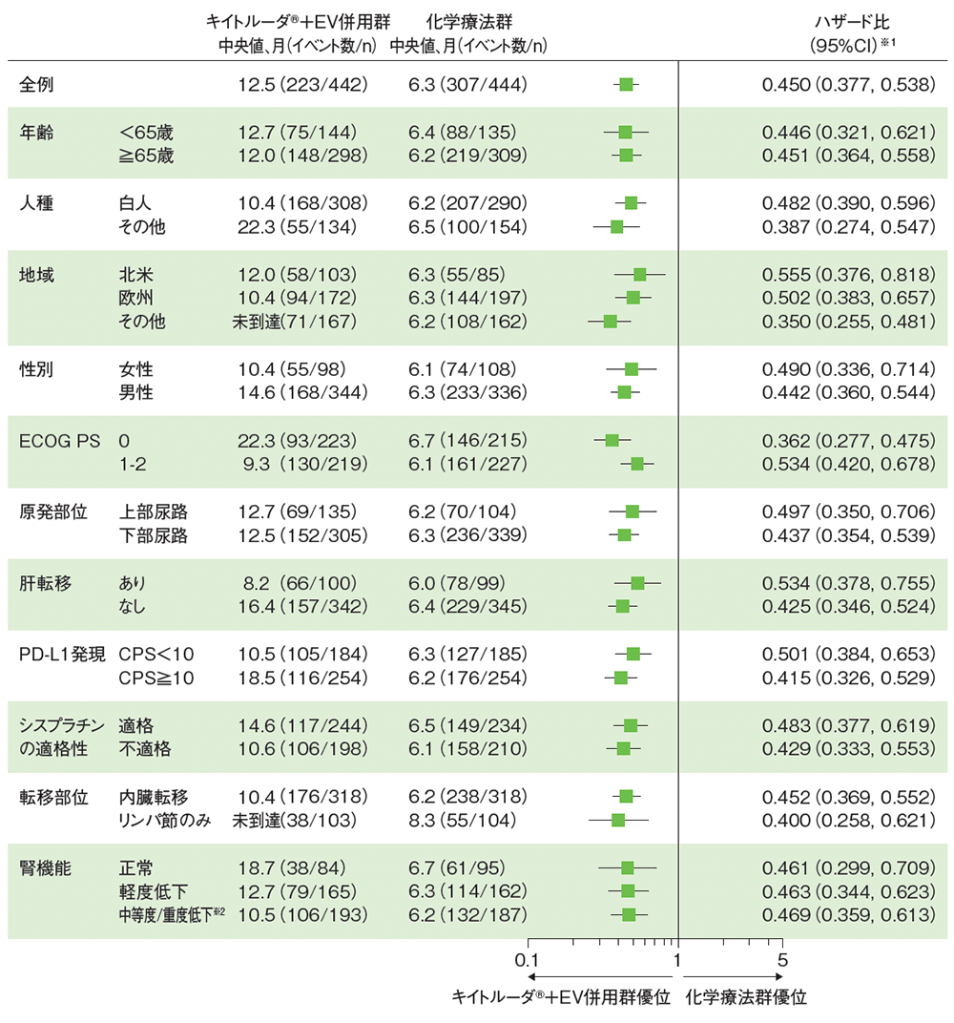
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年8月8日
シスプラチン適格性及び肝転移の有無のサブグループは、無作為化補正後のCRF(case report form)に基づく
PD-L1発現のサブグループは、QC(quality control)後の検査結果に基づく
※1 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した
※2 十分な例数がいない場合、2つ以上のサブグループ変数を併合することが規定された
サブグループ解析 シスプラチン適格性別の無増悪生存期間(PFS)

シスプラチン適格患者におけるPFSのKaplan-Meier曲線
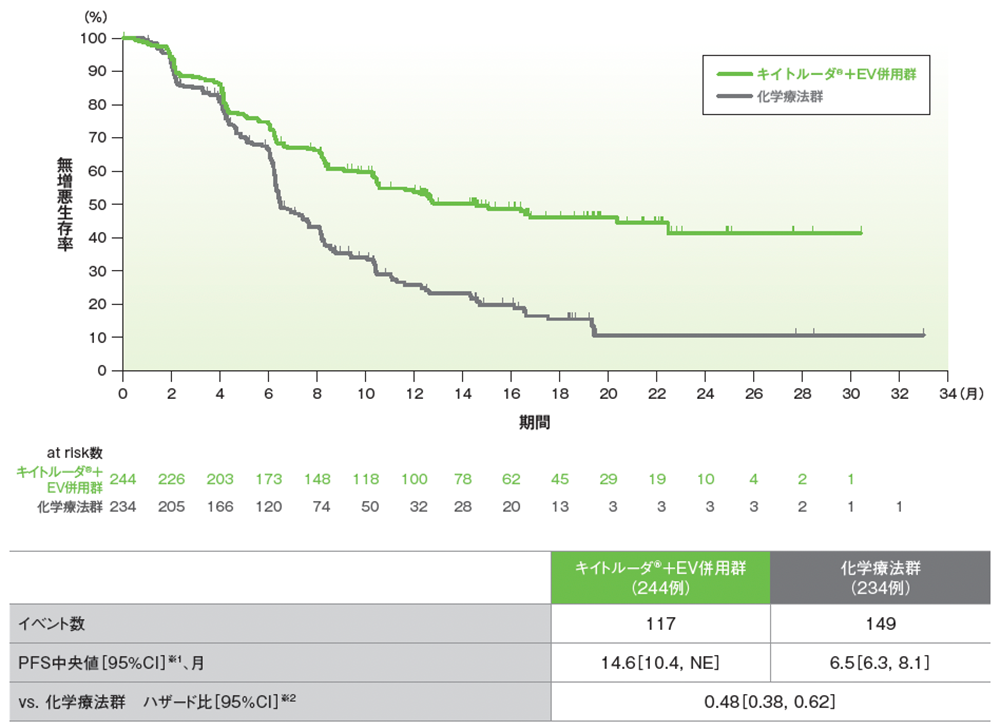
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年8月8日
※1 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した
Powles T, et al. N Engl J Med. 2024; 390(10): 875-888(supplementary appendix)
Adapted with permission from The New England Journal of Medicine, Powles T, et al, Enfortumab Vedotin and Pembrolizumab in Untreated Advanced Urothelial Cancer, 390(10), 875-888. Copyright © 2024 Massachusetts Medical Society. Translated with permission.

シスプラチン不適格患者におけるPFSのKaplan-Meier曲線
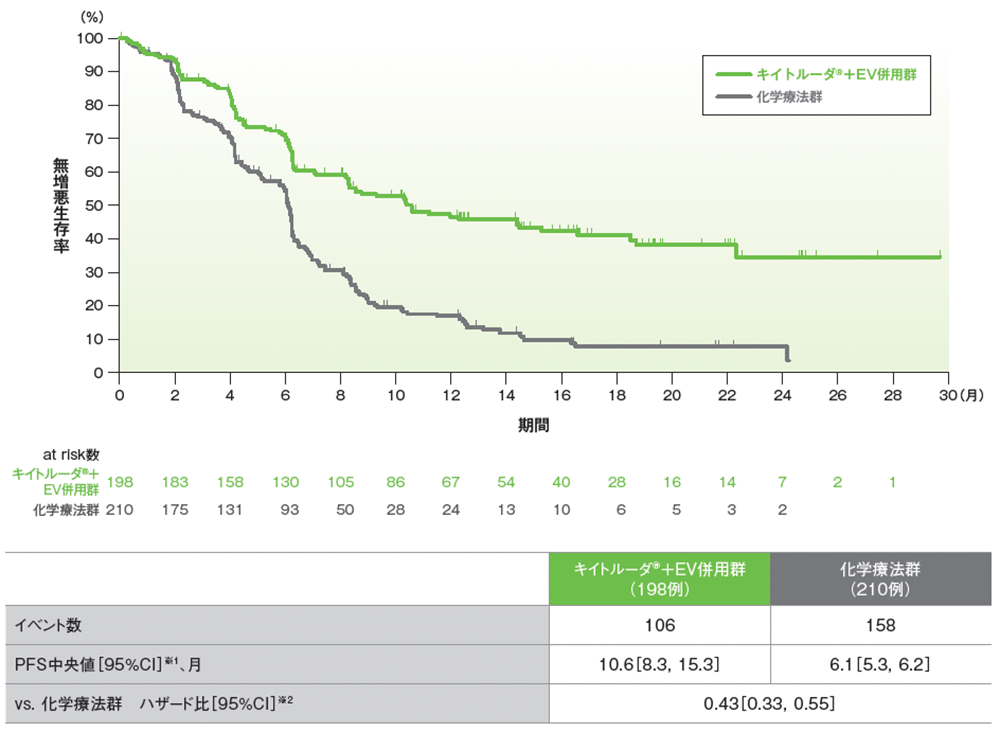
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年8月8日
※1 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した
Powles T, et al. N Engl J Med. 2024; 390(10): 875-888(supplementary appendix)
Adapted with permission from The New England Journal of Medicine, Powles T, et al, Enfortumab Vedotin and Pembrolizumab in Untreated Advanced Urothelial Cancer, 390(10), 875-888. Copyright © 2024 Massachusetts Medical Society. Translated with permission.
主要評価項目 全生存期間(OS)【検証的解析結果】

OSのKaplan-Meier曲線(ITT集団)
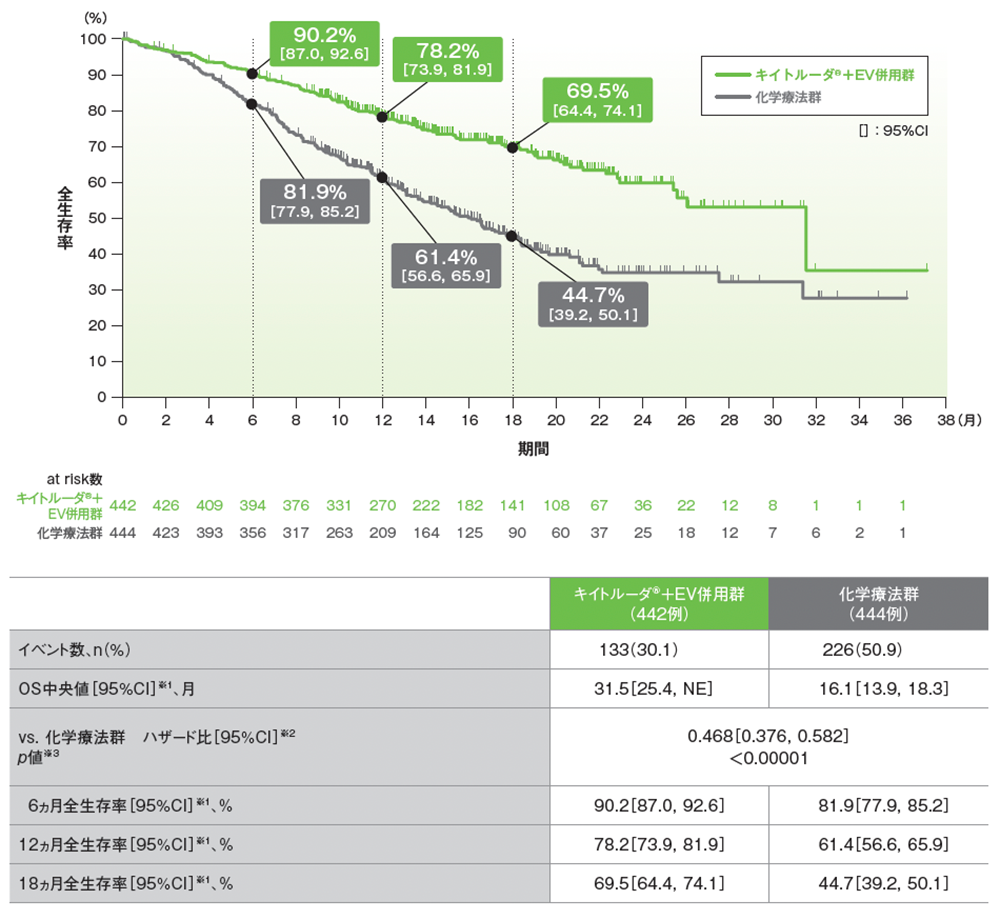
データカットオフ日:2023年8月8日
※1 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく
※3 無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別ログランク検定[両側]、有意水準α=0.01548; 検証的解析結果
- 追跡期間中央値17.2ヵ月において、キイトルーダ®+EV併用群は、化学療法群に対してOSを有意に延長しました(ハザード比:0.468[95%CI: 0.376, 0.582]、p<0.00001、層別ログランク検定[両側]、有意水準α=0.01548; 検証的解析結果)。
- OS中央値は、キイトルーダ®+EV併用群で31.5ヵ月(95%CI: 25.4, NE)、化学療法群で16.1ヵ月(95%CI: 13.9, 18.3)でした。
サブグループ解析 全生存期間(OS)

OSのハザード比のフォレストプロット(ITT集団)
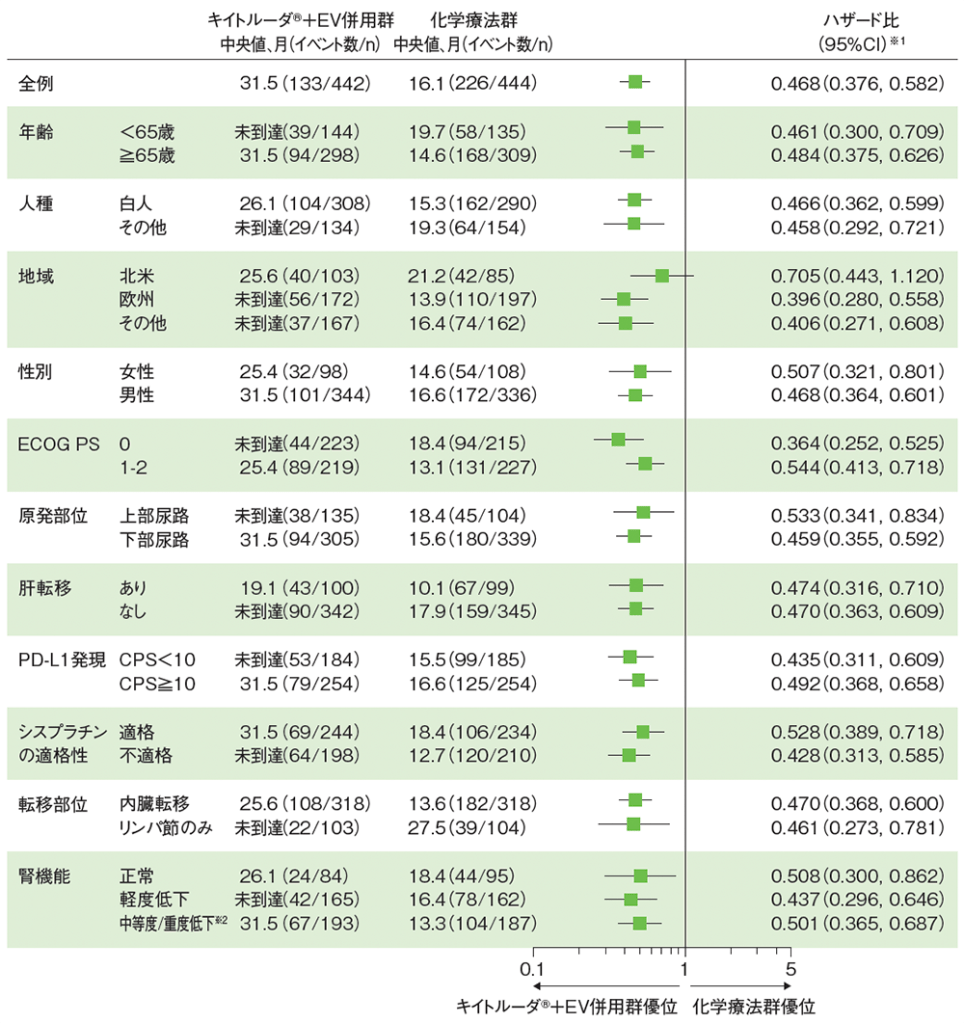
データカットオフ日:2023年8月8日
シスプラチン適格性及び肝転移の有無のサブグループは、無作為化補正後のCRF(case report form)に基づく
PD-L1発現のサブグループは、QC(quality control)後の検査結果に基づく
※1 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した
※2 十分な例数がいない場合、2つ以上のサブグループ変数を併合することが規定された
サブグループ解析 シスプラチン適格性別の全生存期間(OS)

シスプラチン適格患者におけるOSのKaplan-Meier曲線
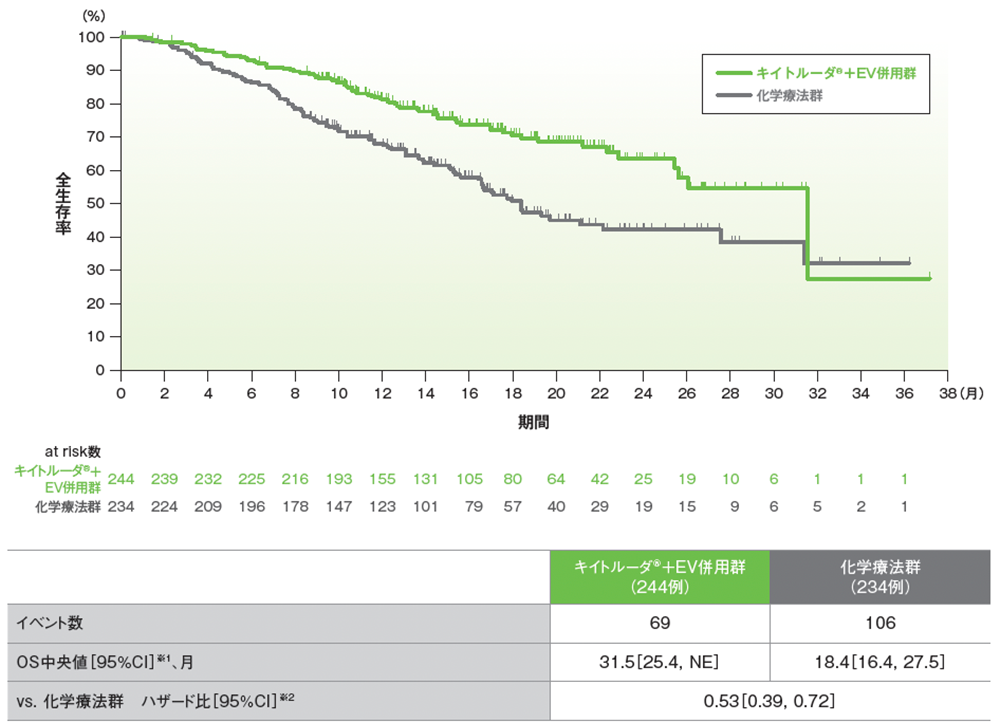
データカットオフ日:2023年8月8日
※1 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した
Powles T, et al. N Engl J Med. 2024; 390(10): 875-888(supplementary appendix)
Adapted with permission from The New England Journal of Medicine, Powles T, et al, Enfortumab Vedotin and Pembrolizumab in Untreated Advanced Urothelial Cancer, 390(10), 875-888. Copyright © 2024 Massachusetts Medical Society. Translated with permission.

シスプラチン不適格患者におけるOSのKaplan-Meier曲線
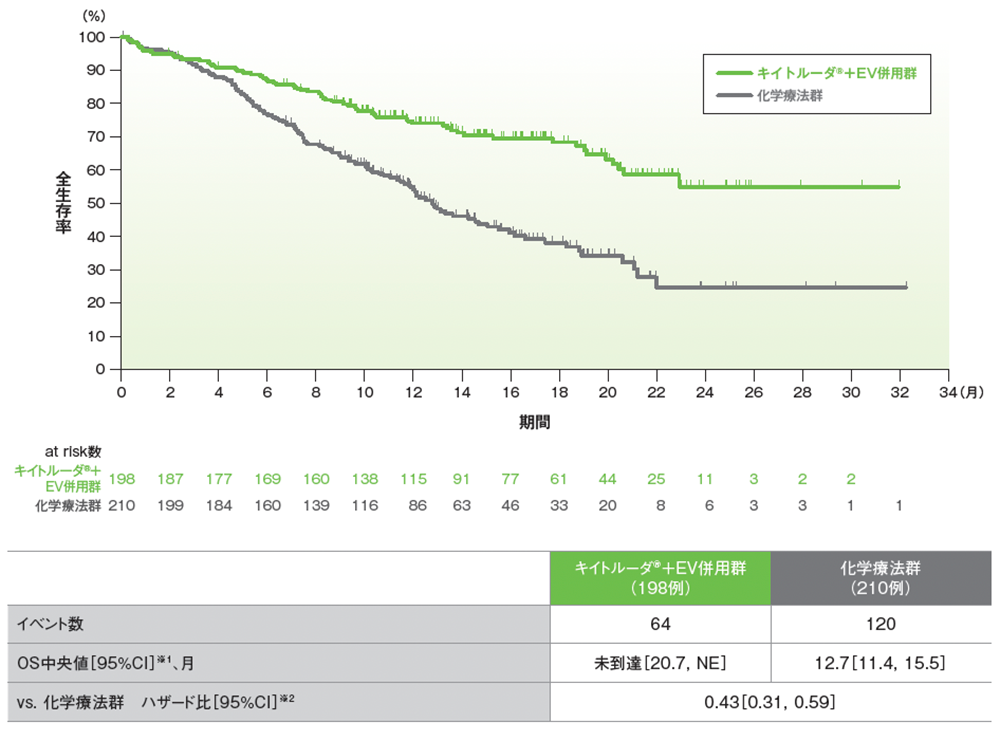
データカットオフ日:2023年8月8日
※1 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した
Powles T, et al. N Engl J Med. 2024; 390(10): 875-888(supplementary appendix)
Adapted with permission from The New England Journal of Medicine, Powles T, et al, Enfortumab Vedotin and Pembrolizumab in Untreated Advanced Urothelial Cancer, 390(10), 875-888. Copyright © 2024 Massachusetts Medical Society. Translated with permission.
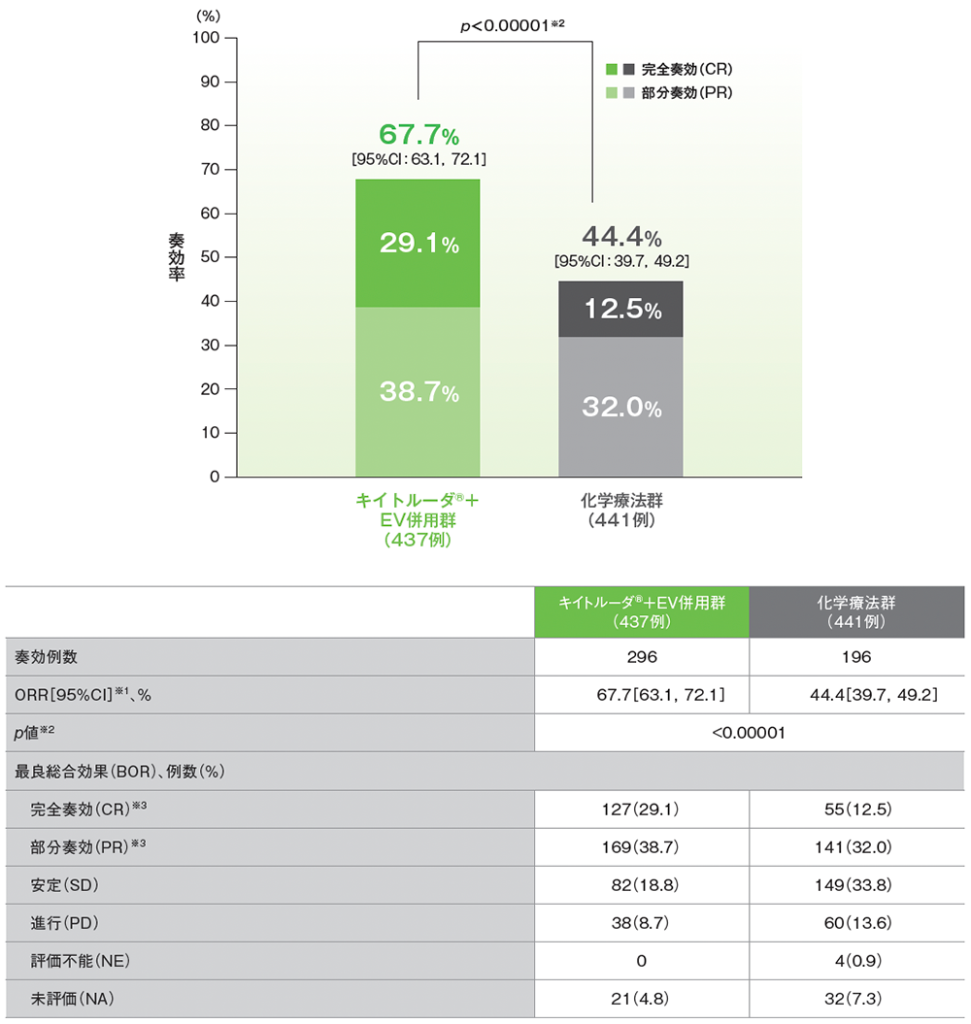
副次評価項目 奏効率(ORR)

ORR:CR+PR(奏効評価対象集団)
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年8月8日
※1 Clopper-Pearson法に基づく
※2 無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cochran-Mantel-Haenszel(CMH)検定[両側]
※3 最初の奏効から28日以上あけて評価した
- 追跡期間中央値17.2ヵ月において、ORRは、キイトルーダ®+EV併用群で、67.7%(95%CI: 63.1, 72.1)、化学療法群で44.4%(95%CI: 39.7, 49.2)であり、キイトルーダ®+EV併用群におけるORRは化学療法群に対して有意に高い値でした(p<0.00001、層別Cochran-Mantel-Haenszel[CMH]検定[両側])。
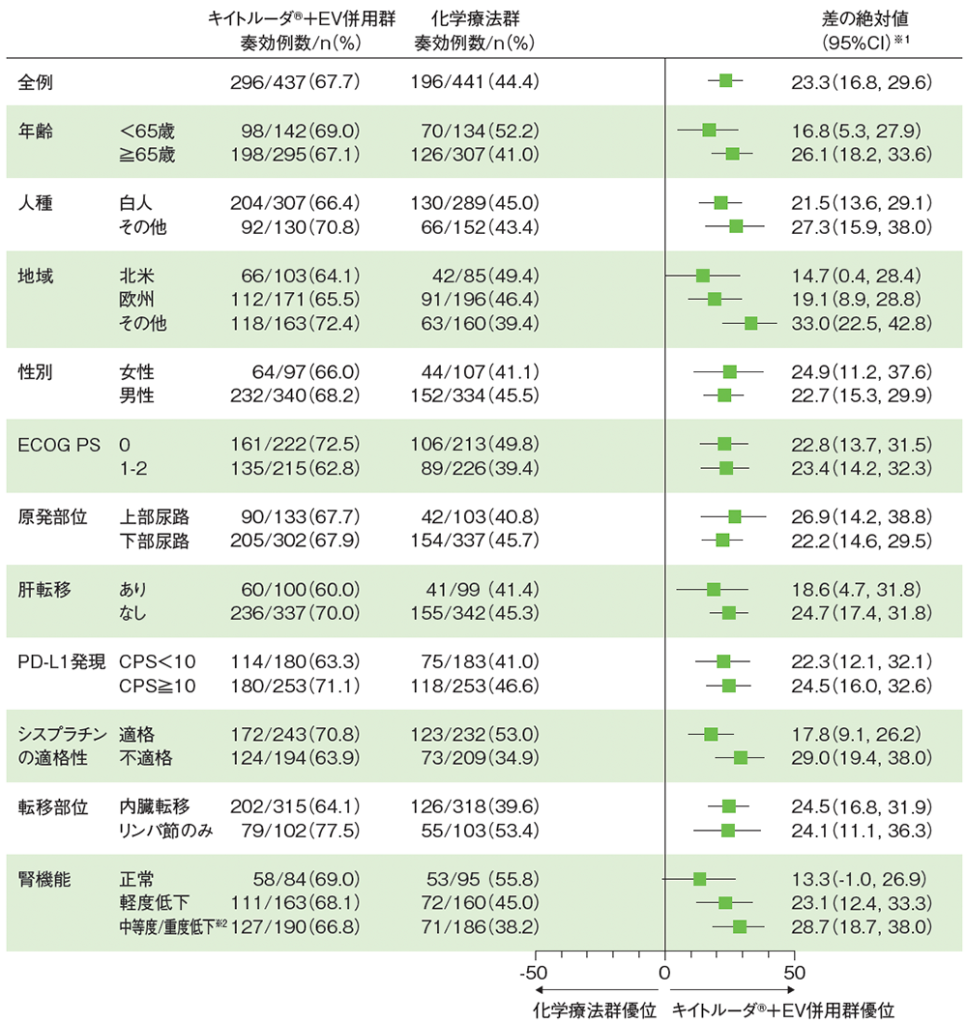
サブグループ解析 奏効率(ORR)

ORRの差の絶対値のフォレストプロット(奏効評価対象集団)
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年8月8日
シスプラチン適格性及び肝転移の有無のサブグループは、無作為化補正後のCRF(case report form)に基づく
PD-L1発現のサブグループは、QC(quality control)後の検査結果に基づく
※1 Clopper-Pearson法に基づく
※2 十分な例数がいない場合、2つ以上のサブグループ変数を併合することが規定された
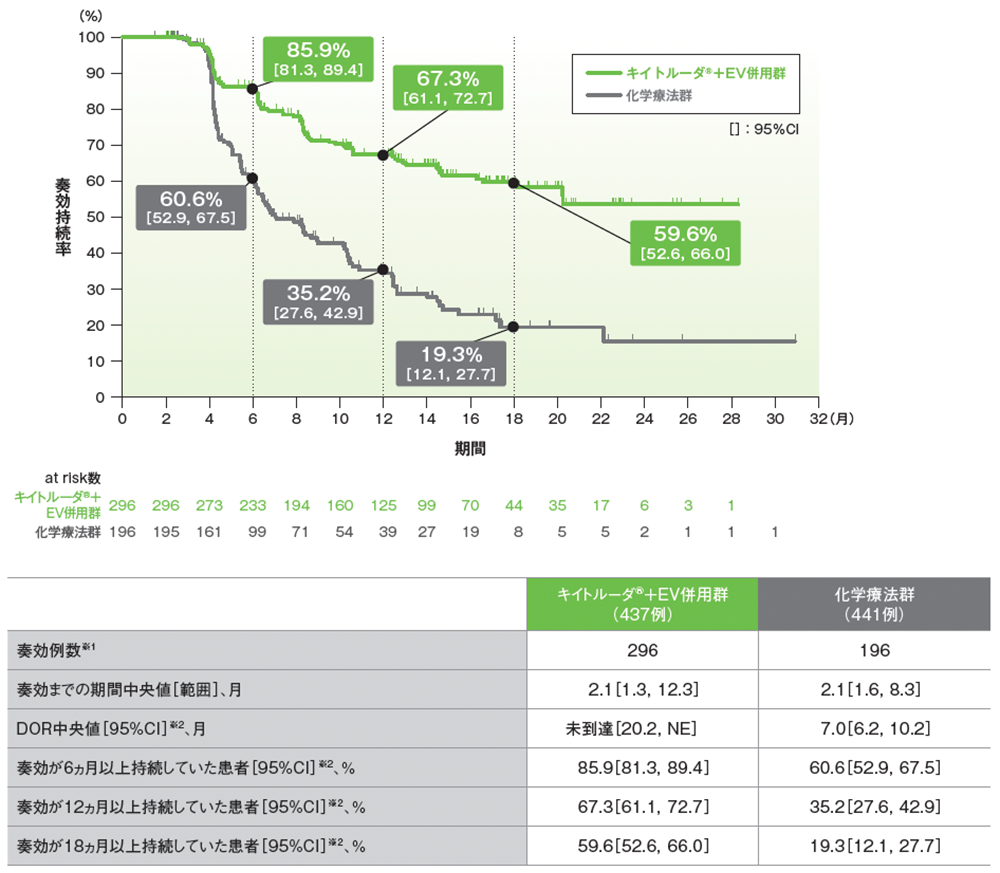
副次評価項目 奏効期間(DOR)

奏効が確定した患者におけるDORのKaplan-Meier曲線(奏効評価対象集団)
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年8月8日
※1 CR又はPRが認められた患者数
※2 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
- 追跡期間中央値17.2ヵ月におけるDOR中央値は、キイトルーダ®+EV併用群で未到達(95%CI: 20.2, NE)、化学療法群で7.0ヵ月(95%CI: 6.2, 10.2)でした。
- 奏効が12ヵ月以上持続した割合は、キイトルーダ®+EV併用群で67.3%、化学療法群で35.2%でした。

曝露状況(ASaT集団)
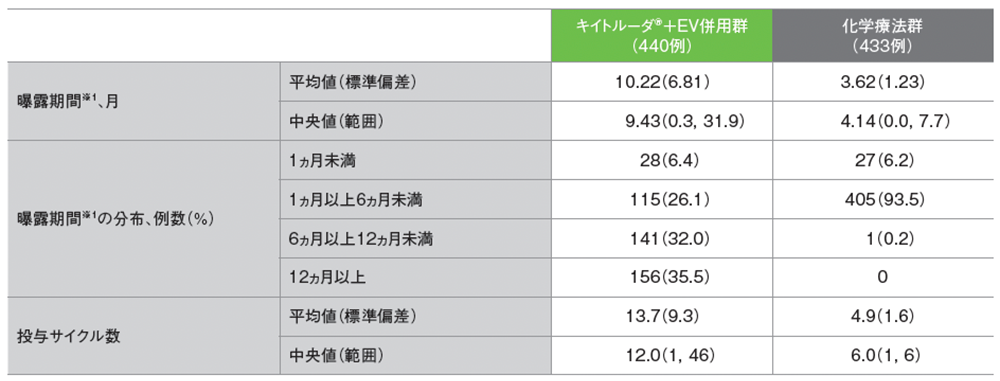
データカットオフ日:2023年8月8日
※1 曝露期間は[(最終サイクルの初回投与日+20、カットオフ日、死亡日のうち最小値)-初回投与日+1]/30.4375に基づく

薬剤ごとの曝露状況(ASaT集団)
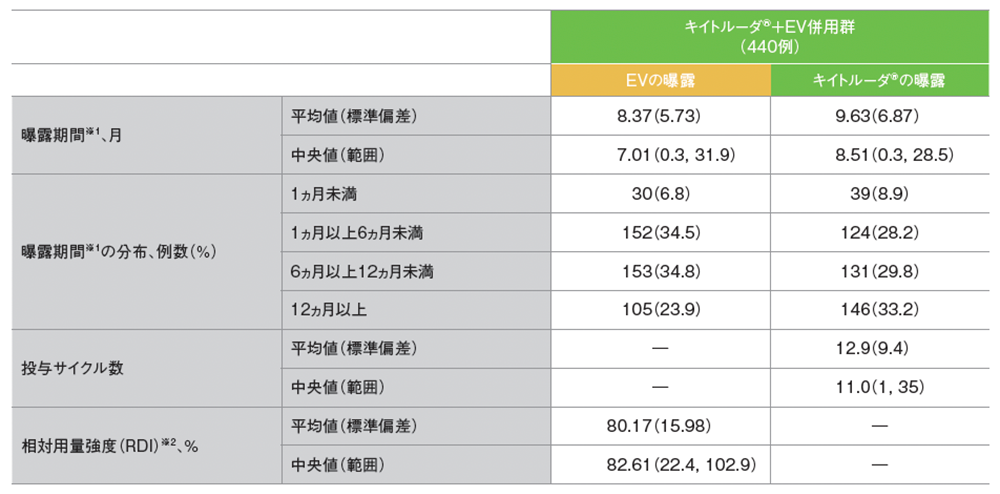
データカットオフ日:2023年8月8日
※1 曝露期間は[(最終サイクルの初回投与日+20、カットオフ日、死亡日のうち最小値)-初回投与日+1]/30.4375に基づく
※2 RDI=(用量強度/計画用量強度)×100に基づく。EVについては、患者の体重上限を100kgとして計算した。実際の投与時、体重100kgを上限としなかった患者がいたため、RDIが100%を超える可能性がある
安全性 主な副作用(ASaT集団)

副作用は、キイトルーダ®+EV併用群で440例中427例(97.0%)、化学療法群で433例中414例(95.6%)に認められました。
Grade 3以上の副作用は、キイトルーダ®+EV併用群で246例(55.9%)、化学療法群で301例(69.5%)に認められました。
発現割合20%以上の主な副作用は、キイトルーダ®+EV併用群で末梢性感覚ニューロパチー220例(50.0%)、そう痒症175例(39.8%)、脱毛症146例(33.2%)、斑状丘疹状皮疹144例(32.7%)、疲労129例(29.3%)、下痢121例(27.5%)、食欲減退118例(26.8%)、悪心89例(20.2%)、化学療法群で貧血245例(56.6%)、好中球減少症180例(41.6%)、悪心168例(38.8%)、疲労156例(36.0%)、血小板減少症148例(34.2%)、食欲減退98例(22.6%)でした。
主な副作用(いずれかの投与群で発現割合20%以上の副作用、又はいずれかの投与群で発現割合5%以上のGrade 3以上の副作用)
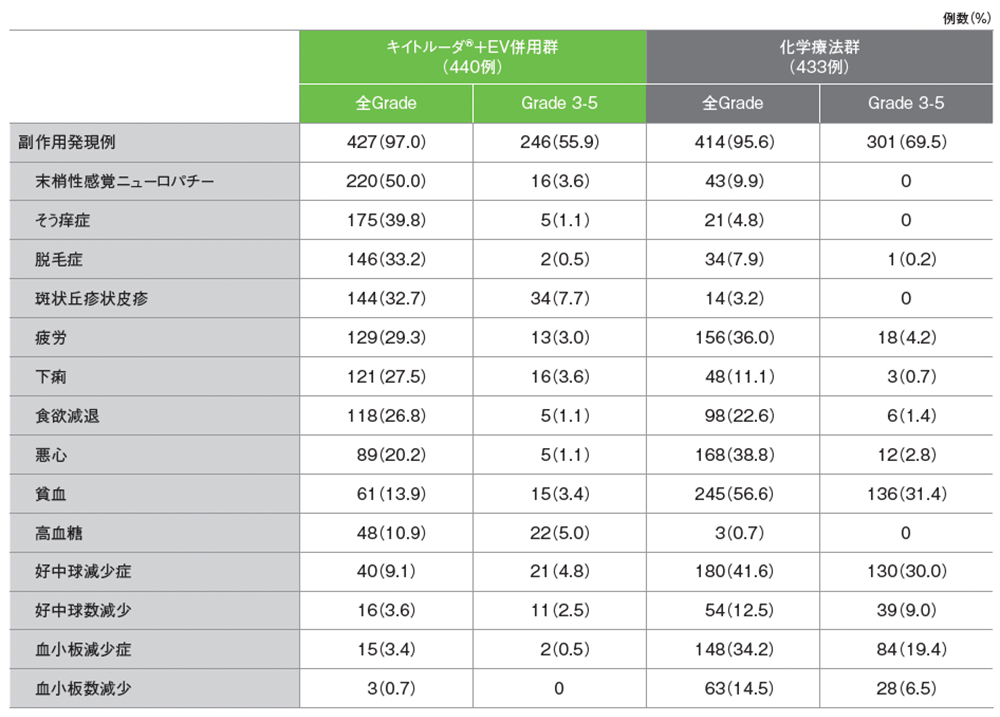
治験担当医師による評価、データカットオフ日:2023年8月8日
GradeはNCI CTCAE v4.03
Powles T, et al. N Engl J Med. 2024; 390(10): 875-888
Adapted with permission from The New England Journal of Medicine, Powles T, et al, Enfortumab Vedotin and Pembrolizumab in Untreated Advanced Urothelial Cancer, 390(10), 875-888. Copyright © 2024 Massachusetts Medical Society. Translated with permission.
キイトルーダ®+EV併用群において、重篤な副作用は122例(27.7%)に認められ、発現割合2%以上のものは、急性腎障害、下痢 各10例(2.3%)、肺臓炎9例(2.0%)でした。
いずれかの薬剤の投与中止に至った副作用は154例(35.0%)に認められ、発現割合2%以上のものは、末梢性感覚ニューロパチー47例(10.7%)、肺臓炎9例(2.0%)でした。
死亡に至った副作用は4例(0.9%)に認められ、多臓器機能不全症候群、無力症、下痢、免疫性肺疾患 各1例(0.2%)でした。
EVの減量に至った副作用は179例(40.7%)に認められ、発現割合2%以上のものは、末梢性感覚ニューロパチー38例(8.6%)、斑状丘疹状皮疹25例(5.7%)、疲労11例(2.5%)でした。
いずれかの薬剤の休薬に至った副作用は299例(68.0%)に認められ、発現割合2%以上のものは、末梢性感覚ニューロパチー78例(17.7%)、斑状丘疹状皮疹42例(9.5%)、下痢26例(5.9%)、アラニンアミノトランスフェラーゼ増加、疲労、好中球減少症 各18例(4.1%)、肺臓炎16例(3.6%)、高血糖、そう痒症 各14例(3.2%)、斑状皮疹11例(2.5%)、末梢性感覚運動ニューロパチー10例(2.3%)、水疱性皮膚炎9例(2.0%)でした。
化学療法群の副作用において、重篤な副作用は85例(19.6%)に認められ、発現割合2%以上のものは、貧血16例(3.7%)、血小板減少症13例(3.0%)、発熱性好中球減少症11例(2.5%)でした。
いずれかの薬剤の投与中止に至った副作用は80例(18.5%)に認められ、発現割合2%以上のものは、貧血12例(2.8%)でした。
死亡に至った副作用は4例(0.9%)に認められ、敗血症、発熱性好中球減少症、心筋梗塞、好中球減少性敗血症 各1例(0.2%)でした。
いずれかの薬剤の減量に至った副作用は164例(37.9%)に認められ、発現割合2%以上のものは、血小板減少症41例(9.5%)、好中球減少症39例(9.0%)、貧血26例(6.0%)、疲労16例(3.7%)、血小板数減少15例(3.5%)、好中球数減少12例(2.8%)でした。
いずれかの薬剤の休薬に至った副作用は229例(52.9%)に認められ、発現割合2%以上のものは、好中球減少症95例(21.9%)、貧血55例(12.7%)、血小板減少症38例(8.8%)、好中球数減少33例(7.6%)、疲労15例(3.5%)、悪心11例(2.5%)、急性腎障害10例(2.3%)でした。
※MedDRA v26.0、減量が許されたのはEVのみであった
安全性 キイトルーダ®の免疫関連など特に注目すべき有害事象(ASaT集団)

免疫関連など特に注目すべき有害事象は、キイトルーダ®+EV併用群で440例中193例(43.9%)、化学療法群で433例中21例(4.8%)に認められました。
キイトルーダ®の免疫関連など特に注目すべき有害事象

MedDRA v26.0、データカットオフ日:2023年8月8日
※カテゴリー別で集計
安全性 EVの特に注目すべき有害事象(ASaT集団)

EVの特に注目すべき有害事象

MedDRA v26.0
データカットオフ日:2023年8月8日
※カテゴリー別で集計
後治療

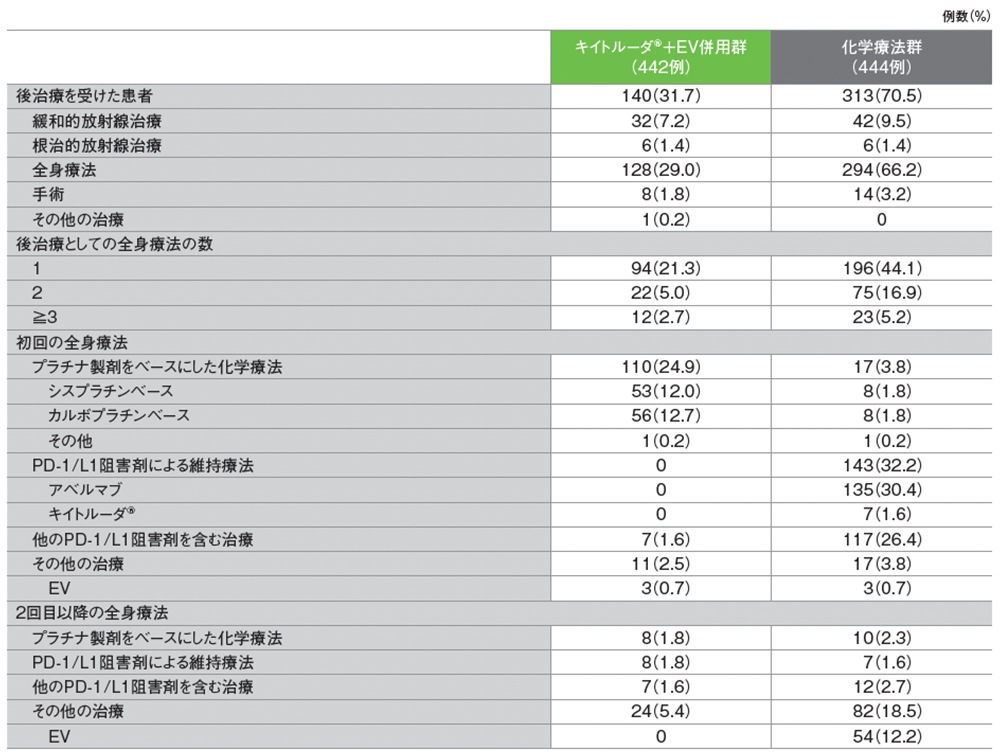
カルボプラチンの尿路上皮癌への使用は国内適応外
キイトルーダ®による維持療法は国内適応外
シスプラチンの効能又は効果は以下のとおりです。
4. 効能又は効果(抜粋)
○シスプラチン通常療法
睾丸腫瘍、膀胱癌、腎盂・尿管腫瘍、前立腺癌、卵巣癌、頭頸部癌、非小細胞肺癌、食道癌、子宮頸癌、神経芽細胞腫、胃癌、小細胞肺癌、骨肉腫、胚細胞腫瘍(精巣腫瘍、卵巣腫瘍、性腺外腫瘍)、悪性胸膜中皮腫、胆道癌
以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
悪性骨腫瘍、子宮体癌(術後化学療法、転移・再発時化学療法)、再発・難治性悪性リンパ腫、小児悪性固形腫瘍(横紋筋肉腫、神経芽腫、肝芽腫その他肝原発悪性腫瘍、髄芽腫等)
カルボプラチンの効能又は効果は以下のとおりです。
4. 効能又は効果(抜粋)
○頭頸部癌、肺小細胞癌、睾丸腫瘍、卵巣癌、子宮頸癌、悪性リンパ腫、非小細胞肺癌、乳癌
○ 以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
小児悪性固形腫瘍(神経芽腫・網膜芽腫・肝芽腫・中枢神経系胚細胞腫瘍、再発又は難治性のユーイング肉腫ファミリー腫瘍・腎芽腫)
キイトルーダ®の電子添文は以下のとおりです。
4. 効能又は効果(抜粋)根治切除不能な尿路上皮癌
5. 効能又は効果に関連する注意(抜粋)
5.6 本剤の手術の補助療法としての有効性及び安全性は確立していない。
5.7 白金系抗悪性腫瘍剤を含む化学療法の適応とならない化学療法未治療患者への本剤単独投与については、他の治療の実施についても慎重に検討すること。
6. 用法及び用量(抜粋)
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
7. 用法及び用量に関連する注意(抜粋)
7.3 エンホルツマブ ベドチン(遺伝子組換え)以外の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.4 白金系抗悪性腫瘍剤を含む化学療法の適応となる化学療法未治療患者に対する本剤単独投与の有効性及び安全性は確立していない。
副次評価項目 痛みの増悪までの期間(TTPP)(BPI-SF† 質問3及び質問7)

TTPPのKaplan-Meier曲線(PRO解析対象集団)
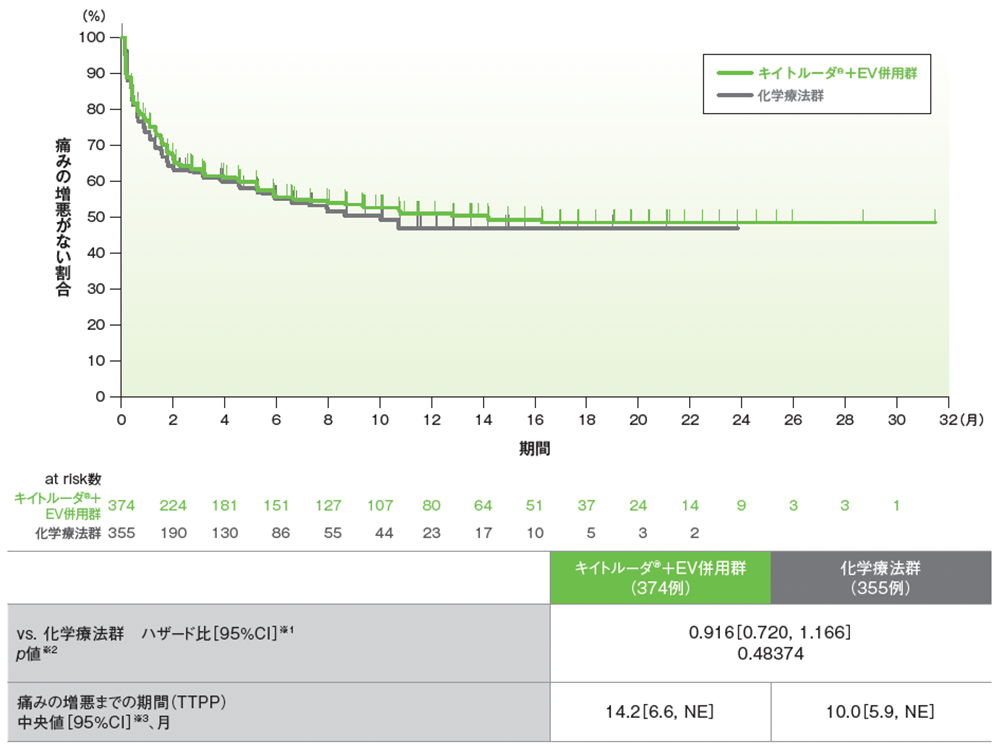
データカットオフ日:2023年8月8日
※1 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]及び年齢、性別、地域で調整したCox比例ハザードモデルに基づく
※2 無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]及び年齢、性別、地域で調整した層別ログランク検定[両側]
※3 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
- 追跡期間中央値17.2ヵ月において、TTPP中央値はキイトルーダ®+EV併用群14.2ヵ月、化学療法群で10.0ヵ月でした(ハザード比: 0.916[95%CI: 0.720, 1.166]、p=0.48374、層別ログランク検定[両側])。TTPPに投与群間の統計学的有意差は認められませんでした。
- この結果から、ゲートキーピング法による検定計画に従い検定が終了しました。そのため、26週目の最も強い痛みにおけるベースラインからの平均変化量は有意水準を定めた統計学的検定を行いませんでした。
† BPI-SF(Brief Pain Inventory-Short Form; 簡易疼痛調査用紙 縮小版):
痛みの強さに加え、痛みが日常生活にどのように影響しているかを明らかにする評価ツールで、9つの質問から成る。日本語版1)もあり、質問3及び質問7は以下の通り。
質問3:この24時間にあなたが感じた最も強い痛みはどの位でしたか?最も近い数字を〇で囲んでください。
[0(痛くない)~10(これ以上の痛みは考えられない)の11段階で回答]
質問7:あなたは、痛みをとるためにどのような治療や投薬を受けていますか?
[自由記述回答]
1)Uki J et al. J Pain Symptom Manage 1998; 16(6): 364-373
副次評価項目 26週目の最も強い痛み(BPI-SF 質問3)におけるベースラインからの平均変化量

26週目の最も強い痛み(BPI-SF 質問3)におけるベースラインからの最小二乗平均変化量(±95%CI)(PRO解析対象集団)
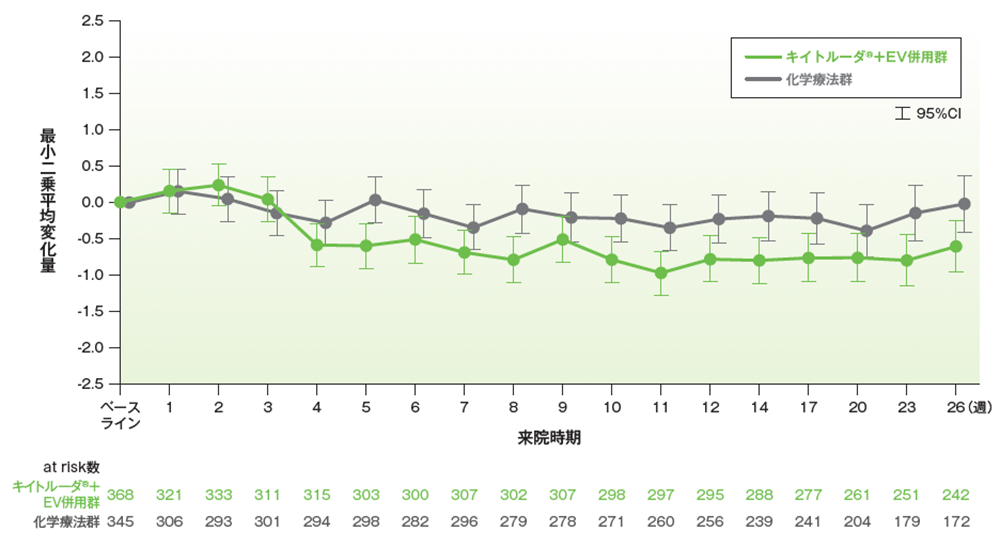
データカットオフ日:2023年8月8日
- 追跡期間中央値17.2ヵ月において、26週目の最も強い痛みにおけるベースラインからの平均変化量は、キイトルーダ®+EV併用群で-0.61、化学療法群-0.03でした。
- 26週目の平均変化量の差は-0.58でした。
キイトルーダ®の投与期間中は、以下の検査スケジュールを参考に患者さんの状態を観察してください。
キイトルーダ®200mg及びEV1.25mg/kgを3週間間隔投与したKEYNOTE-A39試験における検査スケジュール(キイトルーダ®は最大35回投与)
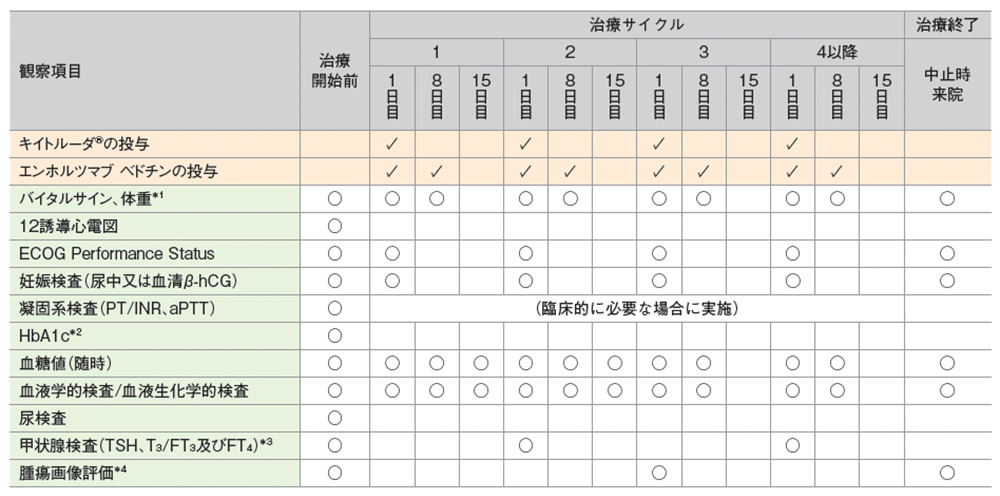
*1 体重は各サイクル1日目のみ
*2 スクリーニング時にHbA1cの高値(6.5%以上)が認められた場合は、治療サイクル1の間、適切な専門家による診療と血糖値の管理指導を行うよう規定されていた
*3 サイクル2以降2サイクル毎
*4 18ヵ月まで9週間毎、以降は12週間毎
バイタルサイン:体温、脈拍、血圧
妊娠検査:妊娠の可能性のある女性の場合に、投与前に実施
血液学的検査:白血球数及び分画(好中球、リンパ球、単球、好酸球、好塩基球)、血小板数、ヘモグロビン、ヘマトクリット
血液生化学的検査:アルブミン、ALP、ALT、AST、HCO3‒、BUN、Ca、クレアチニン、Cl、LDH、P、K、Na、総ビリルビン、アミラーゼ(スクリーニング時のみ)、リパーゼ(スクリーニング時のみ)
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-A39試験/ EV-302試験)