【Expert Eyes on irAE】皮膚障害編(監修:がん研究会有明病院 皮膚腫瘍科 部長 吉野 公二 先生)
irAE皮膚障害の早期発見のポイント、皮膚科専門医へのコンサルトタイミングについて、わかりやすく解説しています。
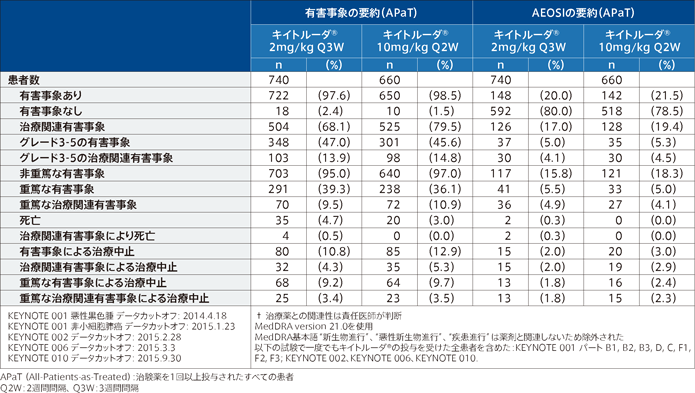
本剤は、一部承認外の用法・用量による臨床成績も含めた臨床データパッケージで評価され、承認されました。そのため、国内で承認されている用法・用量※と異なる海外データも紹介しています。
※通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
臨床データに基づく投与量と有効性/安全性の関係(曝露-応答関係)のシミュレーション解析により、400mg 6週間間隔投与の有効性及び安全性が検討されました。
●400mg 6週間間隔投与の平均血中濃度Cavg,ss及び最小血中濃度Ctrough,ssの分布は、200mg 3週間間隔投与とほぼ重なると予測されました。
●400mg 6週間間隔投与で予測される最高血中濃度Cmax,ssは、これまでの臨床試験で安全性を検討した用法及び用量の予測値の範囲内に含まれると予測されました。
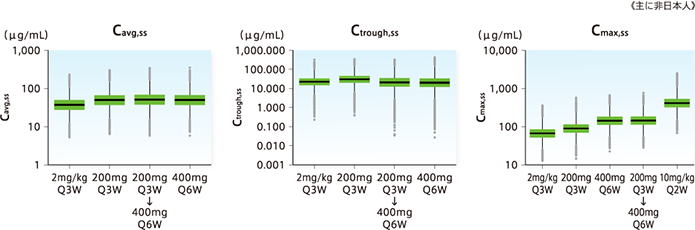
[方法]キイトルーダ®単独投与(2mg/kg Q3W、10mg/kg Q3W又はQ2W、200mg Q3W)を行った5試験(KEYNOTE 001、002、006、010及び024試験)を統合して、悪性黒色腫及び非小細胞肺癌を含む2,993例の患者(日本人83例を含む)を対象に構築した母集団薬物動態モデルにより、シミュレーションを100回繰り返し、400mg Q6W投与及び200mg Q3Wから400mg Q6Wへの切り替え投与時のペムブロリズマブの曝露量[平均血清中濃度(Cavg)、最低血清中濃度(Ctrough)及び最高血清中濃度(Cmax)]を予測した。比較のため、同じ方法で、2mg/kg Q3W、200mg Q3W(承認用法及び用量)、10mg/kg Q2Wを投与した際の曝露量も併せて予測した。
実 線:中央値、箱:25及び75パーセンタイル、ヒゲ:5及び95パーセンタイル、点:5パーセンタイル未満及び95パーセンタイル超の個別値
ss:定常状態、Q2W:2週間間隔、Q3W:3週間間隔、Q6W:6週間間隔
Lala M et al. Eur J Cancer 2020; 131: 68-75
本研究はMSD社により計画・実施された。
●400mg 6週間間隔投与時の推定生存曲線は、200mg 3週間間隔投与時の推定生存曲線と類似すると予測されました。
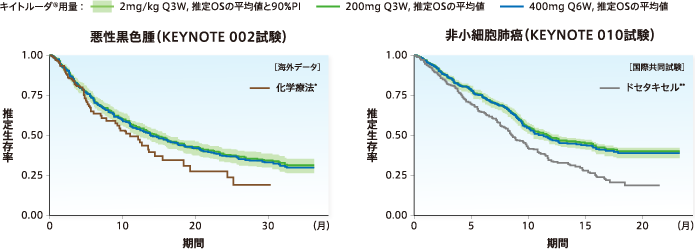
[方法]悪性黒色腫(KEYNOTE 002試験)及び非小細胞肺癌(KEYNOTE 010試験)患者のデータに基づいて、ペムブロリズマブの曝露量[Ctrough,wk6及び初回投与後の投与間隔内の平均血清中濃度(Cavg,wk6)]との関係を、がん種ごとにCox比例ハザードモデルを用いて100回シミュレーションを行い、2mg/kg Q3W、200mg Q3W 及び400mg Q6Wの用法及び用量に基づく曝露量から、それぞれOSを予測した。実線は、各用法及び用量での投与後の推定OSの平均値を示す。
網掛け:2mg/kg Q3Wでの予測生存曲線の90%予測区間(PI)
* KEYNOTE 002試験の対照群で、担当医師が選択した化学療法(カルボプラチン+パクリタキセル※、パクリタキセル単剤※、ダカルバジン又はテモゾロミド※)
** KEYNOTE 010試験の対照群
※悪性黒色腫に対して国内未承認
Q3W:3週間間隔、Q6W:6週間間隔、wk6:6週時
承認時評価資料
●キイトルーダ®のAEOSIの発現割合はAUCの増加にかかわらず、おおむね一定と予測されました。
●400mg 6週間間隔投与のAUCは200mg 3週間間隔投与と大部分が重なると予測されました。
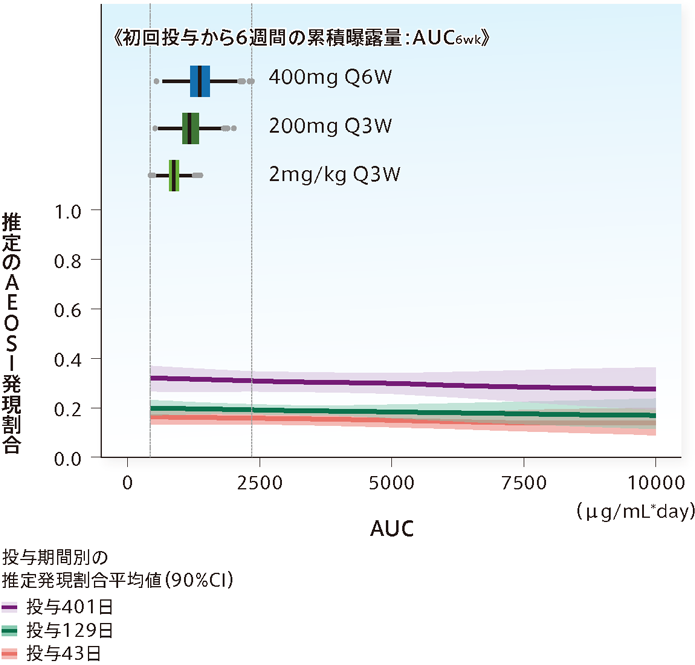
[方法]KEYNOTE 001、002及び010試験のデータを統合し、2~10mg/kgで投与した6週間のAUC6wkの範囲(425~10,000 μg/mL*day)でAEOSIの発現割合をAUCの関数として予測した。実線はモデルにより予測した確率、網掛け部分は予測値の90%信頼区間を表す。投与期間は三分位数で示し、投与期間の中央値はそれぞれ43、129及び401日間であった。
箱ひげ図は、母集団薬物動態モデルにより予測した2mg/kg Q3W、200mg Q3W、400mg Q6Wで投与した際のAUC6wkの分布を示す。
Q2W:2週間間隔、Q3W:3週間間隔、Q6W:6週間間隔
※AEOSI (adverse events of special interest):免疫関連を含む特に注目すべき有害事象
承認時評価資料

irAE皮膚障害の早期発見のポイント、皮膚科専門医へのコンサルトタイミングについて、わかりやすく解説しています。


WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?