海外第Ⅱa相試験(006試験)(海外データ)
海外第Ⅱa相試験(006試験)(海外データ)1)
1)承認時評価資料:海外第Ⅱa試験(006試験)
試験概要
患者背景
* OD値が総Igで0.376、IgAで0.3、IgMで0.31、IgGで0.376より大きいことと定義した。
† 抗体保有者数
有効性
1)SARS-CoV-2 RNA陰性化までの期間(MITT集団):主要評価項目
SARS-CoV-2 RNA陰性化までの期間の中央値は、ラゲブリオ®800mg群で14.0日、プラセボ群で15.0日でした。
a)2回連続でRT-PCR検査結果が陰性の場合にイベント発現とされ、イベント発現日は1回目にRT-PCR検査結果が陰性となった検体の採取日とされた。なお、最後に採取された検体においてのみRT-PCR検査結果が陰性であった場合には、最後の採取時点がイベント発現日とされた。
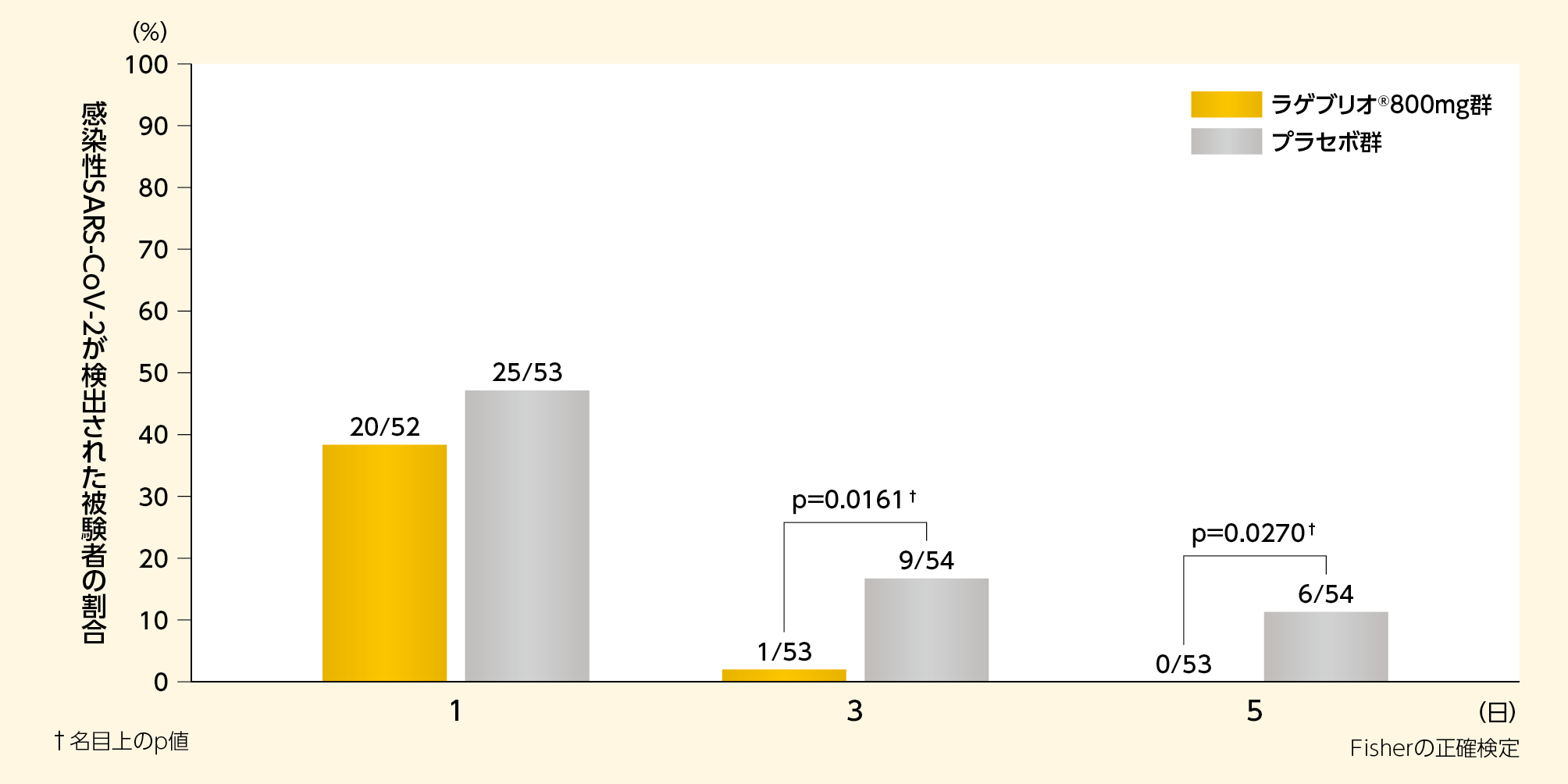
2)感染性SARS-CoV-2の割合(MITT集団):副次評価項目
感染性SARS-CoV-2陽性被験者の割合は、3日目にラゲブリオ®800mg群1.9%(1/53例)、プラセボ群16.7%(9/54例)であり、5日目ではラゲブリオ®800mg群0%(0/53例)、プラセボ群11.1%(6/54例)でした。
6. 用法及び用量
通常、18歳以上の患者には、モルヌピラビルとして1回800mgを1日2回、5日間経口投与する。
安全性:主要評価項目
- 副作用は、ラゲブリオ®200mg群で23例中4例(17.4%)、400mg群で62例中13例(21.0%)、800mg群で55例中1例(1.8%)、プラセボ群で62例中8例(12.9%)に認められました。主な副作用(発現例数2例以上)はラゲブリオ®200mg群で不眠症2例(8.7%)、400mg群で血中クレアチニン増加3例(4.8%)、頭痛、ALT増加、悪心各2例(3.2%)、プラセボ群で不眠症3例(4.8%)、ALT増加2例(3.2%)でした。
- 本試験において重篤な副作用、投与中止に至った副作用、死亡に至った副作用は認められませんでした。