製品基本Q&A
製品基本Q&A
ラゲブリオ®カプセル200mg
製品に関する情報は、チャットボットもご利用ください。
製品情報▼ 投与対象▼ 投与方法▼ 相互作用・併用▼ 用量調節▼ ボトルの扱い▼ 安全性▼ その他▼
製品情報
本剤の電子添文には、以下のとおり記載されています。
4. 効能又は効果
SARS-CoV-2による感染症
5. 効能又は効果に関連する注意
5.1 臨床試験における主な投与経験を踏まえ、SARS-CoV-2による感染症の重症化リスク因子を有する等、本剤の投与が必要と考えられる患者に投与すること。また、本剤の投与対象については最新のガイドラインも参考にすること。[17.1.1参照]
5.2 重症度の高いSARS-CoV-2による感染症患者に対する有効性は確立していない。
<引用>
電子添文
本剤の電子添文には、以下のとおり記載されています。
18. 薬効薬理 より
18.1 作用機序
モルヌピラビルはプロドラッグであり、NHCに代謝され細胞内に取り込まれた後、活性型であるNHC-TPにリン酸化される。NHC-TPがウイルス由来RNA依存性RNAポリメラーゼによりウイルスRNAに取り込まれた結果、ウイルスゲノムのエラー頻度が増加し、ウイルスの増殖が阻害される(1)(2)。[5.参照]
<引用>
(1)Crotty S et al. Nat Med. 2000;6:1375-1379.
(2)Tejero H et al. Curr Top Microbiol Immunol. 2016;392:161-179.
In vitroにおいて、NHC(*)はアルファ株、ベータ株、ガンマ株、デルタ株、ミュー株、ラムダ株、オミクロン株に対して、従来株と同様の抗ウイルス活性を示しました(1)。
(*)NHC: モルヌピラビルの主要代謝物。N-ヒドロキシシチジンの略。
<引用>
(1)インタビューフォーム Ⅵ.薬効薬理に関する項目 2.薬理作用 (2) 薬効を裏付ける試験成績 1) In vitro薬理試験 ②NHCのSARS-CoV-2の変異株に対する抗ウイルス作用
非臨床試験において、オミクロン株BA.1、BA.1.1、BA.2(XBB、XBB.1.5、XBB.1.9.1を含む)、BA.4、及びBA.5(BQ.1を含む)系統への抗ウイルス活性が報告されています(1)(2)(3)(4)(5)(6)。
また、実臨床においてもオミクロン株流行期での有効性を評価した研究が報告されています(7)(8)(9)(10)(11)。
<引用>
(1) インタビューフォーム Ⅵ.薬効薬理に関する項目 2.薬理作用
(2)Takashita E et al. N Engl J Med. 2022;387(5):468-470. Correspondence
(検討されているオミクロン株: BA.2.12.1, BA.4, BA.5)
(3)Takashita E et al. N Engl J Med. 2022;387(13):1236-1238. Correspondence
(検討されているオミクロン株:BA.2.75 (通称ケンタウルス))
(4)Imai M et al. N Engl J Med. 2023;388(1):89-91. Correspondence
(検討されているオミクロン株:BQ.1.1 (通称 ケルベロス)、XBB (通称 グリフォン))
(5)Uraki R et al. Lancet Infect Dis. 2023;23(4):402-403. Correspondence
(検討されているオミクロン株:XBB.1.5)
(6)Uraki R et al. iScience. 2023;26(11):108147.
(検討されているオミクロン株:XBB.1.9.1)
(7)Butler CC et al. Lancet. 2023;401(10373):281-293.
(8)Xie Y et al. BMJ. 2023;380:e072705.
(9)Wong CKH et al. Lancet Infect Dis. 2022;22(12):1681-1693.
(10)Suzuki Y et al. Clin Exp Med. 2023;23(6):2715-2723.
(11)Lin DY et al. JAMA Netw Open. 2023 Sep 5;6(9):e2335077.
(検討されているオミクロン株:BQ.1.1、XBB.1.5など)
投与対象
本剤の電子添文には、以下のとおり記載されています。
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[8.、9.4、9.5参照]
<引用>
電子添文
電子添文上、具体的な重症化リスク因子は設定しておらず、「本剤の投与対象については最新のガイドラインも参考にすること」としています。
以下のガイドライン又は関係学会による最新の指針等も参照してください。
・日本感染症学会の「COVID-19 に対する薬物治療の考え方」の記載(1)
・国際共同第Ⅱ/Ⅲ相試験(MOVe-OUT(002)試験)の組み入れ基準(2)
・新型コロナウイルス感染症に係る国内の主要な診療ガイドラインである「新型コロナウイルス感染症(COVID-19)診療の手引き」の記載(3)
<一般流通品(薬価基準収載品)の保険請求>
保険給付につきましては、各都道府県の審査の先生方の判断が異なる可能性もありますので、地域の審査支払機関に状況をご確認ください。
<引用>
(1)日本感染症学会:COVID-19に対する薬物治療の考え方 第15.1版 (2023年2月14日)
(2)電子添文
(3)厚生労働省:新型コロナウイルス感染症(COVID-19)診療の手引き 第10.1版 (2024年4月23日) 研究班最終報告
<ワクチン接種者への投与の可否>
電子添文上、ワクチン接種済み患者に対する制限はありません。ワクチン接種者への投与は可能です。
<ワクチン接種者での有効性評価>
・国際共同第Ⅱ/Ⅲ相試験 (MOVe-OUT試験) (*1)ではワクチンを接種した患者は、除外されていたため(1)ワクチン接種者でのデータはありません。
実臨床において、ワクチン接種者が多く含まれる患者に対しラゲブリオ®の有効性を評価した海外(2)(3)及び国内(4)報告があります。
(*1)MOVe-OUT(002)試験: SARS-CoV-2による感染症患者(非入院患者)を対象とした国際共同第Ⅱ/Ⅲ相試験
<引用>
(1)Bernal AJ et al. N Engl J Med. 2022;386(6):509-520.
Supplementary Material/Protocol 6.5 Concomitant Therapy
(2)Butler CC et al. Lancet. 2023;401(10373):281-293.
(3)Xie Y et al. BMJ. 2023;380:e072705.
(4)Suzuki Y et al. Clin Exp Med. 2023;23(6):2715-2723.
電子添文上、本剤の投与対象は重症化リスク因子を有する患者が中心ですが、審査の過程における議論からは、高熱や呼吸器症状等の相当の症状を呈し重症化のおそれがある場合など、本剤の投与が必要と判断された患者に対しては投与可能と考えられます(1)。
投与にあたっては、 電子添文に記載されているように※、最新のガイドラインも参考の上、ご判断ください。
国内のガイドライン等では、基本的に、重症化リスクがある患者に対するラゲブリオ®の投与が勧められています(2)(3)(4)。
なお、国購入品・一般流通品のいずれにおいても、電子添文に沿ってご使用ください(5)。
<一般流通品(薬価基準収載品)の保険請求>
保険給付につきましては、各都道府県の審査の先生方の判断が異なる可能性もありますので、地域の審査支払機関に状況をご確認ください。
※電子添文 5. 効能又は効果に関連する注意 より
5.1 臨床試験における主な投与経験を踏まえ、SARS-CoV-2による感染症の重症化リスク因子を有する等、本剤の投与が必要と考えられる患者に投与すること。また、本剤の投与対象については最新のガイドラインも参考にすること。[17.1.1 参照]
<引用>
(1)審査報告書(2021年12月24日) [特例承認に係る報告書] 3.3 効能・効果、用法・用量及び臨床的位置付けについて
(2)日本感染症学会:COVID-19に対する薬物治療の考え方 第15.1版 (2023年2月14日)
(3)厚生労働省:新型コロナウイルス感染症(COVID-19)診療の手引き 第10.1版 (2024年4月23日) 研究班最終報告
(4)厚生労働省 事務連絡(令和5年9月15日):【参考】新型コロナウイルス感染症に関する10月以降の見直し等について
(5)厚生労働省 事務連絡(令和5年5月22日):新型コロナウイルス感染症における経口抗ウイルス薬(ラゲブリオ®カプセル)の 取扱いについて(所有権の移転および再譲渡)
効能又は効果は、「SARS-CoV-2による感染症」です。
用法及び用量に関連する注意には、症状が発現してから速やかに投与を開始することとありますので、症状のある患者への投与となります。
また、無症状の患者は臨床試験に組み入れられておらず、有効性及び安全性が確認されていません。
本剤の投与は18歳以上の患者に行ってください。
18歳未満を対象とした臨床試験は実施していません。
<引用>
電子添文
本剤の電子添文には、以下のように記載されています。
2. 禁忌(次の患者には投与しないこと)
2.2 妊婦又は妊娠している可能性のある女性には投与しないこと。[8.、9.4、9.5参照]
8. 重要な基本的注意
妊娠する可能性のある女性への投与に際しては、本剤投与の必要性を十分に検討すること。
また、投与が必要な場合には、次の注意事項に留意すること。[2.2、9.4、9.5参照]
8.1 本剤投与開始前に十分な問診により患者が妊娠していないこと及び妊娠している可能性がないことを確認すること。
8.2 次の事項について、本剤投与開始前に患者に説明すること。
・妊娠中に本剤を服用した場合、胎児に影響を及ぼす可能性があること。
・本剤服用中に妊娠が判明した又は疑われる場合は、直ちに服用を中止すること。
・本剤服用中及び最終服用後4日間における妊娠が判明した又は疑われる場合は、速やかに医師、薬剤師等に相談すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。
動物実験で胎児毒性が報告されている。妊娠ラットの器官形成期にモルヌピラビルを投与した実験において、N-ヒドロキシシチジン(NHC)の臨床曝露量の8倍に相当する用量で催奇形性及び胚・胎児致死が、3倍以上に相当する用量で胎児の発育遅延が認められている。また、妊娠ウサギの器官形成期にモルヌピラビルを投与した実験において、NHCの臨床曝露量の18倍に相当する用量で胎児体重の低値が認められている。[2.2、8.、9.4参照]
本剤の電子添文には、以下のとおり記載されています。
9. 特定の背景を有する患者に関する注意
9.4 生殖能を有する者
妊娠する可能性のある女性には、本剤投与中及び最終投与後4日間において避妊する必要性及び適切な避妊法について説明すること。[2.2、8.、9.5 参照]
本剤の主要代謝物であるNHC(*1)の半減期の最大値(約19時間)(*2)の5倍に相当する期間として設定しました。
一般的に、体内から薬物が消失する時間として、半減期の5倍が目安とされています(1)。
本剤の場合、個々の被験者におけるNHCの半減期の最大値が約19時間なので、4日間が目安となると考えられます。
(*1)NHC: モルヌピラビルの主要代謝物。N-ヒドロキシシチジンの略。
(*2)モルヌピラビル800mgを12時間間隔で反復投与したときのNHCの血中半減期: 1.49~19.1時間
<引用>
(1)改訂2版薬物動態学;高田 寛治;じほう 3-16,2002
本剤を投与中の男性において、避妊の必要はありません。
本剤の電子添文には、以下のとおり記載されています。
9. 特定の背景を有する患者に関する注意
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
ラットの授乳期にモルヌピラビルを投与したとき、出生児の血漿中にNHCが検出されている。ヒト乳汁中への移行の有無及び乳汁産生への影響に関するデータはない。
<引用>
電子添文
【適応外】
小児への投与は適応外です。
本剤のご使用にあたっては電子添文をご確認ください。
本剤の投与は18歳以上の患者に行うことが用法及び用量で規定されています。
本剤は第Ⅲ相試験において18歳以上を対象に有効性・安全性を検討しています。
18歳未満を対象とした臨床試験は実施しておらず、本剤の有効性及び安全性は確立されていません。
投与方法
本剤の電子添文には、以下のとおり記載されています。
6. 用法及び用量
通常、18歳以上の患者には、モルヌピラビルとして1回800 mgを1日2回、5日間経口投与する。
7. 用法及び用量に関連する注意
SARS-CoV-2による感染症の症状が発現してから速やかに投与を開始すること。臨床試験において、症状発現から6日目以降に投与を開始した患者における有効性を裏付けるデータは得られていない。[17.1.1参照]
<引用>
電子添文
SARS-CoV-2のウイルス動態及びモルヌピラビルの作用メカニズムに基づくと、抗ウイルス療法を早期(発症から5日間以内)に行うことで治療後期(5日間超)に行う場合に比べて治療のベネフィットが大きいと考えられるためです(1)(2)。
実際に第Ⅱ/Ⅲ相試験(002試験)において、発症から5日以内にモルヌピラビルを投与した患者群で、5日目以降に投与した患者群と比較してより顕著な抗ウイルス効果が示されました(3)。
このことから症状発症から5日目までの投与が望ましいと考えられますが、実臨床下では正確な発症日時を特定することは困難であると考えられることから、具体的な日数は設けていません(2)。
<引用>
(1)Bernal AJ et al. N Engl J Med. 2022;386(6):509-520.
Supplementary Material/Protocol 6.3.2 Stratification
(2)インタビューフォーム Ⅴ. 治療に関する項目 3.用法及び用量
(3)Merck Briefing Information for the November 30, 2021 Meeting of the Antimicrobial Drugs Advisory Committee
以下を参考の上、服薬指導をお願いします。
・カプセルには腸溶・徐放などの機能は持たせておらず、口腔内でカプセルが崩壊したとしても薬剤の吸収に影響はないと考えられます。
・食事は薬剤の吸収への影響はありませんので(1)、柔らかい食べ物(プリン・アップルソース、服薬ゼリーなど)と投与しても吸収への影響は無いと考えられます。
・臨床試験において、薬剤の味、においに関して特に問題となる情報はありませんでした。
<引用>
(1)電子添文 16. 薬物動態
本剤を脱カプセルや懸濁、簡易懸濁して投与することは、承認された用法ではないため、やむを得ない場合を除き、おすすめしていません(1)。
臨床試験では脱カプセルして調製した懸濁液の経口、経管投与の経験があります(2)。
また、経管投与に関しては米国の添付文書に12F 以上の経鼻胃管 (NG)、経口胃管 (OG)、胃瘻管 (G)、又は14F以上の胃空腸瘻管 (GJ) による投与法の記載があります(3)。
■臨床試験における使用経験
<使用経験:懸濁液の経口投与※>
外国人健康成人での第Ⅰ相試験(P004)、COVID-19患者を対象とした第Ⅱ相試験(P006、P002、P001)ではラゲブリオ® の投与はカプセルあるいは脱カプセルして懸濁液として経口投与されていました(2)。
これらの臨床試験では忍容性は概して良好でした。
なお、薬剤の味、においに関して特に問題となる情報はありませんでした(4)。
また、有効成分(モルヌピラビル)のみを溶解した水溶液と、ラゲブリオ® カプセル製剤(そのまま、あるいは懸濁液)を投与したときの曝露量(AUC)を比較したところ、それらに差はみられませんでした。
脱カプセルした粉末を懸濁せずに直接経口投与した経験はありません。
簡易懸濁法(カプセル剤そのままを微温湯に入れる)での投与経験もありません。
<使用経験:経鼻胃管/経口胃管などで投与※>
外国人入院患者を対象とした臨床試験(001試験)では、カプセルを嚥下できなくなった患者には、本剤の懸濁液を経鼻胃管又は経口胃管などで投与することが許容されていました(5)。
懸濁液を経管投与された5例のNHCの血中濃度は、カプセル製剤(カプセルそのまま、あるいは懸濁液)を経口投与された患者の血中濃度の範囲内であり、投与方法による差は示唆されませんでした(6)。
※承認外の用法・用量を含みます。
本剤のご使用にあたっては電子添文をご確認ください。
本剤の承認された用法及び用量は「通常、18歳以上の患者には、モルヌピラビルとして1回800 mgを1日2回、5日間経口投与する。」です。
<引用>
(1)インタビューフォーム ⅩⅢ. 備考
(2)申請資料概要 2.7.2 2.5.2.1 Population Pharmacokinetic Analysis – End of Phase 2
(3)米国添付文書 [FACT SHEET]
(4)申請資料概要 2.7.4 2 ADVERSE EVENTS
(5)Arribas JR et al. NEJM Evid. 2022;1(2):EVIDoa2100044.
SUPPLEMENTARY MATERIAL protocol
(6)社内資料
本剤を脱カプセルや懸濁、簡易懸濁して投与することは、承認された用法ではないため、やむを得ない場合を除き、おすすめしていません(1)。
臨床試験及び米国添付文書(2)から、参考となる調製方法及び投与方法は以下のとおりです。
<懸濁液の調製(1)>
1) カプセル4個を開け、内容物を蓋付きの清潔な容器に移す。
2) 容器に水40mLを加える。
3) 容器に蓋をして、カプセルの内容物と水を3分間よく振って混ぜる。
[注意]
・カプセルの内容物は完全に溶解しない場合がある。
・調製した混合物には、目に見える未溶解の微粒子が含まれている場合があるが、投与に問題ない。
なお、カプセル内容物はモルヌピラビル(有効成分)が水溶性のため水と混ぜて投与することを推奨します。
懸濁後の安定性データはなく、「何度まで安定か」など安定な温度に関する情報もありません。
懸濁液は用時調製し、作り置きはしないでください。
<投与手順:経口(1)>
1) 調製した懸濁液を投与前に振り混ぜて再混合し、経口投与する。
2) 経口投与後、全ての懸濁液を確実に飲み込むため追加の水を投与可能である。
<投与手順:12F以上の経鼻胃管(NG)、経口胃管(OG)、胃瘻管(G)、又は14F以上の胃空腸瘻管(GJ) (1)>
1) 調製した懸濁液を投与前に振り混ぜ、懸濁液を再混合する。
2) 投与前にチューブを5mLの水で洗い流す。
3) 適切なシリンジを使用して、容器の内容物すべてを吸い上げ、すぐにチューブから投与する。胃空腸瘻チューブを使用する場合は、胃ポートから投与する。
4) 容器内にカプセル内容物が残っている場合は、容器に水10 mLを加えて混ぜ、同じ注射器を使用して容器の内容物をすべて吸い上げ、チューブから投与する。容器又は注射器内にカプセル内容物が残らなくなるまで、必要に応じて繰り返す。
5) 懸濁液を投与した後、チューブを5 mLの水で2回 (合計10 mL) 洗い流す。
【注意!】懸濁液を調製、投与する際には、曝露(すなわち妊婦)のリスクに関する電子添文を参照してください。
なお、モルヌピラビルの極性と低い分配係数[0.46(logD、pH 7)]から皮膚吸収の可能性は低いと考えられます。
※承認外の用法・用量を含みます。
本剤のご使用にあたっては電子添文をご確認ください。
本剤の承認された用法及び用量は「通常、18歳以上の患者には、モルヌピラビルとして1回800 mgを1日2回、5日間経口投与する。」です。
<引用>
(1)インタビューフォーム ⅩⅢ. 備考
(2)米国添付文書 [FACT SHEET]
基本的には、ボトル包装単位での処方が推奨されます。
ただし、無包装安定性試験により、90日まで安定である結果が得られています。
実際のご使用にあたっては、各ご施設でご判断ください。
分包機を用いた一包化は実施した経験はなく、データも無いため、基本的には分包機の使用はおすすめしていません。
なお、臨床試験においては手作業による分包のみ許容されていました。
実際のご使用にあたっては、各ご施設でご判断ください。
決して2回分を一度に飲まないでください。
気がついた時に、1回分を飲んでください。ただし次の飲む時間が近い場合(*)は1回とばして、次の時間に1回分飲んでください(1)。
なお、とばして余った分は服用せずに、添付文書「6. 用法及び用量」に記載のあるとおり、5日間で服用を終了してください。
臨床試験において、5日間を超えた場合の有効性及び安全性は十分には検討されていません。
(*)海外添付文書においては、服用間隔は最低2時間は空けることが規定されています(2)(3)。
<引用>
(1)患者向け医薬品ガイド
(2)米国添付文書 [FACT SHEET]
(3)英国添付文書 [SPC(Summaries of Product Characteristics)]
電子添文上、規定はありませんが、投与間隔は最低2時間は空けるようにしてください。
海外の添付文書には、12時間ごとに投与し、飲み忘れた場合は予定時刻から起算して10時間を目途に忘れた分の対応を決めることが記載されています(1)(2)。
用法及び用量
「ラゲブリオの推奨用量は800mg(200mgカプセルを4つ) を12時間ごとに、5日間経口投与する。」
飲み忘れ
「予定時刻に服用できなかった場合は、予定時刻から起算して10時間以内であれば速やかに1回分を服用し、その後はあらかじめ定めていた時刻に服用を再開する。予定時刻から起算して10時間を超えた場合は、その回は服用せず、次の予定時刻に1回分を服用する。飲み忘れた薬を補うために1度に2回分を服用しないこと。」
<引用>
(1)米国添付文書 [FACT SHEET]
(2)英国添付文書 [SPC(Summaries of Product Characteristics)]
相互作用・併用
電子添文上、「相互作用:併用禁忌、併用注意」の薬剤はありません。
In vitroの試験成績により、モルヌピラビル及びNHC(*)は主要な薬物代謝酵素及びトランスポーターの基質ではなく、また、主要な薬物代謝酵素及びトランスポーターに対する阻害作用又は誘導作用を示さなかったことが確認されました(1)。
(*)NHC: モルヌピラビルの主要代謝物。N-ヒドロキシシチジンの略。
<引用>
(1)電子添文
電子添文上、他のCOVID-19治療薬との併用に関する制限はありません。
厚労省の「新型コロナウイルス感染症(COVID-19)診療の手引き」(1)では、「抗ウイルス薬と中和抗体薬の併用については,十分な知見がなく、各薬剤の供給も限られることから,現時点で併用療法は推奨されない。」と記載されています。
感染症学会の「COVID-19 に対する薬物治療の考え方」(2)では、「薬効の異なる治療薬は併用されうる。」とし、以下のように記載されています。
「軽症患者への抗ウイルス薬と中和抗体薬については、併用に関するリスク及びベネフィットに関する臨床的知見は十分に集積していないこと、需要と供給のバランスから流通に制限が生じうること等を考慮の上、通常、併用療法は推奨されない。これまでの知見においては、高齢者、複数の重症化リスク因子がある患者、ワクチンの未接種者等では症状が進行しやすいことを踏まえ、患者ごとの評価において、中等症への急速な病状の進行等、非典型的な臨床経過の症例や免疫抑制状態などの重症化リスクが特に高い症例等では、併用投与又は逐次投与の適応を考慮する。」
<引用>
(1)厚生労働省:新型コロナウイルス感染症(COVID-19)診療の手引き 第10.1版 (2024年4月23日) 研究班最終報告
(2)日本感染症学会:COVID-19 に対する薬物治療の考え方 第15.1版 (2023年2月14日)
用量調節
腎機能障害患者での用量調節は不要です(1)。
モルヌピラビル及びNHC(*)の主要な消失経路は腎排泄ではないため、腎機能障害がこれらの排泄に影響を及ぼす可能性は低いと考えられます。
(*)NHC: モルヌピラビルの主要代謝物。N-ヒドロキシシチジンの略。
<引用>
(1)インタビューフォーム Ⅶ. 薬物動態に関する項目 10.特定の背景を有する患者 (1)腎機能障害者
透析患者に対する投与制限はありません。
モルヌピラビル及びNHCの主要な消失経路は腎排泄ではないため、 腎機能障害がこれらの排泄に影響を及ぼす可能性は低く(1)、用量調節の必要はないと考えられます。
ただし、重度腎機能障害患者(eGFR 30 mL/min/1.73m2未満)又は透析を必要とする患者に対するモルヌピラビル及びNHCの薬物動態評価は実施していません(1)。
(*)NHC: モルヌピラビルの主要代謝物。N-ヒドロキシシチジンの略。
<引用>
(1)電子添文 16.6.1 腎機能障害患者
肝機能障害患者での用量調節は不要です(1)。
非臨床試験の結果、NHC(*)の主要な消失経路は肝代謝ではないと考えられました。また、モルヌピラビルは主に消化管及び肝臓でNHCへ代謝される一方、モルヌピラビルの加水分解に必要な代謝酵素は広範な組織に分布しているため、肝機能障害がモルヌピラビル及びNHCの曝露量に影響を及ぼす可能性は低いと考えられます。
(*)NHC: モルヌピラビルの主要代謝物。N-ヒドロキシシチジンの略。
<引用>
(1)インタビューフォーム Ⅶ. 薬物動態に関する項目 10.特定の背景を有する患者 (2)肝機能障害者
高齢者での用量調節は不要です。
母集団薬物動態解析の結果、高齢者におけるNHC(*)の薬物動態は若年者と同様でした(外国人データ)(1)。
(*)NHC: モルヌピラビルの主要代謝物。N-ヒドロキシシチジンの略。
<引用>
(1)電子添文 16.6.3 高齢者
ボトルの扱い
ボトルごとの提供が可能です。
本剤は1ボトル 40カプセル包装であり、1人当たりの総投与カプセル量が1ボトルに含まれます。
ボトルは誤開封を防ぐ仕組みとしています。
キャップをしっかり下方向に押しながら左回り(反時計回り)に回してください(1)。
開ける際には指でキャップをしっかりとつかみながら、手のひらでキャップを上から押すと力が入り開けやすくなります。
動画「ラゲブリオ®カプセル200mg~ボトルの開け方~」をご参考ください。
https://www.msdconnect.jp/videos/lagevrio-how-to-open/
患者用小冊子「ラゲブリオ®カプセル200mgを服用する患者さん・ご家族の方へ」に、開閉方法を図示していますのであわせてご参考ください。
https://www.msdconnect.jp/lagevrio-dosing-guide/
<引用>
(1)インタビューフォーム Ⅳ. 製剤に関する項目 10.容器・包装
<開けるとき>
キャップをしっかり下方向に押しながら左回り(反時計回り)に回してください。
開ける際には指でキャップをしっかりとつかみながら、手のひらでキャップを上から押すと力が入り開けやすくなります。
<閉めるとき>
キャップを閉めるときは、押さずに回してください。
このとき、きつく締めすぎないようにしてください。
閉めるときにキャップを押したりきつく締めすぎると、次回以降開けにくくなることがあります。
動画「ラゲブリオ®カプセル200mg~ボトルの開け方~」をご参考ください。
https://www.msdconnect.jp/videos/lagevrio-how-to-open/
ラゲブリオ®のボトルは誤開封を防ぐために特殊な形状となっています。
開かない場合はもう一度、しっかりとキャップをもって下方向に押しながら左回り(反時計回り)に回してください。
開ける際には指でキャップをしっかりとつかみながら、手のひらでキャップを上から押すと力が入り開けやすくなります。
動画「ラゲブリオ®カプセル200mg~ボトルの開け方~」をご参考ください。
https://www.msdconnect.jp/videos/lagevrio-how-to-open/
はがしにくい場合は指等でアルミシートを押し破るようにしてください。
その際、できる限り道具は使わず、怪我やカプセルの破損には十分にご注意ください。
キャップ開封の際、押し回す構造になっているため、ボトル口にあるアルミシールの印字マークの黒インクが擦れてキャップ内側に付着したものと考えられます。
製品の品質に影響はございません。
貯法: 室温保存
有効期間: 48箇月
本剤の電子添文 第8版 (2024年7月改訂)より、有効期間は48箇月となりました。
本改訂以降に出荷されている製品の有効期間は48箇月となり、本改訂以前に出荷された製品はこれまでどおり以下の対応が適用されます。
<有効期間:36箇月への読み替え>
「有効期間:24 箇月」及び「有効期間:30箇月」を前提に使用期限が外箱及びボトルラベルに印字されている製品は、「有効期間:36箇月」に読み変えて使用できます(1)。
なお、有効期間が、24 箇月、30箇月、36箇月を前提に使用期限が外箱及びボトルラベルに印字されている製品を「有効期間: 48箇月」には読み替えません。
<使用期限検索>
当社のホームページ MSDConnectで、使用期限が検索可能ですのでご利用ください。
https://www.msdconnect.jp/product-product-lotnum/
<引用>
(1)厚生労働省のホームページ:治療薬、ワクチン、医療機器、検査キットの開発について
2.現在承認されている治療薬の使用期限について:ラゲブリオカプセル(成分名:モルヌピラビル)
安全性
本剤の電子添文には、以下のとおり記載されています。
8. 重要な基本的注意
妊娠する可能性のある女性への投与に際しては、本剤投与の必要性を十分に検討すること。また、投与が必要な場合には、次の注意事項に留意すること。[2.2、9.4、9.5 参照]
8.1 本剤投与開始前に十分な問診により患者が妊娠していないこと及び妊娠している可能性がないことを確認すること。
8.2 次の事項について、本剤投与開始前に患者に説明すること。
・妊娠中に本剤を服用した場合、胎児に影響を及ぼす可能性があること。
・本剤服用中に妊娠が判明した又は疑われる場合は、直ちに服用を中止すること。
<引用>
電子添文
国際共同第Ⅱ/Ⅲ相試験[MOVe-OUT(002)試験]第Ⅲ相試験パートにおける副作用発現頻度は、ラゲブリオ®800mg群で8.0%(57/710例)であり、主な副作用(発現割合1%以上)は、下痢1.7%、悪心1.4%、浮動性めまい1.0%でした(1)。
本剤の電子添文「11. 副作用」の記載は、以下のとおりです。
11. 副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
アナフィラキシー(頻度不明)
11.2 その他の副作用
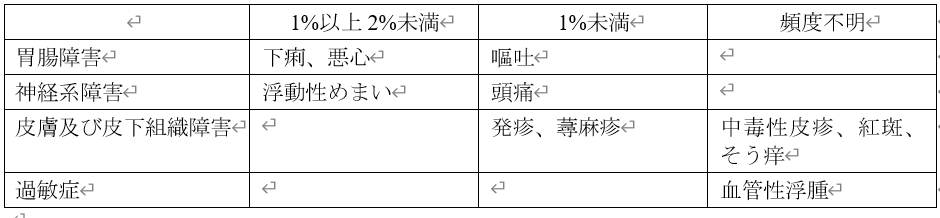
<引用>
(1)電子添文
過量投与の治療に関する情報は得られていません。
過量投与の場合には、標準的な支援、臨床モニタリングを採用し、必要に応じて支持療法を開始してください。
NHC(*)がどの程度透析可能かは不明です(1)。
(*)NHC: モルヌピラビルの主要代謝物。N-ヒドロキシシチジンの略。
<引用>
(1)治験薬概要書 6.2.3 過量投与
その他
同意取得に関する承認条件が解除され(1)、患者さん又は代諾者からの文書による同意取得は不要となりました。
<引用>
(1)厚生労働省 事務連絡(令和5年4月24日): ラゲブリオカプセルの承認条件の取扱いについて
「適格性情報や同意書取扱等についてのチェックリスト」の提出は不要です。
2022年9月15日付事務連絡(1)にて、不要となりました。
<引用>
(1)厚生労働省 事務連絡(令和4年9月15日): 新型コロナウイルス感染症における経口抗ウイルス薬(ラゲブリオ®カプセル)の薬価収載に伴う医療機関及び薬局への配分等について(その3)(周知)
ご注文につきましては、取引特約店にご相談ください。
処方や本剤の提供に際して登録済であるかのご確認やユーザー登録は不要です。
承認時から本剤の有効期間が変更されてきたことに伴い、外箱及びボトルラベルに印字されている使用期限が変更されている場合があります。
厚生労働省から発出された5月22日付事務連絡の「(6)使用期限の確認について」に、「本剤の使用期限が変更されることがあるため、使用期限を迎えて薬剤を廃棄しようとする際には、その前に厚生労働省及び製造販売業者のホームページにて、使用期限を確認し、当該使用期限が到来していることを確認すること。」と記載されています(1)。
新型コロナウイルス感染症治療薬を無駄にせず有効に活用する観点から、延長された使用期限をご確認いただき(2)(3)、引き続き今後の新規投与患者に備えた在庫分として保管をお願いいたします。
<引用>
(1)厚生労働省 事務連絡(2023年5月22日付):新型コロナウイルス感染症における経口抗ウイルス薬(ラゲブリオ®カプセル)の 取扱いについて(所有権の移転および再譲渡)
https://www.mhlw.go.jp/content/001099063.pdf
(2)厚生労働省のホームページ:治療薬、ワクチン、医療機器、検査キットの開発について
2.現在承認されている治療薬の使用期限について:ラゲブリオカプセル(成分名:モルヌピラビル)
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/covid-19tiryouyaku_vaccine.html#h2_free2
(3)MSDConnect:使用期限検索
https://www.msdconnect.jp/product-product-lotnum/
【販売名】ラゲブリオ®カプセル200mg(LAGEVRIO® Capsules 200mg)
【一般名】モルヌピラビル(Molnupiravir)
【特例承認日】2021年12月24日
【承認番号】30300AMX00467000
【日本標準商品分類番号】87625
【薬効分類】内625 抗ウイルス剤
【販売開始日】2021年12月25日
【規制区分】劇薬
処方箋医薬品:注意-医師等の処方箋により使用すること
<薬価基準収載品(※)>
【薬価収載日】2022年8月18日
【薬価基準収載医薬品コード(厚生省コード)】6250051M1028
【個別医薬品コード(YJコード)】6250051M1028
【レセプト電算処理システム用コード(レセプトコード)】628785401
【HOT番号】
HOT-13:1878547010201
HOT-9:187854701
(※)薬価基準収載品は、2022年9月16日(金)に一般流通開始しました。
<政府購買品>
【個別医薬品コード(YJコード・販売名コード)】62500B6M1020
【HOT番号】
HOT-13:1878547010101
HOT-11:18785470101
HOT-9:187854701
HOT-7:1878547