「禁忌を含む注意事項等情報」等
「禁忌を含む注意事項等情報」等
禁忌
2. 禁忌(次の患者には投与しないこと)
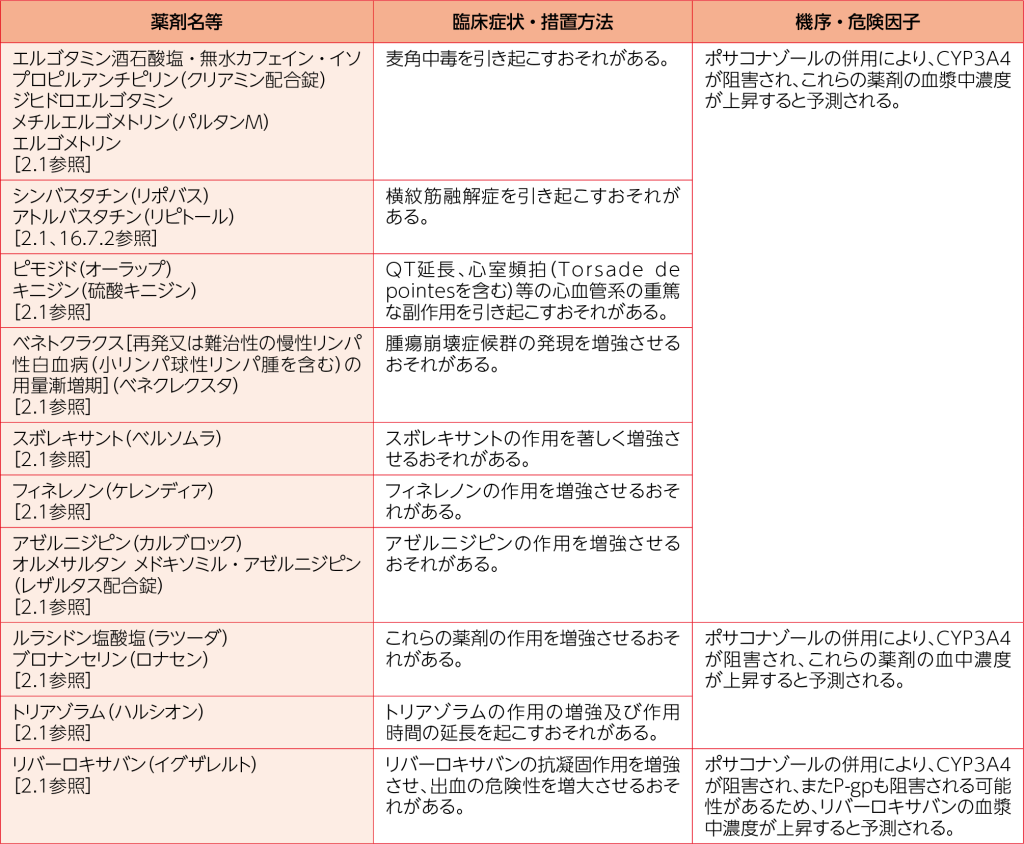
2.1 エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、メチルエルゴメトリン、エルゴメトリン、シンバスタチン、アトルバスタチン、ピモジド、キニジン、ベネトクラクス[再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期]、スボレキサント、フィネレノン、アゼルニジピン、オルメサルタン メドキソミル・アゼルニジピン、ルラシドン塩酸塩、ブロナンセリン、トリアゾラム、リバーロキサバンを投与中の患者[10.1参照]
2.2 本剤の成分に対し過敏症の既往歴のある患者
重要な基本的注意
8. 重要な基本的注意
8.1 肝機能障害があらわれることがあるので、定期的に肝機能検査を行うなど、患者の状態を十分に観察すること。[9.1.2、11.1.1参照]
8.2 QT延長、心室頻拍(Torsade de pointesを含む)があらわれることがあるので、本剤の投与前及び投与中は定期的に心電図検査及び電解質検査(カリウム、マグネシウム、カルシウム等)を行い、必要に応じて電解質を補正すること。[11.1.3参照]
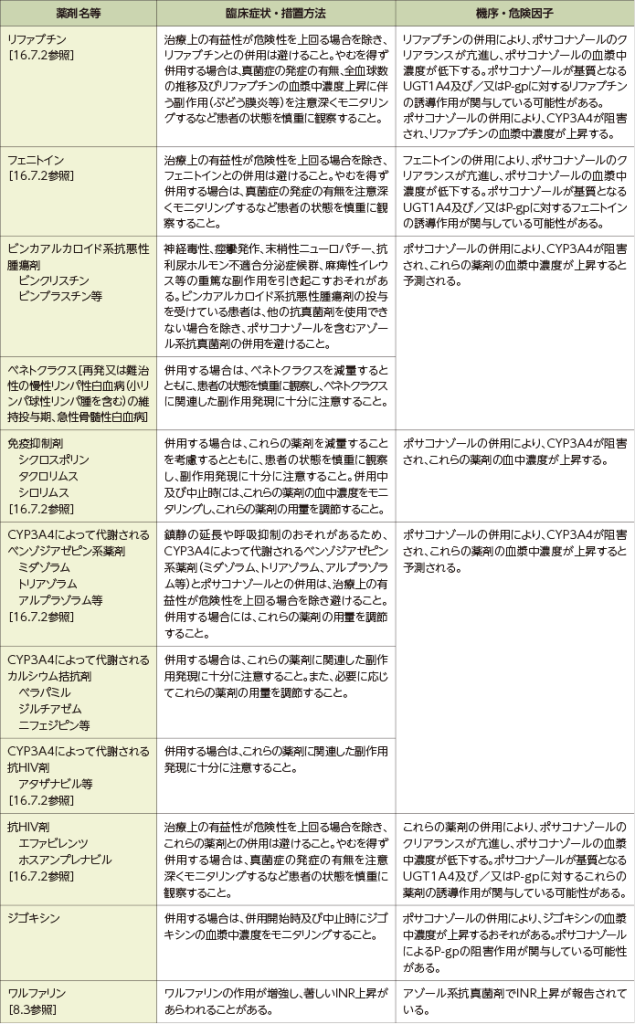
8.3 本剤投与開始にあたっては、あらかじめワルファリン服用の有無を確認し、ワルファリンと併用する場合は、プロトロンビン時間測定及びトロンボテストの回数を増やすなど慎重に投与すること。[10.2参照]
8.4 本剤の投与に際しては、アレルギー歴、薬物過敏症等について十分な問診を行うこと。
特定の背景を有する患者に関する注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 他のアゾール系抗真菌剤に対し薬物過敏症の既往歴のある患者
類似の化学構造を有しており、交差過敏反応を起こすおそれがある。
9.1.2 重篤な基礎疾患(血液悪性腫瘍等)のある患者
重度の肝機能障害が発現し、致死的な転帰をたどるおそれがある。[8.1、11.1.1参照]
9.1.3 体重120kgを超える患者
本剤の投与中は、真菌症の発症の有無を注意深くモニタリングするなど患者の状態を慎重に観察すること。[16.6.1参照]
9.2 腎機能障害患者
錠100mg
9.2.1 重度(eGFR<20mL/min/1.73m2)の腎機能障害のある患者
本剤の投与中は、真菌症の発症の有無を注意深くモニタリングするなど患者の状態を慎重に観察すること。本剤の曝露量が大きくばらつくおそれがある。[16.6.2参照]
点滴静注300mg
9.2.1 中等度以上(eGFR<50mL/min/1.73m2)の腎機能障害のある患者
治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。投与する場合には血清クレアチニン値を観察し、上昇が認められた場合には錠剤への切り替えを考慮すること。添加剤スルホブチルエーテルβ-シクロデキストリンナトリウムが蓄積し、腎機能障害を悪化させるおそれがある。[7.1参照]
9.2.2 重度(eGFR<20mL/min/1.73m2)の腎機能障害のある患者
本剤の投与中は、真菌症の発症の有無を注意深くモニタリングするなど患者の状態を慎重に観察すること。本剤の曝露量が大きくばらつくおそれがある。[16.6.2参照]
9.4 生殖能を有する者
妊娠可能な女性に対しては、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ラットにおいて、臨床曝露量(AUC)と同程度の曝露量で、分娩障害、出生児数の減少、生存率低下、催奇形性が認められた。ウサギでは、臨床曝露量(AUC)を上回る曝露量で、吸収胚の増加及び胎児数の減少が認められた。[9.4参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラットで乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした国内臨床試験は実施していない。
相互作用
10. 相互作用
ポサコナゾールは主にUDP-グルクロノシルトランスフェラーゼ(UGT)1A4を介して代謝され、P-糖蛋白(P-gp)の基質である。また、CYP3A4を強く阻害する。腸管ではP-gpを阻害する可能性がある。[16.4、16.7.1参照]
10.1 併用禁忌(併用しないこと)
10.2 併用注意(併用に注意すること)
副作用
11. 副作用
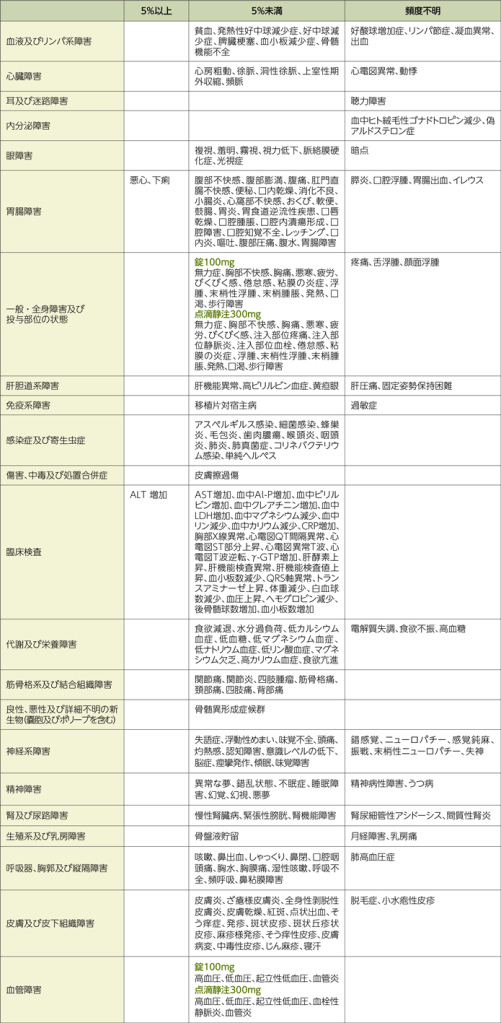
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
11.1.1 肝機能障害
重度の肝機能異常(0.6%)、胆汁うっ滞(0.4%)、肝毒性(0.2%)、黄疸(0.1%)、胆汁うっ滞性肝炎、肝不全、肝炎(いずれも頻度不明)があらわれることがある。[8.1、9.1.2参照]
11.1.2 溶血性尿毒症症候群(HUS)、血栓性血小板減少性紫斑病(TTP)(いずれも頻度不明)
11.1.3 QT 延長(1.4%)、心室頻拍(Torsade de pointes を含む)(頻度不明)[8.2参照]
11.1.4 副腎機能不全(0.1%)
11.1.5 低カリウム血症(4.7%)
11.1.6 皮膚粘膜眼症候群(Stevens-Johnson 症候群)(頻度不明)
11.1.7 脳血管発作(頻度不明)
11.1.8 急性腎障害(0.4%)、腎不全(0.2%)
11.1.9 汎血球減少症(0.1%)、白血球減少症(頻度不明)
11.2 その他の副作用
過量投与
13. 過量投与
ポサコナゾールは血液透析で除去されない。[16.6.2参照]
適用上の注意
14. 適用上の注意
錠100mg
14.1 薬剤交付時の注意
14.1.1 本剤は腸溶錠であり、服用にあたっては、分割したり、砕いたり、噛んだりせずに、飲みくだすよう患者に指導すること。
14.1.2 PTP包装の薬剤はPTP シートから取り出して服用するよう指導すること。PTP シートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
点滴静注300mg
14.1 薬剤調製時の注意
14.1.1 本剤は静脈内投与の前に希釈すること。
14.1.2 バイアルを室温に戻した後、バイアルから16.7mL抜き取り、150~283mLの生理食塩液又は5%ブドウ糖注射液が入った点滴バッグ又はボトルに添加し、最終濃度を1~2mg/mLとする。
14.1.3 以下の希釈液とは配合変化を起こすので使用しないこと。
乳酸リンゲル液、5%ブドウ糖加乳酸リンゲル液、4.2%炭酸水素ナトリウム注射液
14.1.4 本剤は保存剤を含まないため、希釈後は速やかに使用すること。速やかに使用しない場合は、冷蔵保存(2~8℃)し、24時間以内に使用すること。1回使い切りであり、残液は廃棄すること。
14.1.5 本剤を希釈後、投与する前に目視で異物がないか確認すること。希釈後の溶液は無色~微黄色である。溶液に異物や変色があった場合は使用しないこと。
14.2 薬剤投与時の注意
14.2.1 本剤の急速静注は行わないこと。
14.2.2 治療上やむを得ないと判断される場合を除き、他の薬剤を同一の輸液ラインを通して同時に注入しないこと。やむを得ず他の薬剤を同一の輸液ラインから同時注入する場合には、配合変化を起こさない薬剤を用いること。
その他の注意
15. その他の注意
錠100mg
15.2 非臨床試験に基づく情報
15.2.1 幼若イヌの生後2~8週に静脈内投与した試験において、側脳室拡張の発現頻度の増加がみられたが、5ヵ月の休薬後には本所見の発現頻度の増加は認められなかった。本所見がみられたイヌでは、神経系、行動又は発達に異常は認められなかった。また、幼若イヌの生後4日~9ヵ月に経口投与した試験では、脳に同様の所見は観察されなかった。
15.2.2 ラットに臨床曝露量(AUC)の2.4倍以上の曝露量で投与したところ、副腎の皮質腺腫及び癌並びに褐色細胞腫が増加した。ラットの副腎皮質腫瘍は、副腎皮質ステロイドの慢性的な産生抑制に続く内分泌系のかく乱と整合するものである。また、褐色細胞腫の増加は、カルシウムホメオスタシスの変化に続発するラット特有の現象であると考えられている。ポサコナゾールを投与したヒトでは、カルシウムホメオスタシスの変化や副腎腫瘍は報告されていない。
点滴静注300mg
15.1 臨床使用に基づく情報
ポサコナゾールを末梢静脈内に単回又は反復投与したときの安全性について、以下の臨床試験成績が報告されている。
- 外国人健康成人9例にポサコナゾール静注液200mgを90分間かけて単回末梢静脈内投与したとき、注入部位反応が67%(6/9例)で認められた(P04985試験)。
- 外国人健康成人にポサコナゾール静注液(50、100、200、250及び300mg用量:各9例)を30分間かけて単回末梢静脈内投与したとき、血栓性静脈炎が4%(2/45例)、注入部位反応が16%(7/45例)で認められた(P06356試験パート1)。
- 外国人健康成人13例にポサコナゾール静注液300mgを30分間かけて単回末梢静脈内投与したとき、血栓性静脈炎が7%(1/13例)で認められた(P07783試験パート1)。
- 外国人健康成人5例にポサコナゾール静注液100mgを30分間かけて1日1回(初日のみ1日2回)、10日間反復末梢静脈内投与したとき、血栓性静脈炎が60%(3/5例)、注入部位反応が80%(4/5例)で認められた(P06356試験パート2)。
15.2 非臨床試験に基づく情報
15.2.1 幼若イヌの生後2~8週に静脈内投与した試験において、側脳室拡張の発現頻度の増加がみられたが、5ヵ月の休薬後には本所見の発現頻度の増加は認められなかった。本所見がみられたイヌでは、神経系、行動又は発達に異常は認められなかった。また、幼若イヌの生後4日~9ヵ月に経口投与した試験では、脳に同様の所見は観察されなかった。
15.2.2 ラットに臨床曝露量(AUC)の2.4倍以上の曝露量で投与したところ、副腎の皮質腺腫及び癌並びに褐色細胞腫が増加した。ラットの副腎皮質腫瘍は、副腎皮質ステロイドの慢性的な産生抑制に続く内分泌系のかく乱と整合するものである。また、褐色細胞腫の増加は、カルシウムホメオスタシスの変化に続発するラット特有の現象であると考えられている。ポサコナゾールを投与したヒトでは、カルシウムホメオスタシスの変化や副腎腫瘍は報告されていない。