DRIVE-AHEAD試験
本剤は海外での臨床試験成績をもとに承認されたため、国内での臨床試験は実施していません。
DRIVE-AHEAD試験で投与したDOR/3TC/TDF(ドラビリン/ラミブジン/テノホビル ジソプロキシルフマル酸塩)配合剤※1およびEFV/FTC/TDF(エファビレンツ/エムトリシタビン/テノホビル ジソプロキシルフマル酸塩)配合剤※2は、いずれも国内未承認薬ですが、承認時評価資料であることからデータを掲載しています。これらの各成分の国内承認用法および用量については本ページ注釈または各製品添付文書をご参照ください。
DRIVE-AHEAD試験
承認時評価資料
治療未経験HIV-1感染患者を対象とした海外第Ⅲ相二重盲検比較試験(海外データ)5)6)
[目的]
治療未経験HIV-1感染患者を対象に、ドラビリン/ラミブジン/テノホビル ジソプロキシルフマル酸塩の配合剤 (DOR/3TC/TDF)※1の有効性を、エファビレンツ/エムトリシタビン/テノホビル ジソプロキシルフマル酸塩の配合剤(EFV/FTC/TDF)※2と比較検証し、あわせて安全性を検討する。
[試験デザイン]
多施設共同、無作為化、二重盲検、実薬対照第Ⅲ相、非劣性検証試験

[対象]
抗HIV薬による治療経験のない18歳以上のHIV-1感染患者(HIV-1 RNA量≧1,000copies/mL)728例(試験薬投与例)
[方法]
対象患者を、スクリーニング時のHIV-1 RNA量(≦100,000copies/mL vs >100,000copies/mL)およびB型またはC型肝炎感染の有無で層別し、DOR/3TC/TDF(DOR 100mg/3TC 300mg/TDF 300mg)群またはEFV/FTC/TDF(EFV 600mg/FTC 200mg/TDF 300mg)群に無作為に割付け、96週間治療を行った。
[評価項目]
主要評価項目:48週時におけるHIV-1 RNA量<50copies/mLの患者の割合
副次評価項目:96週時におけるHIV-1 RNA量<50copies/mLの患者の割合
48および96週時におけるHIV-1 RNA量<40copies/mLの患者の割合
48および96週時におけるCD4陽性リンパ球数のベースラインからの変化量 等
探索的評価項目:HIV-1 RNA量<200copies/mLの患者の割合、抗ウイルス薬耐性の発現 等
安全性評価項目:副作用、48週時におけるLDLコレステロールおよびNon-HDLコレステロールのベースラインからの変化量 等
[解析計画]
有効率の群間差の95%CIは、各層で投与群あたりの症例数の調和平均により重み付けした差を用いた層補正Mantel-Haenszel法により算出した。CD4陽性リンパ球数の平均変化量の差の95%CIは、t分布に基づいて求めた。
主要評価項目について、群間差(DOR/3TC/TDF群-EFV/FTC/TDF群)の95%CIの下限値が-10%を上回る場合に、EFV/FTC/TDF群に対するDOR/3TC/TDF群の非劣性が検証されるとした。主要評価項目について、ベースライン時のHIV-1 RNA量(>100,000または≦100,000copies/mL)別にサブグループ解析を実施した。また、その他のベースライン時の患者背景因子別にサブグループ解析を実施した。
有効性
■48週時における有効率(主要評価項目)
48週時においてHIV-1 RNA量<50copies/mLを達成した患者の割合は、DOR/3TC/TDF群84.3%、EFV/FTC/TDF群80.8%であり[群間差(95%CI)3.5(-2.0, 9.0)%]、DOR/3TC/TDF群のEFV/FTC/TDF群に対する非劣性が検証されました。
HIV-1 RNA量<50copies/mLを達成した患者の割合の推移a(主要評価項目:48週時) 5)6)
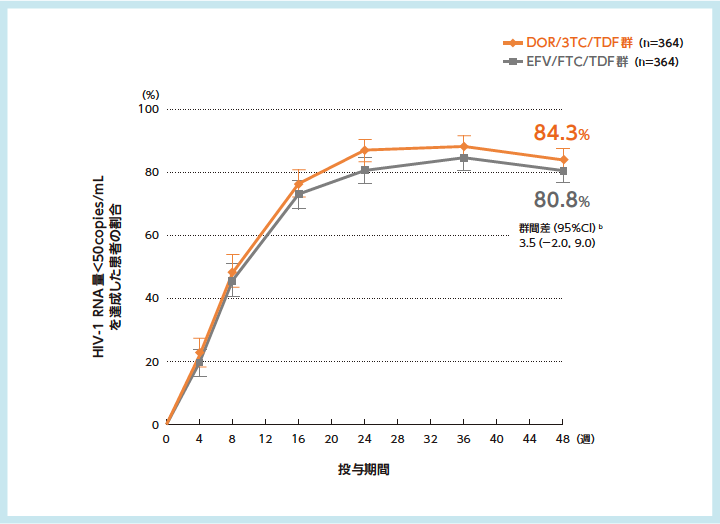
a:FDA Snapshot法:理由を問わず、試験の中止を含めて全てのデータ欠損を治療失敗として扱った。
b:群間差の95%CIは、各層で投与群当たりの症例数の調和平均により重み付けした差を用いた層補正Mantel-Haenszel法により算出した。群間差(DOR/3TC/TDF群-EFV/FTC/TDF群)の95%CIの下限値が-10%を上回る場合に、EFV/FTC/TDF群に対するDOR/3TC/TDF群の非劣性が検証されるとした。
DOR/3TC/TDF群は、ベースライン時のHIV-1 RNA量にかかわらず、ウイルス学的抑制効果を示しました。
HIV-1 RNA量<50copies/mLを達成した患者の割合a(主要評価項目、サブグループ解析:48週時) 5)
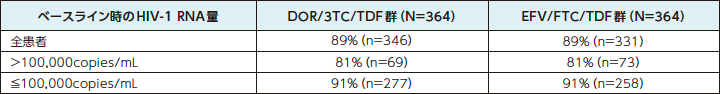
a:Observed Failure法:効果不十分のために試験薬投与を早期に中止し、欠測値[投与期間中に断続的に生じる欠測値を除く]のある症例を治療失敗例として扱った。
n:各カテゴリーに該当した患者数
■48週時および96週時におけるウイルス学的抑制および免疫学的効果(主要評価項目および副次評価項目)
DOR/3TC/TDF群の48週時および96週時におけるウイルス学的抑制および免疫学的効果は、以下のとおりでした。
ウイルス学的抑制および免疫学的効果(48週時および96週時)6)
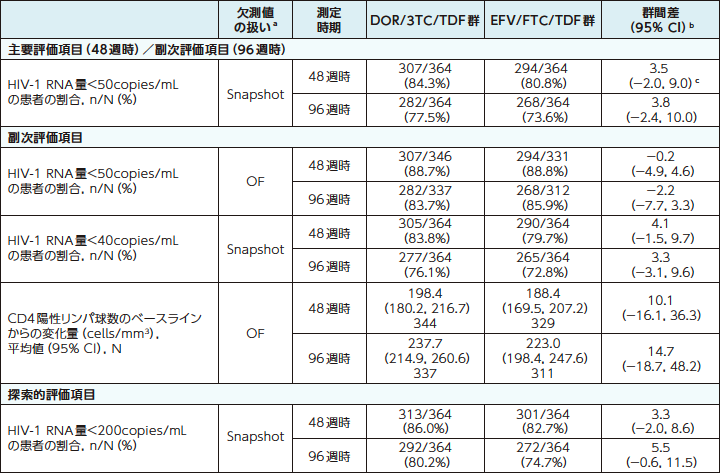
a:Snapshot:FDA Snapshot法:理由を問わず、試験の中止を含めて全てのデータ欠損を治療失敗として扱った。
OF:Observed Failure法:効果不十分のために試験薬投与を早期に中止し、欠測値[投与期間中に断続的に生じる欠測値を除く]のある症例を治療失敗例として扱った。
b:群間差の95%CIは各層で投与群当たりの症例数の調和平均により重み付けした差を用いた層補正Mantel-Haenszel法により算出した。CD4陽性リンパ球数の平均変化量の差の95%CIは、t分布に基づいて求めた。
C:群間差(DOR/3TC/TDF群-EFV/FTC/TDF群)の95%CIの下限値が-10%を上回る場合に、EFV/FTC/TDF群に対するDOR/3TC/TDF群の非劣性が検証されるとした。
安全性
■ 副作用
96週までの副作用発現率は、DOR/3TC/TDF 群で31.9%(116/364例)、EFV/FTC/TDF群で64.8%(236/364例)でした。
DOR/3TC/TDF群の主な副作用は、浮動性めまい25例(6.9%)、悪心18例(4.9%)および異常な夢18例 (4.9%)でした。 EFV/FTC/TDF群の主な副作用は、浮動性めまい117例(32.1%)、異常な夢37例(10.2%)および発疹31例 (8.5%)でした。
試験薬と関連のある死亡は、両群ともに認められませんでした。
重篤な副作用は、DOR/3TC/TDF群で無力症、不眠症および悪夢が各1件1例、EFV/FTC/TDF群で高トリグリセリド血症、全身性皮疹、斑状皮疹、斑状丘疹状皮疹が各1例の計4例でした。
試験薬の投与中止に至った副作用は、DOR/3TC/TDF群の8例で脱毛症、疲労、注意力障害、うつ病、上腹部痛、 適応障害、嘔吐、無力症、不眠症、悪夢、腎障害およびビタミンD欠乏が各1件、EFV/FTC/TDF群の24例で全身性皮疹3件、発疹3件、浮動性めまい2件、不安2件、多形紅斑、紅斑性皮疹、不眠症、神経毒性、注意力障害、 そう痒性皮疹、斑状皮疹、うつ病、疲労、異常な夢、下腹部痛、悪心、抑うつ気分、睡眠障害、斑状丘疹状皮疹、頭痛、 傾眠、パーソナリティ障害および薬物過敏症が各1件でした。
■[参考情報]脂質プロファイルへの影響(48週時)
48週時におけるLDLコレステロールおよびNon-HDLコレステロールのベースラインからの変化量は、DOR/3TC/TDF群で-1.6および-3.8mg/dL、EFV/FTC/TDF群でそれぞれ8.7および13.3mg/dLでした。
空腹時脂質のベースラインからの変化量(安全性評価項目:48週時)6)
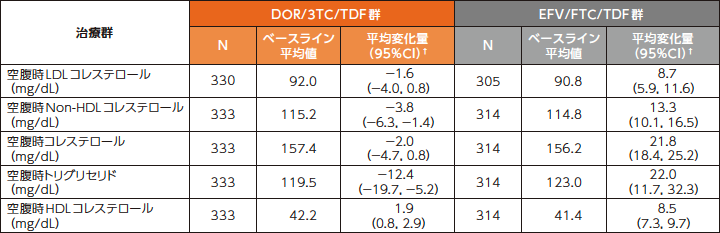
欠測値は、Last Observation Carried Forward(LOCF)法を用いて補完した。
†:群内の95%CIはt分布に基づいた。
ベースライン後データは、試験薬の投与開始から最終投与の14日後までの測定結果を対象とした。
N :ベースライン後の検査結果が1つ以上得られた患者の数
※1 DOR/3TC/TDF配合剤は、ドラビリン100mg/ラミブジン300mg/テノホビル ジソプロキシルフマル酸塩300mgを含有する製剤で、国内未承認です。
各成分の国内承認用法および用量(各製品添付文書より):
・ドラビリン:通常、成人にはドラビリンとして100mgを1日1回経口投与する。本剤は、食事の有無にかかわらず投与できる。投与に際しては、必ず他の抗HIV薬と併用すること。
・ラミブジン:通常、成人には他の抗HIV薬と併用して、ラミブジンとして1日量300mgを1日1回又は2回(150mg×2)に分けて経口投与する。なお、年齢、体重、症状により適宜増減する。
・テノホビル ジソプロキシルフマル酸塩:通常、成人にはテノホビル ジソプロキシルフマル酸塩として1回300mg(テノホビル ジソプロキシルとして245mg)を1日1回経口投与する。 なお、投与に際しては必ず他の抗HIV薬と併用すること。
※2 EFV/FTC/TDF配合剤は、エファビレンツ600mg/エムトリシタビン200mg/テノホビル ジソプロキシルフマル酸塩300mgを含有する製剤で、国内未承認です。
各成分の国内承認用法および用量(各製品添付文書より):
・エファビレンツ:通常、成人にはエファビレンツとして600mgを1日1回経口投与する。本剤は、食事の有無にかかわらず投与できる。なお、投与に際しては必ず他の抗HIV薬と併用すること。
・エムトリシタビン:通常、成人にはエムトリシタビンとして1回200mgを1日1回経口投与する。なお、投与に際しては必ず他の抗HIV薬と併用すること。
・テノホビル ジソプロキシルフマル酸塩:通常、成人にはテノホビル ジソプロキシルフマル酸塩として1回300mg(テノホビル ジソプロキシルとして245mg)を1日1回経口投与する。 なお、投与に際しては必ず他の抗HIV薬と併用すること。
【禁忌を含む使用上の注意】 等はこちらをご参照ください。
5) Orkin C, et al. Clin Infect Dis 2019; 68(4): 535-544
(利益相反:Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.が資金提供。
共著者のLupinacci、Rodgers、Xu、Lin、Kumar、Sklar、Nguyen、Hanna、Hwang、MartinはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.の社員。)
6) 承認時評価資料(海外第Ⅲ相試験:DRIVE-AHEAD試験)