2回目接種データ
2回目接種時の免疫原性と安全性
高齢者に対し、23価肺炎球菌ワクチンを2回まで接種した際のIgG抗体価および局所・全身反応(初回接種群・再接種群)
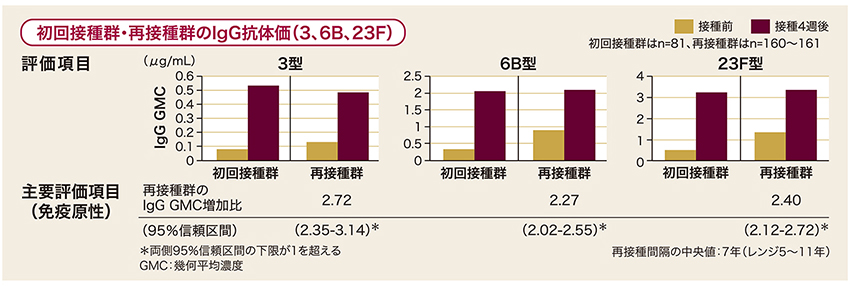
23価肺炎球菌ワクチン※再接種4週後の血清型3、6B、23FのIgG抗体価は、接種前と比較して有意に上昇しました。
局所反応の頻度は、再接種群70.2%、初回接種群50.6%と、再接種群の方が高い結果でした。全身の副反応(発熱、 下痢、倦怠感、上咽頭炎、浮動性めまい、等)の頻度は、再接種群26.1%、初回接種群19.8%でした。
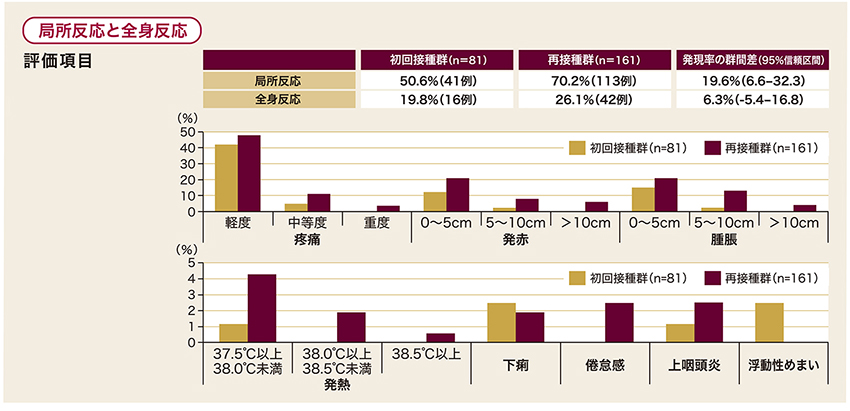
ワクチンに関連した重篤な有害事象:再接種群における軽度の発熱、重度のヘルペスウイルス感染症、各1件。 試験期間中に、死亡例またはワクチンに関連した有害事象による中止例は認められなかった。

※国内ではニューモバックス(旧製剤) ® 及びニューモバックス®NP(現行製剤)を含みます。製法変更等に係る承認申請を経て、2006年から現行製剤が販売され、旧製剤は販売中止となりました。両製剤を比較した国内臨床試験では、抗体価上昇の観点から同等の抗原性を示すワクチンであることが確認されています(審査報告書,IV総合評価)。
Kawakami K. et.al. Vaccine. 2016; 34: 3875-3881.より作図
ニューモバックス®NPシリンジの「重要な基本的注意」(抜粋)
8. 重要な基本的注意(抜粋)
8.4 過去5年以内に、多価肺炎球菌莢膜ポリサッカライドワクチンを接種されたことのある者では、本剤の接種により注射部位の疼痛、紅斑、硬結等の副反応が、初回接種よりも頻度が高く、程度が強く発現すると報告されている1)、2)。本剤の再接種を行う場合には、再接種の必要性を慎重に考慮した上で、前回接種から十分な間隔を確保して行うこと。[9.1.7 参照]
1) Borgono JM, et al. Proc Soc Exp Biol Med. 1978; 157: 148-54.
2) Musher DM, et al. J Infect Dis. 2010; 201: 516-24.