警告・禁忌を含む注意事項等情報
警告・禁忌を含む注意事項等情報
「警告・禁忌を含む注意事項等情報」に関する製品電子添文の改訂には十分ご留意ください。
警告
1. 警告
〈同種造血幹細胞移植〉
同種造血幹細胞移植患者の感染管理に十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例のみに投与すること。
禁忌
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 次の薬剤を投与中の患者:ピモジド、エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、メチルエルゴメトリン、エルゴメトリン[10.1参照]
重要な基本的注意
8. 重要な基本的注意
点滴静注240mg
長期間に亘り点滴静注製剤を継続して使用する場合には、添加剤ヒドロキシプロピル-β-シクロデキストリンの蓄積により腎機能障害の悪化等を引き起こすおそれがあるため、定期的に腎機能検査を実施する等観察を十分に行うこと。[15.2.2参照]
特定の背景を有する患者に関する注意
9. 特定の背景を有する患者に関する注意
点滴静注240mg
9.2. 腎機能障害患者
9.2.1 中等度又は重度(クレアチニンクリアランス<50mL/min)の腎機能障害のある患者
定期的に腎機能検査を実施する等観察を十分に行うこと。添加剤ヒドロキシプロピル-β-シクロデキストリンの蓄積により腎機能障害の悪化等を引き起こすおそれがある。[15.2.2参照]
錠240mg 顆粒分包20mg・120mg 点滴静注240mg
9.3 肝機能障害患者
9.3.1 重度(Child-Pugh分類C)の肝機能障害のある患者
レテルモビルの血漿中濃度が上昇するおそれがある。[7.4、16.6.2参照]
9.4 生殖能を有する者
妊娠可能な女性に対しては、本剤が胎児に悪影響を及ぼす可能性があることを十分に説明し、本剤投与中及び本剤投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
錠240mg 顆粒分包20mg・120mg
妊婦又は妊娠している可能性のある女性には、本剤投与の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠中に本剤を投与するか、本剤投与中の患者が妊娠した場合は、本剤投与による催奇形性等が生じる可能性があることについて、患者に十分説明すること。
妊娠ラット及びウサギの器官形成期に投与したとき、成人同種造血幹細胞移植患者の臨床曝露量(シクロスポリン併用下での240mg経口投与)のそれぞれ18倍及び2.8倍の母動物毒性を示す用量で骨格奇形、胎児体重の減少等が認められた。妊娠ラットに着床から分娩後まで投与した試験では、臨床曝露量の3.7倍まで胚・胎児毒性は認められなかった。[9.4参照]
点滴静注240mg
妊婦又は妊娠している可能性のある女性には、本剤投与の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠中に本剤を投与するか、本剤投与中の患者が妊娠した場合は、本剤投与による催奇形性等が生じる可能性があることについて、患者に十分説明すること。
妊娠ラット及びウサギの器官形成期に投与したとき、成人同種造血幹細胞移植患者の臨床曝露量(480mg静脈内投与)のそれぞれ11倍及び1.7倍の母動物毒性を示す用量で骨格奇形、胎児体重の減少等が認められた。妊娠ラットに着床から分娩後まで投与した試験では、臨床曝露量の2.2倍まで胚・胎児毒性は認められなかった。[9.4参照]
錠240mg 顆粒分包20mg・120mg 点滴静注240mg
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物試験(ラット)で乳汁移行が認められている1)。
9.7 小児等
〈臓器移植〉
小児等を対象とした臨床試験は実施していない。
相互作用
10. 相互作用
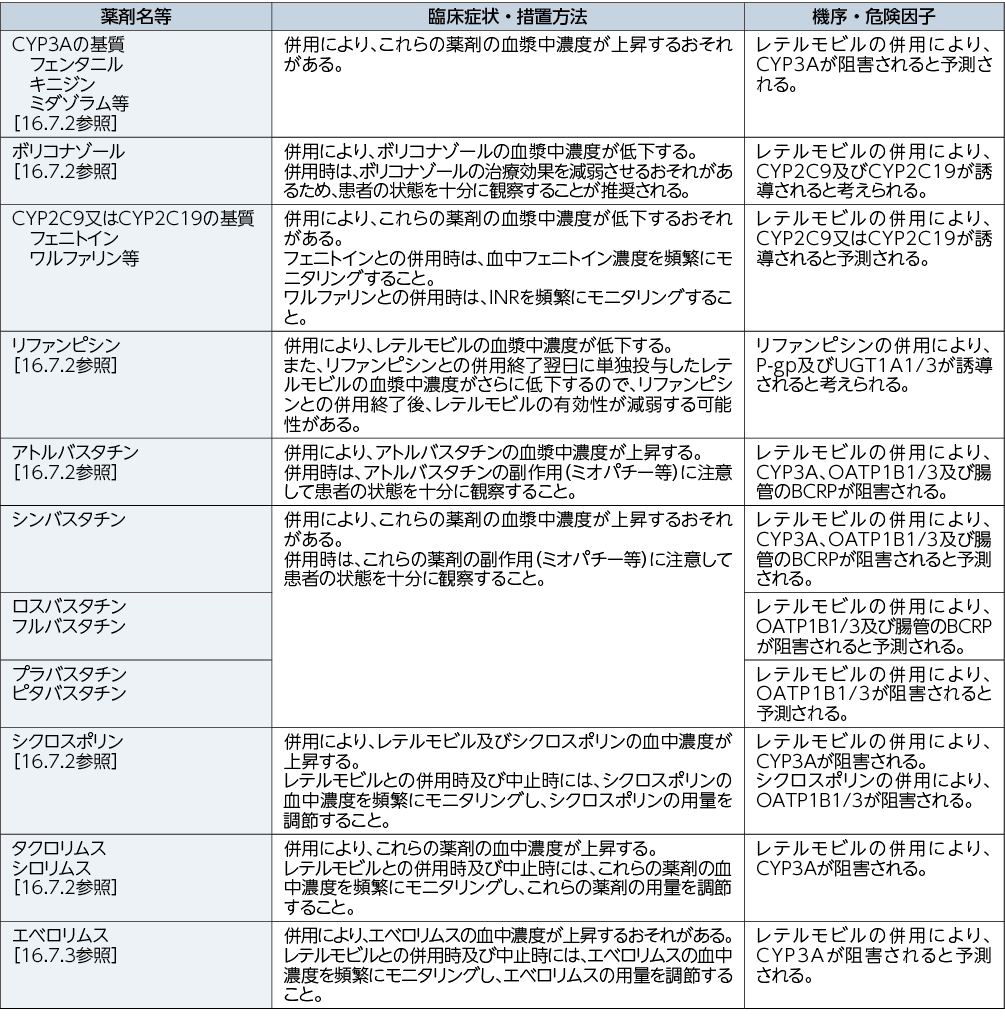
レテルモビルは有機アニオン輸送ポリペプチド1 B 1 / 3(OATP1B1/3)、P-糖蛋白(P-gp)及びUDP-グルクロノシルトランスフェラーゼ1A1/3(UGT1A1/3)の基質である。レテルモビルはCYP3Aの時間依存的な阻害作用、並びに乳癌耐性蛋白(BCRP)及びOATP1B1/3の阻害作用を有する。また、レテルモビルはCYP2C9及びCYP2C19の誘導作用を有する可能性がある。[16.7.1参照]
10.1 併用禁忌(併用しないこと)

10.2 併用注意(併用に注意すること)
適用上の注意
14. 適用上の注意
錠240mg 顆粒分包20mg・120mg
14.1 薬剤交付時の注意
〈錠剤〉
14.1.1 PTPシートのまま保存し、服用直前にPTPシートから取り出すよう指導すること。
14.1.2 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
〈顆粒剤〉
14.1.3 スティックパックのまま保存し、服用直前にスティックパックから取り出すよう指導すること。
14.1.4 本剤は軟らかい食品に混ぜて経口投与することが望ましい。また、経口投与が困難な場合は経鼻又は胃瘻チューブを介して投与できる。患者又は保護者等に対し、患者用説明文書を参照するよう指導すること。
- 経鼻又は胃瘻チューブを介して投与する場合、本剤を室温の液体注)が入った容器に入れて10分程度静置する。顆粒が崩壊した後にシリンジで混合して、全量をシリンジ、及び経鼻又は胃瘻チューブを用いて投与する。
- その後、容器やシリンジを室温の液体注)ですすぎ、すすいだ全量をシリンジ、及び経鼻又は胃瘻チューブを用いて投与する。
- 最後に、経鼻又は胃瘻チューブに水を流して投与する。
注)胃瘻チューブを介して投与する場合、チューブ内に本剤が残存する可能性があるため、水の使用は推奨されない。
点滴静注240mg
14.1 薬剤調製時の注意
14.1.1 希釈前に、変色や不溶性異物がないか、各バイアルを確認すること。本剤は無色澄明の溶液である。また、製品由来の少量の半透明又は白色の微粒子を含むことがある。バイアル内の溶液に変色や濁り、又は異物(少量の半透明又は白色の微粒子以外)が認められた場合は使用しないこと。バイアルを振盪しないこと。
14.1.2 バイアルから溶液を採取して日局生理食塩液又は日局5%ブドウ糖注射液が入った点滴バッグに添加し、振盪せず静かに混和すること。
60~480mgを投与する場合、バイアルからの採取液量、点滴バッグの液量は以下を参照し、点滴バッグの総液量を投与すること。

40mgを投与する場合、1バイアル(レテルモビル濃度20mg/mL)から5mLを採取し、45mLの日局生理食塩液又は日局5%ブドウ糖注射液が入った点滴バッグに添加し、振盪せず静かに混和すること。当該希釈液を20mL投与すること。
14.1.3 本剤のバイアルは1回使い切りである。残液は使用しないこと。
14.1.4 混和後、本剤の希釈液は無色~黄色澄明の溶液となる。投与前の希釈液に変色や不溶性異物がないか目視により確認すること。変色や濁り、又は異物(少量の半透明又は白色の微粒子以外)が認められる場合には、希釈液を廃棄すること。
14.1.5 希釈液は、室温保存(2~30℃)では24時間以内に、冷蔵保存(2~8℃)した場合は48時間以内に使用すること。なお、これらの時間には点滴終了までの時間が含まれる。
14.2 配合変化
本剤は他剤と配合したとき、濁りや不溶性異物が生じることがある。配合適性についてはデータが限られているが、次の薬剤は配合禁忌であり、同一の輸液ラインを通して同時に注入しないこと。
主な配合禁忌薬剤:アミオダロン塩酸塩、アムホテリシンBリポソーム、アズトレオナム、セフェピム塩酸塩、シプロフロキサシン、シクロスポリン、ジルチアゼム塩酸塩、フィルグラスチム(遺伝子組換え)、ゲンタマイシン硫酸塩、レボフロキサシン、リネゾリド、ミダゾラム、オンダンセトロン塩酸塩、パロノセトロン塩酸塩
14.3 薬剤投与時の注意
14.3.1 必ず0.2μmインラインフィルター(ポリエーテルスルホン、ポリスルホン又は正荷電ナイロン製)を使用して投与すること。
14.3.2 本剤はポリウレタンを含有する輸液チューブで投与しないこと。
その他の注意
15. その他の注意
15.2 非臨床試験に基づく情報
錠240mg 顆粒分包20mg・120mg
動物試験(ラット)において、成人同種造血幹細胞移植患者の臨床曝露量(シクロスポリン併用下での240mg経口投与)の3倍以上の曝露量で精巣毒性(精細管の変性、精子数の低値、精子の運動性低下、異常精子発現率の増加、受胎能への影響等)が認められた。ラット精巣毒性に対する無毒性量での曝露量は、臨床曝露量と同程度であった。雄マウス及びサルでは、動物における最高用量(臨床曝露量のそれぞれ5.7倍及び3.5倍)まで精巣への影響は認められなかった。第Ⅲ相試験ではレテルモビルに関連した精巣毒性を示唆する所見は認められなかった。
点滴静注240mg
15.2.1 動物試験(ラット)において、成人同種造血幹細胞移植患者の臨床曝露量(480mg静脈内投与)の3倍以上の曝露量で精巣毒性(精細管の変性、精子数の低値、精子の運動性低下、異常精子発現率の増加、受胎能への影響等)が認められた。ラット精巣毒性に対する無毒性量での曝露量は、臨床曝露量と同程度であった。雄マウス及びサルでは、動物における最高用量(臨床曝露量のそれぞれ3.5倍及び2.1倍)まで精巣への影響は認められなかった。第Ⅲ相試験ではレテルモビルに関連した精巣毒性を示唆する所見は認められなかった。
15.2.2 添加剤であるヒドロキシプロピル-β-シクロデキストリンをラット及びイヌへ静脈内投与すると50mg/kgを超える用量で腎臓及び膀胱の空胞化等の生理学的な適応性変化を引き起こすことが報告されている2)。
15.2.3 添加剤であるヒドロキシプロピル-β-シクロデキストリンが投与された複数の動物種(マウス、ラット及びネコ)において、聴覚パラメータの変化及び内耳の外有毛細胞の減少が報告されている。なお、ラットでは、最大推奨臨床用量の約3倍(体表面積換算値)である2,000mg/kgの投与においてこれらの所見が認められた3、4)。
1)社内資料(レテルモビルのラット乳汁中移行に関する試験)
2)Gould S et al. Food Chem Toxicol. 2005; 43(10): 1451-1459.
3)Crumling MA et al. Front Cell Neurosci. 2017; 11: 355.
4)Liu X et al. Neurotox Res. 2020; 38(3): 808-823.