レカルブリオ®に関する過去のお知らせ一覧
過去のお知らせ一覧
承認時評価資料:イミペネム耐性菌(中等度耐性を含む)感染症患者を対象とした国際共同第Ⅲ相試験(013試験)
Motsch J, et al., Clin Infect Dis. 2020;70(9):1799-1808.
[利益相反:本研究はMSDの研究費により実施された。I.Kö.はMSDのアドバイザリーボードのメンバーであり、演者である。
M.L.B.、 I.Kh.、 J.D.、 H.-K.J.、 R.W.T.、 A.A.、 K.Y.、 N.A.K.、 J.R.B.、 A.P.はMSD社員である。]
本試験には日本の治験実施医療機関も参加したが、症例の組み入れには至らなかった。
イミペネム耐性菌〔中等度耐性(腸内細菌目細菌:MIC 2μg/mL;緑膿菌、アシネトバクター:MIC 4μg/mL)以上〕感染症患者〔細菌性の院内肺炎(HABP)又は人工呼吸器関連肺炎(VABP)、複雑性腹腔内感染症(cIAI)、複雑性尿路感染症(cUTI)〕に対するレカルブリオ®の有効性及び安全性を、コリスチンメタンスルホン酸ナトリウム(コリスチン)とイミペネム/シラスタチンの併用投与と比較検討する。
18歳以上のイミペネム耐性菌(中等度耐性以上)感染症患者50例
(レカルブリオ®群31例、コリスチン+イミペネム/シラスタチン群16例、レカルブリオ®非盲検群3例)
多施設共同、二重盲検、実薬対照、無作為化、並行群間、第Ⅲ相試験。イミペネム耐性菌(中等度耐性以上)感染症患者(コリスチン及びレレバクタム/イミペネム感受性)を、レカルブリオ®群又はコリスチン+イミペネム/シラスタチン群に2:1の比で無作為に割り付けた。
レカルブリオ®群にはレカルブリオ®1.25g[レレバクタム250mg/イミペネム500mg/シラスタチン500mg]を6時間ごと及びコリスチンのプラセボを12時間ごとに静脈内投与、コリスチン+イミペネム/シラスタチン群にはコリスチン(# 1日あたりの最高維持用量:コリスチン力価として300mg)を12時間ごと及びイミペネム500mg/シラスタチン500mg†を6時間ごとに静脈内投与した。
また、イミペネム及びコリスチン耐性、かつ、レレバクタム/イミペネム感受性の患者をレカルブリオ®非盲検群に組み入れ、レカルブリオ®1.25g[レレバクタム250mg/イミペネム500mg/シラスタチン500mg]を6時間ごとに静脈内投与した。
投与期間は、HABP/VABP患者では7~21日間、cIAI又はcUTI患者では5~21日間とした。
なお、腎機能障害を有する患者では、腎機能の程度に基づきレカルブリオ®、コリスチン、イミペネム/シラスタチンの用量を調整した。

a)6時間ごとに30分かけて点滴静注する
1)レレバクタム250mg/イミペネム500mg/シラスタチン500mg
2)レレバクタム200mg/イミペネム400mg/シラスタチン400mg
3)レレバクタム150mg/イミペネム300mg/シラスタチン300mg
4)レレバクタム100mg/イミペネム200mg/シラスタチン200mg
# コリスチンは国内承認用法及び用量外 † イミペネム╱シラスタチンは国内承認用法及び用量外
‡ 組み入れ前にコリスチン力価として200mg(約470mg CMS又は590万 IUに相当)の負荷投与が行われていた場合、その患者は維持投与から初回の治験薬投与を開始する。事前の負荷投与をされていない場合は、事前の投与量にかかわらず、記載されているように負荷投与を行う。
§ レカルブリオ®を除き、維持投与は、負荷投与の12時間後に開始し、その後12時間ごとに投与する。プラセボの投与も同様に行う。
主要評価項目:①3種類の各感染症で評価した総合効果の有効率 ②安全性:有害事象、臨床検査値、バイタルサイン及び身体所見
重要な副次評価項目:①投与28日時点の臨床効果の有効率 ②投与28日までの全死亡率 ③投与終了14日までに生じた腎毒性の発現割合
その他の副次評価項目:①投与3日、EOT時点及びEFU時点での臨床効果の有効率 ②投与3日、EOT時点及びEFU時点での細菌学的効果の有効率 ③感染症の種類ごとの総合効果の有効率
治療終了時(EOT):治験薬最終投与後24時間以内 早期フォローアップ(EFU):EOTの5~9日後
総合効果:HABP/VABP患者における投与28日までの生存率(全死亡率に基づく)、cIAI患者における投与28日の臨床効果、cUTI患者におけるEFU来院(治療終了5~9日後)の複合効果(臨床効果及び細菌学的効果)に基づく評価。
治癒持続:治験薬投与開始前の感染症に関連する臨床症状・徴候のすべてが回復(又は感染症発症前の状態に回復)し再発の徴候がない、かつ、感染症に対する抗菌薬の追加投与が不要、かつ、cIAI患者においては、予定外の外科的処置又は経皮的ドレナージ処置が実施されていない。
治癒:治験薬投与開始前の感染症に関連する臨床症状・徴候のすべてが回復(又は感染症発症前の状態に回復)、かつ、感染症に対する抗菌薬の追加投与が不要、かつ、cIAI患者においては、予定外の外科的処置又は経皮的ドレナージ処置が実施されていない。
消失持続:EFU来院時の尿分離培養において、組み入れ時に同定された尿中原因菌が継続して消失。
本試験は推定を目的としており、有効性評価項目に対して正式な統計的検定は行わなかった。有効性評価項目は、Agresti and Coullの方法を用いて投与群内の95%信頼区間(CI)を算出した。主要な有効性解析対象集団はmMITT集団とした。なお、主要評価項目の3種類の各感染症で評価した総合効果の有効率について原因菌別にサブグループ解析を行った。
有効性解析対象集団:mMITT集団31例(レカルブリオ®群21例、コリスチン+イミペネム/シラスタチン群10例)
mMITT集団:無作為割付けされたすべての患者(レカルブリオ®群及びコリスチン+イミペネム/シラスタチン群)のうち、治験薬の投与を少なくとも1回は受け、ベースラインの原因菌が中央検査機関の検査結果で選択基準〔グラム陰性菌と同定され、イミペネム耐性(中等度耐性以上)、かつ、コリスチン及びレレバクタム/イミペネム感受性〕を満たした患者
安全性解析対象集団:治験薬の投与を少なくとも1回は受けたすべての患者50例(レカルブリオ®群31例、コリスチン+イミペネム/シラスタチン群16例、レカルブリオ®非盲検群3例)
mMITT集団における総合効果の有効率は、レカルブリオ®群71.4%(15/21例)、コリスチン+イミペネム/シラスタチン群70.0%(7/10例)でした。
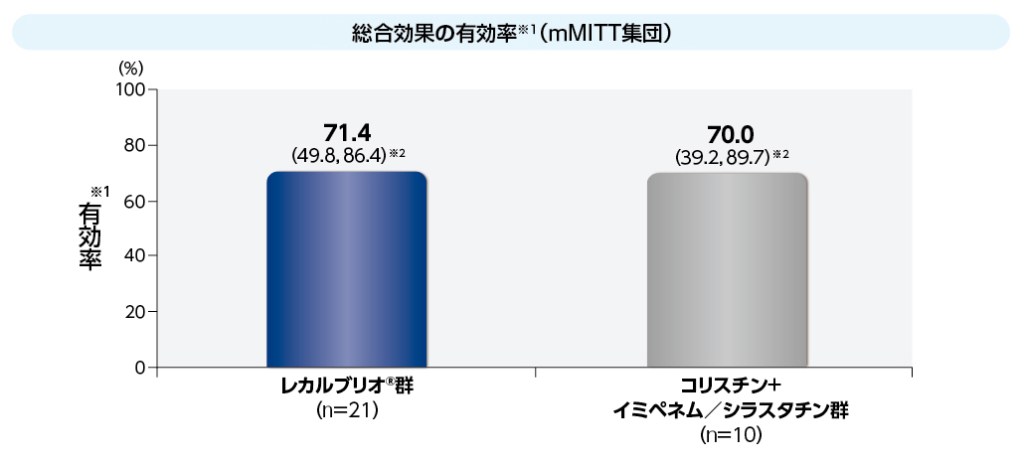
※1 3種類の各感染症で評価した総合効果の有効率
感染部位別に以下のとおり定義した。
・HABP/VABP:投与28日時点で生存
・cIAI:投与28日時点で臨床効果が「治癒持続」又は「治癒」
・cUTI:EFU時点で臨床効果が「治癒持続」又は「治癒」、かつ細菌学的効果が「消失持続」
※2 95%信頼区間;Agresti and Coullの方法
承認時評価資料:イミペネム耐性菌(中等度耐性を含む)感染症患者を対象とした国際共同第Ⅲ相試験(013試験)
Motsch J, et al., Clin Infect Dis. 2020;70(9):1799-1808.
[利益相反:本研究はMSDの研究費により実施された。I.Kö.はMSDのアドバイザリーボードのメンバーであり、演者である。
M.L.B.、 I.Kh.、 J.D.、 H.-K.J.、 R.W.T.、 A.A.、 K.Y.、 N.A.K.、 J.R.B.、 A.P.はMSD社員である。]
本試験には日本の治験実施医療機関も参加したが、症例の組み入れには至らなかった。
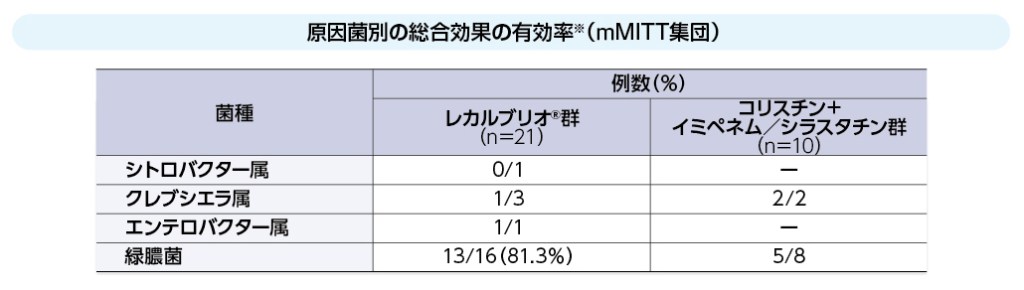
※ 3種類の各感染症で評価した総合効果の有効率
感染部位別に以下のとおり定義した。
・HABP/VABP:投与28日時点で生存
・cIAI:投与28日時点で臨床効果が「治癒持続」又は「治癒」
・cUTI:EFU時点で臨床効果が「治癒持続」又は「治癒」、かつ細菌学的効果が「消失持続」
承認時評価資料:イミペネム耐性菌(中等度耐性を含む)感染症患者を対象とした国際共同第Ⅲ相試験(013試験)
Motsch J, et al., Clin Infect Dis. 2020;70(9):1799-1808.
[利益相反:本研究はMSDの研究費により実施された。I.Kö.はMSDのアドバイザリーボードのメンバーであり、演者である。
M.L.B.、 I.Kh.、 J.D.、 H.-K.J.、 R.W.T.、 A.A.、 K.Y.、 N.A.K.、 J.R.B.、 A.P.はMSD社員である。]
本試験には日本の治験実施医療機関も参加したが、症例の組み入れには至らなかった。
# コリスチンは国内承認用法及び用量外
# 本邦における注射用コリスチンメタンスルホン酸ナトリウムの用法及び用量
通常、成人には、コリスチンとして1回1.25~2.5mg(力価)/kgを1日2回、30分以上かけて点滴静注する。
† イミペネム╱シラスタチンは国内承認用法及び用量外
† 本邦における注射用(点滴静注用)イミペネム・シラスタチンナトリウムの6. 用法及び用量(抜粋)
通常成人にはイミペネムとして、1日0.5~1.0g(力価)を2~3回に分割し、30分以上かけて点滴静脈内注射する。
なお、年齢・症状に応じて適宜増減するが、重症・難治性感染症には、成人で1日2g(力価)まで増量することができる。
●各薬剤の製品電子添文をご参照ください。
mMITT集団における投与28日時点の臨床効果の有効率は、レカルブリオ®群71.4%(15/21例)、コリスチン+イミペネム/シラスタチン群40.0%(4/10例)でした。
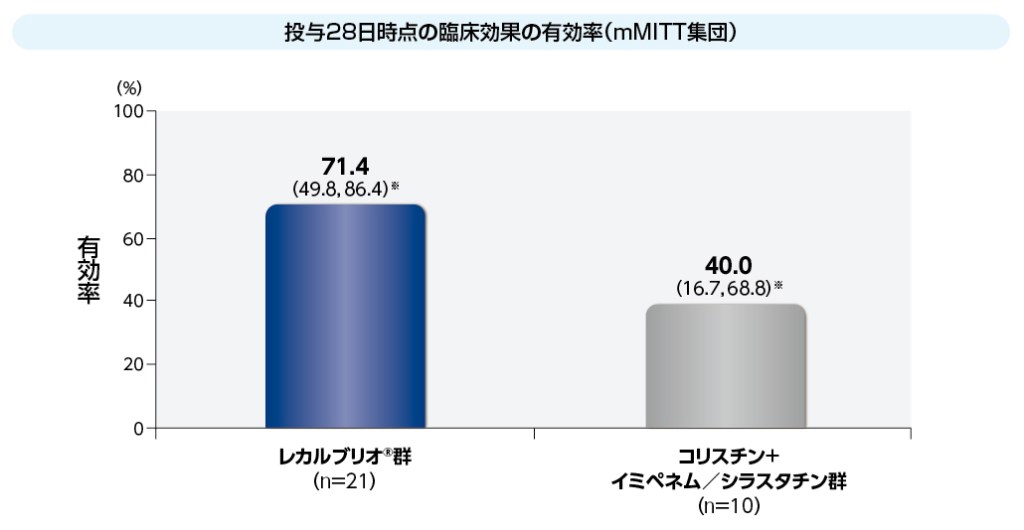
※ 95%信頼区間;Agresti and Coullの方法
承認時評価資料:イミペネム耐性菌(中等度耐性を含む)感染症患者を対象とした国際共同第Ⅲ相試験(013試験)
Motsch J, et al., Clin Infect Dis. 2020;70(9):1799-1808.
[利益相反:本研究はMSDの研究費により実施された。I.Kö.はMSDのアドバイザリーボードのメンバーであり、演者である。
M.L.B.、 I.Kh.、 J.D.、 H.-K.J.、 R.W.T.、 A.A.、 K.Y.、 N.A.K.、 J.R.B.、 A.P.はMSD社員である。]
本試験には日本の治験実施医療機関も参加したが、症例の組み入れには至らなかった。
mMITT集団における投与28日までの全死亡率は、レカルブリオ®群9.5%(2/21例)、コリスチン+イミペネム/シラスタチン群30.0%(3/10例)でした。
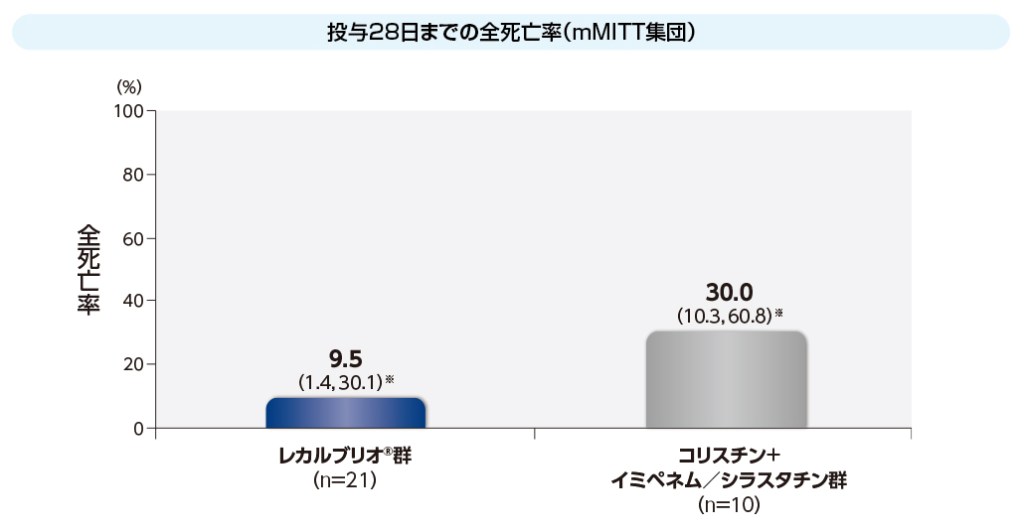
※ 95%信頼区間;Agresti and Coullの方法
承認時評価資料:イミペネム耐性菌(中等度耐性を含む)感染症患者を対象とした国際共同第Ⅲ相試験(013試験)
Motsch J, et al., Clin Infect Dis. 2020;70(9):1799-1808.
[利益相反:本研究はMSDの研究費により実施された。I.Kö.はMSDのアドバイザリーボードのメンバーであり、演者である。
M.L.B.、 I.Kh.、 J.D.、 H.-K.J.、 R.W.T.、 A.A.、 K.Y.、 N.A.K.、 J.R.B.、 A.P.はMSD社員である。]
本試験には日本の治験実施医療機関も参加したが、症例の組み入れには至らなかった。
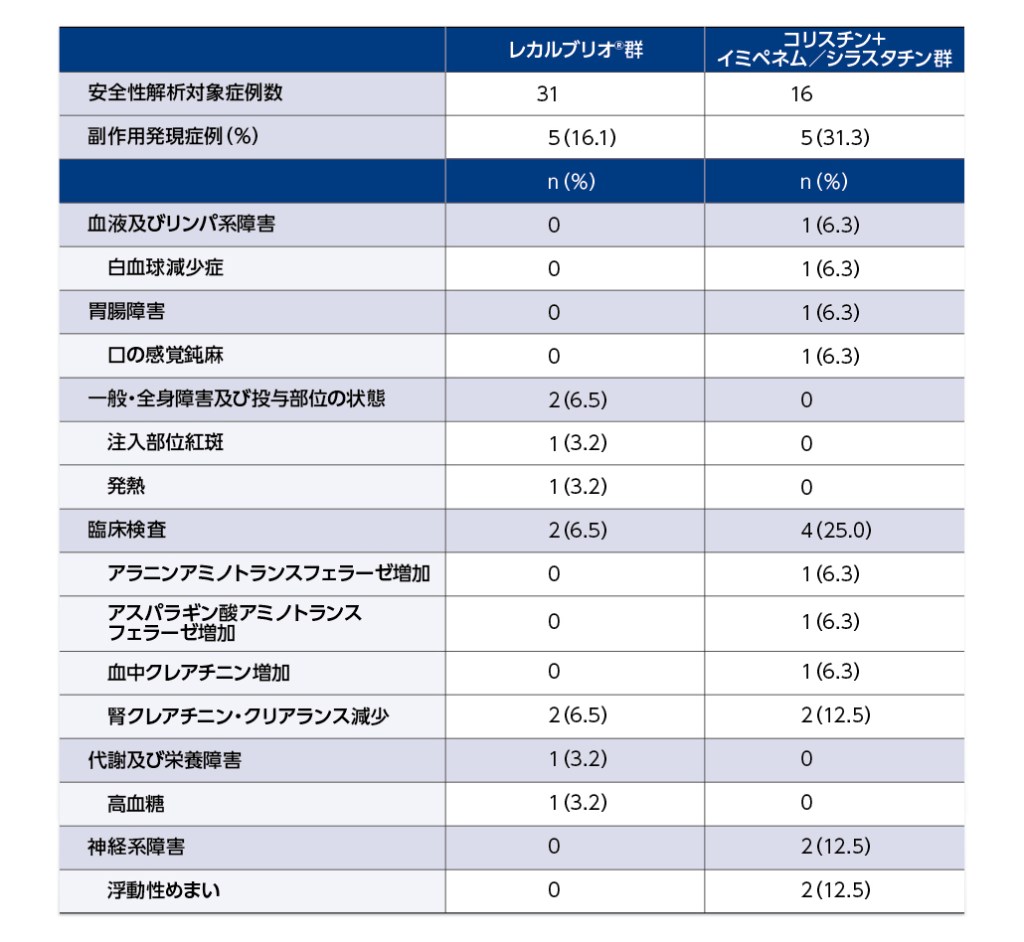
MedDRA ver.22.1
承認時評価資料:イミペネム耐性菌(中等度耐性を含む)感染症患者を対象とした国際共同第Ⅲ相試験(013試験)
Motsch J, et al., Clin Infect Dis. 2020;70(9):1799-1808.
[利益相反:本研究はMSDの研究費により実施された。I.Kö.はMSDのアドバイザリーボードのメンバーであり、演者である。
M.L.B.、 I.Kh.、 J.D.、 H.-K.J.、 R.W.T.、 A.A.、 K.Y.、 N.A.K.、 J.R.B.、 A.P.はMSD社員である。]
本試験には日本の治験実施医療機関も参加したが、症例の組み入れには至らなかった。
WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?