臨床成績
臨床成績
海外第Ⅲ相臨床試験
[REST(Rotavirus Efficacy and Safety Trial):006試験]
ロタテック®の予防効果【海外データ】
ロタテック®は主要評価項目として重症度を問わないロタウイルス胃腸炎を74.0%抑制しました。
また、副次評価項目として、外来受診例は86.0%、保護者の労働損失日数は86.6%減少しました。
![海外第Ⅲ相臨床試験 [REST(Rotavirus Efficacy and Safety Trial):006試験]](https://www.msdconnect.jp/wp-content/uploads/sites/5/2024/11/rotateq_clinical-results_fes_1b.jpg?w=1024)
安全性
安全性コホート(69,274例)における、接種後42日間の腸重積症は、ロタテック®群が6例、プラセボ群5例でした。接種後42日間のロタテック®群の重篤な有害事象の発現は803例、死亡例は14例でした。(内訳:乳児突然死症候群6例、頭部損傷・交通事故、死亡、心房中隔欠損症・肺炎・脂肪肝、急性腎盂腎炎、窒息、悪性新生物、突然死、細菌性髄膜炎・肺炎 各1例ずつ)接種後42日間での中止例は2,838例で、その理由は有害事象214例、治験実施計画書逸脱960例、同意撤回182例、追跡不能68例、転居203例、その他1,211例でした。
詳細な安全性コホートにおける接種後42日間に発現した有害事象は、ロタテック®群で4,068/4,795※(84.8%)に認められました。主な有害事象は、発熱1,963例(41%)、上気道感染1,219例(25%)、下痢945例(20%)、易刺激性878例(18%)でした。プラセボ群では、4,113/4,781※(86.0%)に有害事象が認められました。主な有害事象は、発熱2,058例(43%)、上気道感染1,269例(27%)、下痢915例(19%)、易刺激性860例(18%)でした。(MedDRA version 7.1)
※:追跡を行った被験者数
試験概要
【試験】国際共同無作為化二重盲検プラセボ対照試験
【対象】初回接種時の年齢が生後6~12週目の健康乳児69,274例ならびに有効性コホート5,686例:ロタテック®群2,841例、プラセボ群2,845例
【方法】ロタテック®群またはプラセボ群に無作為に割り付け、計3回、各接種は4~10週(28~70日)の間隔で経口接種した。
当該集団において、ロタテック®/プラセボ3回接種後14日以降にロタウイルス胃腸炎を発症した症例を調査した。
【主要評価項目】腸重積症のリスク、遺伝子型G1~G4に起因したロタウイルス胃腸炎に対する予防効果を評価した。
【副次評価項目】3回接種後14日目以降に発症したG1、G2、G3およびG4遺伝子型に起因した重度のロタウイルス胃腸炎に対する予防効果。3回目接種後の2回目のロタウイルスシーズンを通じた予防効果。(重度ロタウイルス胃腸炎、入院、救急外来受診、入院および救急外来受診、外来受診、保護者の労働損失日数)
【解析計画】95%信頼区間の下限値が>35%の場合、有効性に関する統計学的基準を満たすとし、正確な二項検定を使用した。
海外第Ⅲ相臨床試験(006試験)(承認時評価資料)、Vesikari T et al. N Engl J Med 2006 ; 354(1):23-33より作図
【利益相反】Vesikari T、Marshall GSはMSD社からのコンサルタント謝礼、講師謝金、研究助成費の授受がある。Matson DOら3名はMSD社からのコンサルタント謝礼もしくは講師謝金と研究助成費の授受がある。Dennehy Pら8名はMSD社からの研究助成費の授受がある。Shinefield HRら2名はMSD社からの研究助成費の授受があり、MSD株を保有している。Clark HF、Offit PAはRotaTeqの特許を共同で取得している。Dallas MJら10名はMSD社の社員、Campens Dは仏SPMSDの社員である。
海外第Ⅲ相臨床試験(REST:006試験)と
FES(Finnish extension study)の統合解析
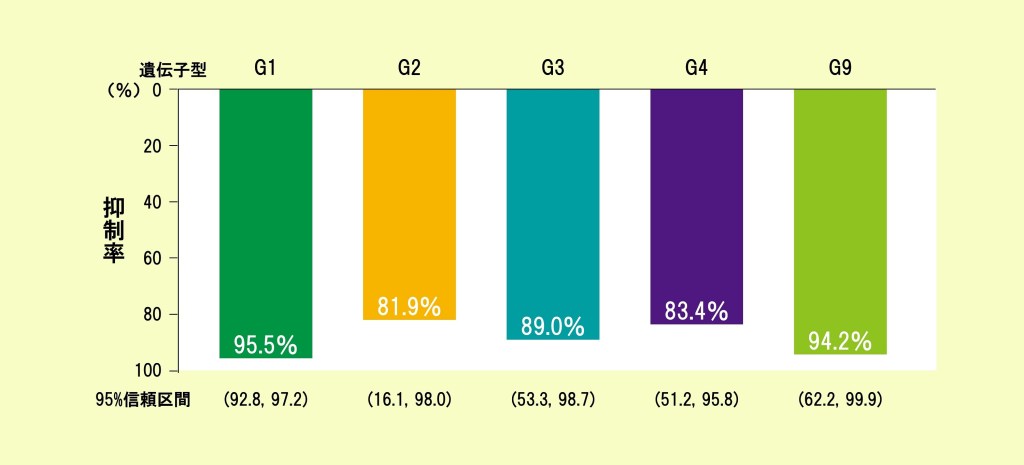
ロタウイルス胃腸炎による入院および救急外来受診の抑制効果
(遺伝子型別、最長3.1年追跡)【海外データ】
ロタテック®は、5つの遺伝子型(血清型)によるロタウイルス胃腸炎に対し、
入院および救急外来受診を抑制しました。
安全性
本論文中に記載なし。FES試験は、REST試験の延長試験のため、ロタウイルスワクチン接種時の安全性として、REST試験での安全性をご参照ください。
試験概要
【試験】 二重盲検プラセボ対照試験として行われたREST(006試験)後に、フィンランドの乳幼児を対象とした延長試験[FES(the Finnish extension study)]
【対象】 REST試験:ロタテック®群34,644例、プラセボ群:34,630例、FES試験:ロタテック®群10,367例、プラセボ群:10,365例
【方法】 ロタテック®接種によるロタウイルス胃腸炎に起因する入院および救急外来受診の予防効果が2年以上有しているかを評価するために、RESTの対象のうち、フィンランドの乳幼児をREST終了後FESに登録し、3回目接種後最大約3.1年追跡した。3回接種後14日以降から遺伝子型(血清型)G1、G2、G3、G4およびG9に起因したロタウイルス胃腸炎で入院および救急外来を受診と腸重積症の発症について調査した。
【解析計画】 ポアゾン数比の正確な二項法を用いて95%CIを推定した。
Vesikari T et al. Pediatr Infect Dis J. 2010; 29(10): 957-963. より作図
【利益相反】 Vesikari TはMSD社とSPMSD社のコンサルタント、演者である。Karvonen AはCOIなし。Ferrante SA、Kuter BJ、Ciarlet MはMSD社員である。
米国 ロタテック®市販後研究
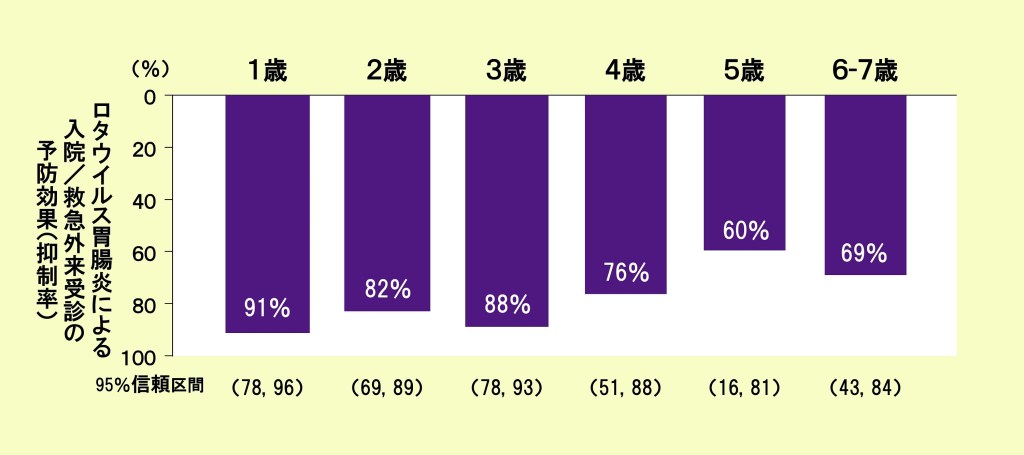
1~7歳 各年齢におけるロタテック®の予防効果【海外データ】
ロタテック®は、1~7歳の各年齢で予防効果を示しました。
安全性
論文中に記載なし。安全性情報は電子添文を参照ください。
試験概要
急性胃腸炎で入院または救急外来を受診した8歳未満の小児のうち、ロタウイルス陽性例を症例群、陰性例を対照群として、ロタウイルスワクチン接種歴を比較し、ロタウイルスワクチンの有効性を評価した症例対照研究
【対 象】 2011年12月〜2012年11月、2012年12月〜2013年11月に急性胃腸炎のために7つの施設にて入院もしくは救急外来を受診した8歳未満*の患児
* ロタテック®が発売された2006年4月1日以降に出生し、少なくとも生後8ヵ月以上
【方 法】 採取した患児の糞便検体を用いて、酵素免疫学的検査によりロタウイルス感染を特定。ロタウイルスワクチン接種歴を調査しcase-control比較を行った。
【解析項目】 ロタウイルス胃腸炎による入院・救急外来受診に対するロタウイルスワクチンの予防効果
【解析計画】 ワクチンの有効性は(1-オッズ比)×100と定義し、調整オッズ比(生年月、症状発現の年月、施設で補正)、95%信頼区間はロジスティック回帰分析(両側検定)で算出
【Limitaion】 ロタウイルスワクチン接種の割合が高くなるにしたがって、ワクチン未接種群の対照群の代表性が低下する可能性がある。
Payne DC et al. Clin Infect Dis 2015 ; 61(12) : 1792-1799.より作図
【利益相反】 Staat MAはMSD社から研究助成費の授受があり、ロタウイルス諮問委員会のメンバー、Bernstein DI はMSD社から研究助成費の授受がある。他の著者はCOIなし。