PIONEER REAL Japan:PMS最終集計結果
本調査の留意点
本調査は製造販売後調査(PMS)を兼ねて実施されたものであるため、結果の解釈にあたっては下記の点に留意する必要がある。
● 対照群が設定されていないため、本試験で得られた結果の因果関係が確立できない。
● 標準的な交絡因子は主要解析で考慮されたものの、それ以外の交絡因子による影響を受けた可能性を除外できない。
● 使用されたデータは日常診療において収集されたものであり、事前に規定されたタイミングで収集されたものではないため、データ
及び結果の頑健性・完全性に影響が及んでいる可能性がある。
● HbA1cの変化はリベルサス®錠を開始した臨床上の理由(治療適応による交絡)の影響を受けた可能性がある。
PIONEER REAL Japan<PMS最終集計結果>
日本人の2型糖尿病がある方に対するリベルサス®錠のリアルワールドエビデンス
Suzuki R et al.:J Diabetes Investig 15(8):1047-1056, 2024
Yabe D et al.:J Diabetes Investig 15(11):1566-1577, 2024
本試験はノボ ノルディスク社のスポンサーシップにより実施された。
PIONEER REAL Japan: Primary results from a multicenter, prospective, real-world study of oral semaglutide in adults with type 2 diabetes in Japanese clinical practice., Yabe D, Hamamoto Y, Kawanami D, et al. Copyright © 2024 The Author(s). Journal of Diabetes Investigation published by Asian Association for the Study of Diabetes (AASD) and John Wiley & Sons Australia, Ltd. Reproduced with permission of John Wiley & Sons Inc.
■試験概要

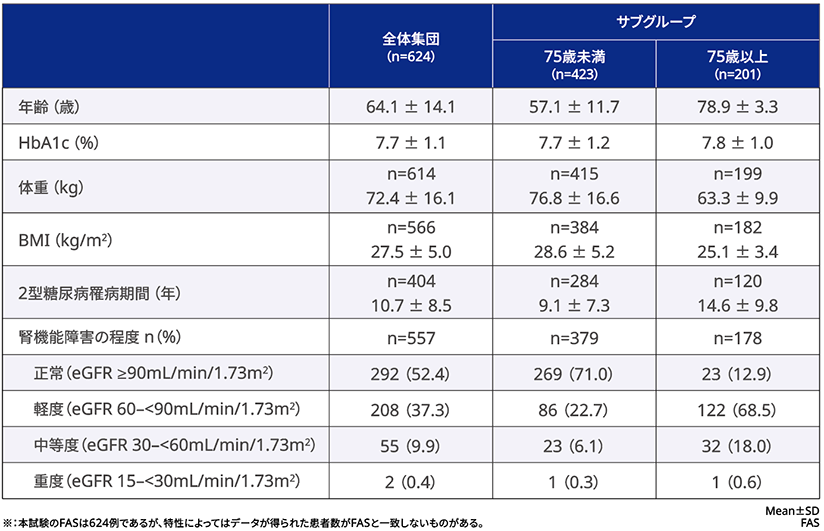
■患者背景

■患者背景※
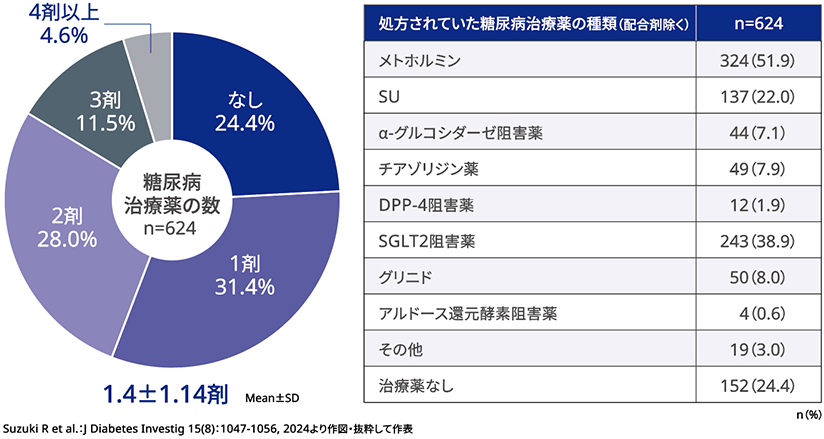
■ベースライン時に処方されていた糖尿病治療薬
ベースライン時に処方されていた糖尿病治療薬(配合剤除く)の平均処方数は1.4剤であった。糖尿病治療薬による治療を受けていない患者が24.4%、1剤の患者が31.4%であり、55.8%の患者で2剤目までにリベルサス®錠が新規で導入された。
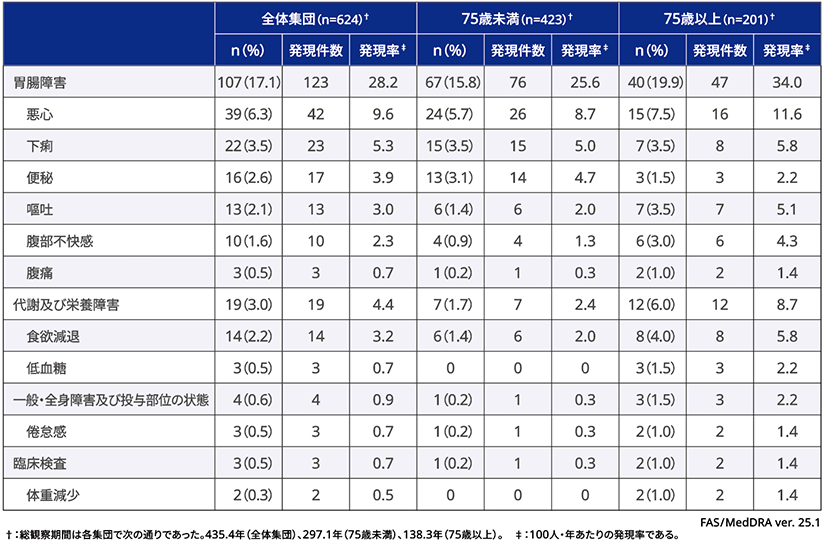
■有害事象・副作用(全体集団・サブグループ解析)
ベースラインから調査終了来院時までに発現した有害事象は624例のうち161例(25.8%)で確認され、発現件数は268件であった。
75歳未満では、423例のうち99例(23.4%)で確認され、発現件数は149件であった。
75歳以上では、201例のうち62例(30.8%)で確認され、発現件数は119件であった。
重篤な副作用が2例(腸閉塞、薬疹)で報告された。いずれも重症度は中等度であり、リベルサス®錠に関連している可能性は低いと判断された。2例ともリベルサス®錠の投与は中止された。
観察期間中、2例の死亡例が確認された。1例の死因は心筋梗塞又は不整脈であり、もう1例の死因は感染性肺炎
であったが、2例ともリベルサス®錠との因果関係はなしと判断された。
[主要評価項目(全体集団)]ベースラインから調査終了来院時までに発現した有害事象の発現件数
[副次的評価項目(全体集団)]ベースラインから調査終了来院時までに発現した重篤な有害事象/副作用/重篤な副作用の発現件数
![[主要評価項目(全体集団)]ベースラインから調査終了来院時までに発現した有害事象の発現件数[副次的評価項目(全体集団)]ベースラインから調査終了来院時までに発現した重篤な有害事象/副作用/重篤な副作用の発現件数](https://www.msdconnect.jp/wp-content/uploads/sites/5/2024/12/rybelsus_real_fig05.png?w=824)
いずれかの集団(サブグループを含む)で1%以上の割合で認められた副作用
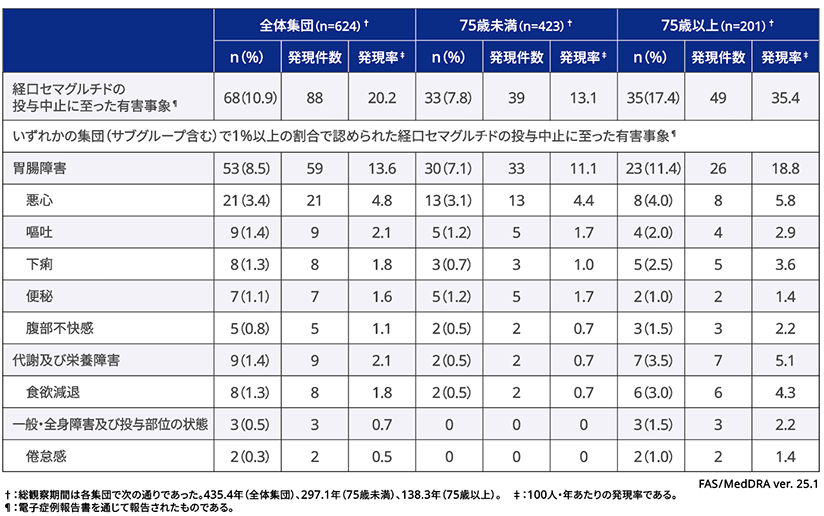
投与中止に至った有害事象
全体集団及びサブグループにおけるリベルサス®錠の投与中止に至った有害事象の発現状況は、下表に示す通りであった。
■リベルサス®錠による治療状況の変化
試験期間中のリベルサス®錠による治療を継続した患者、中断した患者の割合は下図に示す通りであった。調査終了来院時に約8割がリベルサス®錠による治療を継続していた。
*:[探索的及びその他の評価項目]調査終了来院時にリベルサス®錠で治療していた患者の割合
![[探索的及びその他の評価項目]調査終了来院時にリベルサス®錠で治療していた患者の割合](https://www.msdconnect.jp/wp-content/uploads/sites/5/2024/12/rybelsus_real_fig08.png?w=824)
■<参考情報>服用に関する患者アンケート
服用に関するアンケートは、調査終了来院時又はリベルサス®錠を中止する際に実施した。
アンケートではリベルサス®錠の服用のしやすさについて、「とても簡単」と感じる場合を「6」、「とても難しい」と感じる場合を「0」として0~6の間で該当する数値が選択された。
[探索的及びその他の評価項目]リベルサス®錠の服用に関する患者アンケート
![[探索的及びその他の評価項目]リベルサス®錠の服用に関する患者アンケート](https://www.msdconnect.jp/wp-content/uploads/sites/5/2024/12/rybelsus_real_fig09.png?w=824)
6. 用法及び用量
通常、成人には、セマグルチド(遺伝子組換え)として1日1回7mgを維持用量とし経口投与する。ただし、1日1回3mgから開始し、4週間以上投与した後、1日1回7mgに増量する。なお、患者の状態に応じて適宜増減するが、1日1回7mgを4週間以上投与しても効果不十分な場合には、1日1回14mgに増量することができる。
7. 用法及び用量に関連する注意(抜粋)
7.1 本剤の吸収は胃の内容物により低下することから、本剤は、1日のうちの最初の食事又は飲水の前に、空腹の状態でコップ約半分の水(約120mL 以下)とともに3mg錠、7mg錠又は14mg錠を1錠服用すること。また、服用時及び服用後少なくとも30分は、飲食及び他の薬剤の経口摂取を避けること。分割・粉砕及びかみ砕いて服用してはならない。[電子添文16.2.1-16.2.3参照]
FAS:最大の解析対象集団 SU:スルホニルウレア薬 SGLT2阻害薬:ナトリウム-グルコース共輸送体2阻害薬
【禁忌を含む注意事項等情報】等はこちらをご参照ください。