シベクトロ®に関する過去のお知らせ一覧
過去のお知らせ一覧

承認時評価資料:日本人MRSA感染症(皮膚・軟部組織感染症又はそれに伴う敗血症)患者を対象とした第Ⅲ相試験(16099試験)
Mikamo H, et al., J Infect Chemother. 2018;24(6):434-442.
[利益相反:H.M.はMSDから講演料および/または助成金および/または寄付を受領、Y.T.はMSDから講演料および/または寄付を受領、S.K.はMSDより講演料およびコンサルタント料を受領した。]
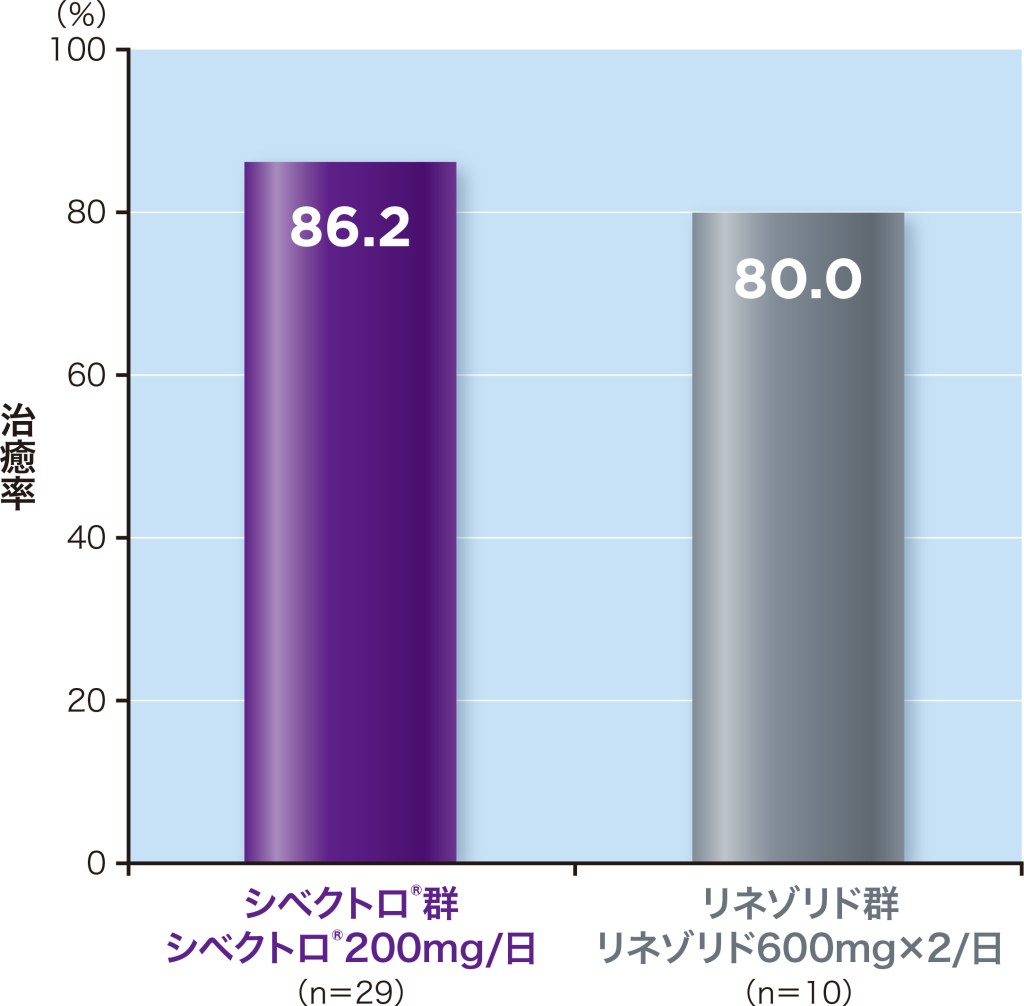
TOC時の臨床効果(治癒率)は、シベクトロ®群86.2%、リネゾリド群80.0%でした。
](https://www.msdconnect.jp/wp-content/uploads/sites/5/2021/02/svx_clinical_3.png)
TOC:治癒判定[投与終了(EOT)7~14日後] ME-MRSA:微生物学的評価可能解析対象集団
盲検担当医師が以下の基準で判定した。各症状・徴候(観察項目)の程度は、「0:なし」、「1:軽度」、「2:中等度」、「3:重度」の4段階で記載した。なお、紅斑については病変部に残る暗紅色の残存紅斑は「0:なし」と判定した。
| 判定 | 判定基準 |
| 治癒 | 次の4つを満たす場合 ● スクリーニング時に認められた皮膚・軟部組織感染症の局所の症状・徴候がTOC時に消失又はほぼ消失している 注1)ほぼ消失とは、スクリーニング時に認められた局所の症状・徴候が全て「1:軽度」以下で、「0:なし」が半分以上あることが望ましい ● スクリーニング時に認められた皮膚・軟部組織感染症の全身性の徴候がTOC時に消失又はほぼ消失している 注2)スクリーニング時に熱のある患者では、スクリーニング時より体温が低下しており、37.2℃未満であれば、ほぼ消失とする ● TOC時における病変の大きさが、スクリーニング時と比較して縮小している ● 対象疾患に起因する新たな徴候、症状、合併症がなく、追加の抗菌薬療法の必要がない |
| 治癒 せず | 次のいずれかの場合 ● EOT時の臨床効果が「無効」 ● スクリーニング時に認められた局所の症状・徴候がTOC時に悪化している又は不変である ● TOC時における病変の大きさは、スクリーニング時と比較して同じ、又は拡大している ● 対象疾患の治療に追加の抗菌薬療法が必要 ● 治験薬の薬効欠如のため大手術(例:切断術)が必要 ● スクリーニング時以降に骨髄炎を発症 ● 治験薬投与開始からTOC時までに死亡(死因を問わない) |
| 判定 不能 | 以下の理由などにより、臨床効果を評価できない場合 ● スクリーニング時から骨髄炎があった ● TOC時に来院がないなど、症状・徴候の情報が欠落している ● スクリーニング時の微生物学的検査においてアズトレオナム以外の抗菌薬療法が必要なグラム陰性菌が分離同定された ● スクリーニング時に認められた症状・徴候の消失又は改善が認められたが、TOC時までに対象疾患以外に対して抗菌薬が投与(全身投与)された ● 同意が撤回された |
EOT:投与終了 TOC:治癒判定[投与終了(EOT)7~14日後]
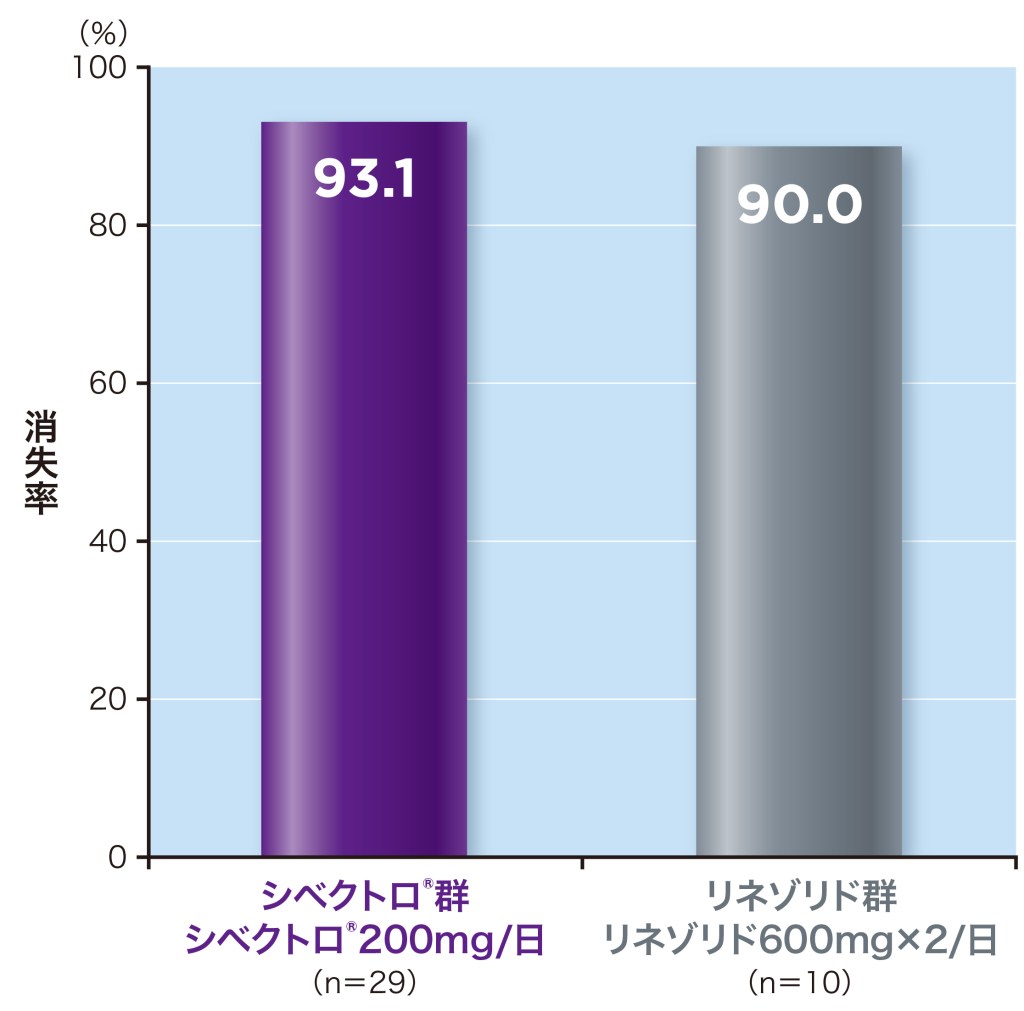
TOC時の微生物学的効果(消失率)は、シベクトロ®群93.1%、リネゾリド群90.0%でした。
](https://www.msdconnect.jp/wp-content/uploads/sites/5/2021/02/svx_clinical_5.png)
TOC:治癒判定[投与終了(EOT)7~14日後] ME-MRSA:微生物学的評価可能解析対象集団
臨床効果と中央測定機関の微生物学的検査結果に基づき、盲検担当医師が以下の基準で微生物学的効果判定を行った。
| 判定 | 定義 | 解析上の取扱い |
| 消失 (Eradication) | 適切に採取された検体から、治験薬の投与後に原因菌が検出されなかった場合 | 消失 |
| 推定消失 (Presumed Eradication) | 治療によって臨床症状が改善又は消失し、当初の感染病変から検査に適した検体が得られなくなった場合、原因菌は消失したものと推定する | 消失 |
| 菌交代症※ (Substituted Microbism) | 治療により当初の原因菌は消失し、それ以外の治験薬に感受性を示さない新たな病原微生物が、明らかな感染症の症状や徴候を伴って同じ部位から検出された場合 | 消失 |
| 定着 (Colonization) | 治療により明らかな感染症の症状や徴候は消失したが、当初の原因菌が同じ部位から検出された場合 | 消失 |
| 存続 (Persistence) | 感染病変から当初の原因菌が検出された場合 | 存続 |
| 推定存続 (Presumed Persistence) | 臨床症状の改善がみられず、適切に採取された検体からの分離培養が不可能あるいは実施されなかった場合、原因菌は存続していると推定する | 存続 |
| 重複感染※ (Superinfection) | 当初の原因菌が存続するとともに異なる新たな微生物の出現をみることがある。これに伴って、臨床的あるいは検査上の感染所見が持続もしくは増悪する場合を重複感染とする | 存続 |
| 再燃 (Recurrence) | 原因菌の消失が証明されるが、それ以降に再び感染部位の検体から同じ病原菌が検出された場合である。主にTOC時に対する再燃判定時の評価に用いる | 存続 |
| 判定不能 (Indeterminate) | 種々の理由により微生物学的検査が実施されなかったなど、上述のいずれかの判定もできない場合 | 除外 |
※:被験者別の微生物学的効果の判定にのみ用いる
TOC:治癒判定[投与終了(EOT)7~14日後]
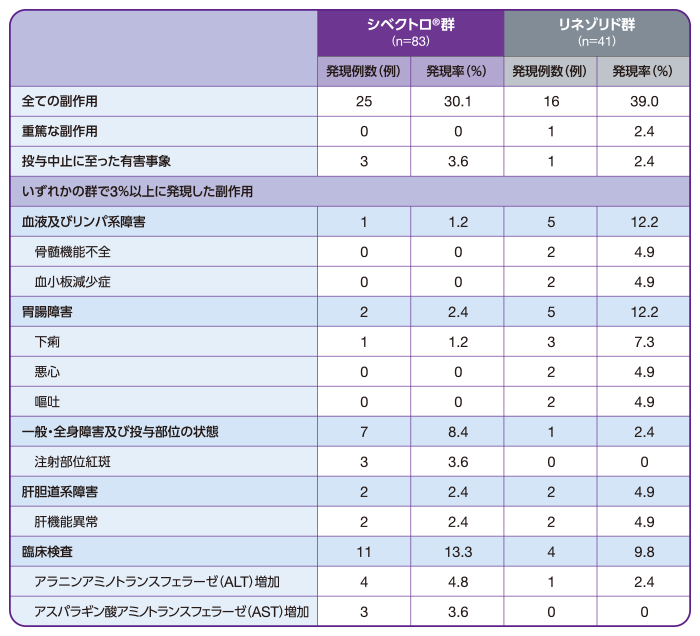
副作用は、シベクトロ®群83例中25例(30.1%)、リネゾリド群41例中16例(39.0%)に認められました。
主な副作用(発現率3%以上)は、シベクトロ®群でアラニンアミノトランスフェラーゼ(ALT)増加(4例、4.8%)、注射部位紅斑、アスパラギン酸アミノトランスフェラーゼ(AST)増加(いずれも3例、3.6%)、リネゾリド群で下痢(3例、7.3%)、骨髄機能不全、血小板減少症、悪心、嘔吐、肝機能異常(いずれも2例、4.9%)でした。
重篤な副作用は、リネゾリド群で骨髄機能不全(1例、2.4%)が認められ(第19日に死亡)、シベクトロ®群では認められませんでした。
投与中止に至った有害事象は、シベクトロ®群で3例[骨髄炎2例、ガス壊疽1例、壊死性筋膜炎1例](3.6%)、リネゾリド群で1例[筋膿瘍1例](2.4%)に認められました。
SAF:安全性解析対象集団
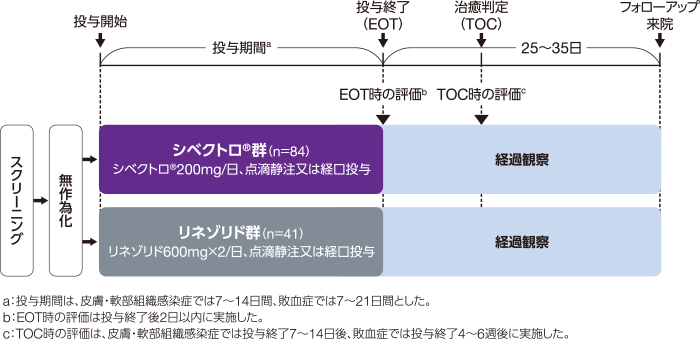
試験:多施設共同、リネゾリド対照、無作為化、非盲検比較試験
目的:日本人のMRSA感染症(皮膚・軟部組織感染症又は敗血症)患者に対するシベクトロⓇの有効性及び安全性をリネゾリドと比較検討する。
対象:日本人で18歳以上のMRSA感染症(皮膚・軟部組織感染症又は敗血症)患者[ITT※1解析対象例数:125例(シベクトロ®群84例、リネゾリド群41例)、うち皮膚・軟部組織感染症119例(シベクトロ®群80例、リネゾリド群39例)、敗血症6例(シベクトロ®群4例、リネゾリド群2例)]
方法:対象患者を、シベクトロ®200mgを1日1回投与する群(シベクトロ®群)又はリネゾリド600mgを1日2回投与する群(リネゾリド群)に2:1の比で無作為割り付けし、皮膚・軟部組織感染症では7~14日間、敗血症では7~21日間投与した。皮膚・軟部組織感染症では、少なくとも第3日又は第4日に実施する臨床効果判定まで点滴静注を続け、その後、治験責任(分担)医師が経口投与可能であると判断した場合は、臨床効果の測定後に経口投与に切り替えができることとした。敗血症では、治験責任(分担)医師が経口投与可能であると判断した場合は、臨床効果の測定後に点滴静注から経口投与に切り替えができることとした。
| 評価項目: | 〈主要評価項目〉治癒判定(TOC)時の臨床効果(治癒率)、TOC時の微生物学的効果(消失率) 〈副次評価項目〉投与終了(EOT)時の臨床効果(有効率)、EOT時の微生物学的効果(消失率)、スクリーニング時からの病変の大きさの推移(皮膚・軟部組織感染症のみ)、スクリーニング時から第3日又は第4日までの病変の大きさの縮小率(皮膚・軟部組織感染症のみ) 〈探索的評価項目〉治験薬の投与期間(TOC時の臨床効果が「治癒」と判定された患者における投与期間)、テジゾリド(代謝活性体)のPK-PDパラメータと有効性の関係 〈安全性の評価項目〉有害事象、臨床検査(血液学的検査、血液生化学検査、血液凝固系検査、尿検査)、バイタルサイン(体温、血圧、脈拍数又は心拍数、呼吸数)、12誘導心電図、理学的検査(神経学的検査を含む)、視力検査 |
| 解析計画: | 有効性の解析は、微生物学的評価可能解析対象集団(ME-MRSA※2)を主要な解析対象集団とした。主要評価項目の臨床効果におけるシベクトロ®群の「治癒」の割合について、閾値30%に対する優越性の検討を主要な有効性解析とした。部分集団解析として、皮膚・軟部組織感染症疾患(深在性皮膚感染症、慢性膿皮症、外傷・熱傷及び手術創等の二次感染、びらん・潰瘍の二次感染)別での臨床効果及び微生物学的効果(TOC時及びEOT時)、並びに治験薬投与下で発現した有害事象(TEAE)の発現割合について、人口統計学的特性及びその他の特性に関する解析を行った。安全性の解析は、安全性解析対象集団(SAF※3)を対象とした。 |
※1 ITT:割り付けられた全ての患者
※2 ME-MRSA:ITTのうち、皮膚・軟部組織感染症又は敗血症と診断され、治験実施計画書からの重大な逸脱に該当しない患者の部分集団であり、スクリーニング時の培養でMRSAが同定された患者
※3 SAF:ITTのうち、割り付け後に治験薬を少なくとも1回以上投与された患者
シベクトロ®の4.効能又は効果
< 適応菌種>テジゾリドに感性のメチシリン耐性黄色ブドウ球菌(MRSA)
<適応症>深在性皮膚感染症、慢性膿皮症、外傷・熱傷及び手術創等の二次感染、びらん・潰瘍の二次感染
リネゾリドの4.効能又は効果(詳細は製品電子添文をご参照ください。)
<適応菌種>本剤に感性のメチシリン耐性黄色ブドウ球菌(MRSA)
<適応症>敗血症、深在性皮膚感染症、慢性膿皮症、外傷・熱傷及び手術創等の二次感染、肺炎
<適応菌種>本剤に感性のバンコマイシン耐性エンテロコッカス・フェシウム
<適応症>各種感染症
WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?