小児侵襲性肺炎球菌感染症予防における0歳児での初回免疫の重要性
本動画では、小児侵襲性肺炎球菌感染症予防の観点から、0歳児における初回免疫での免疫獲得の重要性について、詳しくご説明いたします。
承認時評価資料: 海外第Ⅲ相試験(027試験)
Bili A. et al. Vaccine. 2023; 41(3):657-665.[利益相反:本試験はMSD社の支援により行われた。
著者の一部はMSD社の社員である。]
| 試験 デザイン | 互換性に関する多施設共同、無作為化、実薬対照、並行群間、二重盲検試験 |
| 目的 | 健康乳児を対象として、バクニュバンス®とPCV13の互換性を安全性、忍容性および免疫原性において検討する。 |
| 対象 | 健康乳児(約2カ月齢)900例(第1群179例、第2群181例、第3群180例、第4群180例、第5群180例) |
| 方法 | 被験者を1:1:1:1:1の比で5群に無作為に割り付け、バクニュバンス®またはPCV13を0.5mL筋肉内接種を行った。第1群ではPCV13を4回接種、第5群ではバクニュバンス®を4回接種した。他の3群では、接種をPCV13で開始し、2回目、3回目または4回目(それぞれ第4群、第3群、第2群)で接種をバクニュバンス®に変更した。また、被験者は既承認の小児ワクチン[B型肝炎ワクチン[組換え型](国内未承認)およびロタウイルスワクチン(5価)を含む]も同時接種した。バクニュバンス®またはPCV13の3、4回目接種後30日目に免疫原性を評価した。 |
| 評価項目 免疫原性 | 主要評価項目:第2~4群(PCV13/バクニュバンス®混合4回接種)の4回目接種後30日目のPCV13と共通の13血清型における血 清型特異的IgG GMC*を、PCV13 4回接種(第1群)と比較して評価する 副次評価項目:・3回接種後30日目の血清型特異的IgG GMCおよびIgG抗体保有率(血清型特異IgG抗体濃度≧0.35μg/mLの被験 者割合)を接種群(第1~5群)ごとに評価する。 ・第5群(バクニュバンス®を4回接種)の4回接種後30日目のPCV13と共通の13血清型における血清型特異的IgG GMCを、第1群(PCV13を4回接種)と比較して評価する。 その他の項目:4回接種後30日目のバクニュバンス®固有の血清型における血清型特異的IgG GMC |
| 評価項目 安全性 | 主要評価項目:・バクニュバンス®およびPCV13接種後1~14日目までの事前に規定した注射部位の有害事象(発赤/紅斑、腫 脹、圧痛/疼痛および硬結) ・バクニュバンス®およびPCV13接種後1~14日目までの事前に規定した全身性の有害事象(易刺激性、傾眠/傾眠状態、食欲減退および蕁麻疹/膨疹) ・試験期間中の重篤な副反応 |
* GMC:幾何平均抗体濃度
バクニュバンス®:沈降15価肺炎球菌結合型ワクチン(無毒性変異ジフテリア毒素結合体)
PCV13:沈降13価肺炎球菌結合型ワクチン(無毒性変異ジフテリア毒素結合体)
IPD:侵襲性肺炎球菌感染症
| 解析計画 免疫原性 | 免疫原性の解析には治験実施計画書を逸脱していない全ての被験者(PP集団*)を用いた。 主要評価項目:正式な仮説検定を行わず記述的に評価した。4回目接種後30日目の共通の13血清型に対する血清型特異的IgG GMCは、各血清型の血清型特異的IgG GMC比を推定することにより接種群間で比較した。血清型特異的IgG GMC比の推定値および対応する95%信頼区間(CI)は、接種群および層別因子(組入れ時のB型肝炎ワクチン接 種歴の有無)を要因とした共分散分析モデル(ANCOVA)を用いて算出した。第2群と第1群、第3群と第1群および 第4群と第1群の対比較を行った。 副次評価項目:血清型特異的IgG GMCのCIは、t分布に基づき自然対数値の平均のCIを累乗して算出した。IgG抗体保有率のCI は、Clopper-Pearsonの正確信頼区間を用いた。 |
| 解析計画 安全性 | 安全性解析対象集団は、ワクチンを接種した全ての被験者(APaT集団**)を用いた。安全性および忍容性は、安全性評価項目を用いて臨床的な観点から検討した。 |
* PP(Per-protocol)集団:治験実施計画書を逸脱していない全ての被験者
** APaT(All Participants as Treated)集団:ワクチンを接種した全ての被験者
互換性に関する多施設共同、無作為化、実薬対照、並行群間、二重盲検試験

※1 ロタウイルスワクチン(5価)、B型肝炎ワクチン[組換え型](国内未承認)、5種混合ワクチンDTaP-IPV-Hib(国内未承認)は、1回目~3回目接種時に接種された。インフルエンザ菌b型ワクチン(破傷風トキソイド結合体)(国内未承認)、麻疹・ムンプス・風疹(MMR)混合ワクチン(国内未承認)、水痘生ワクチン(国内未承認)は4回目接種時に接種された。
※2 安全性については、接種後1~14日目の電子ワクチン接種報告カードによる報告を実施した。
主要評価項目である第2~第4群(PCV13/バクニュバンス®混合4回接種)の4回目接種後30日目のPCV13と共通の13血清型における血清型特異的IgG GMCを、PCV13 4回接種(第1群)と比較して評価した結果をご紹介します。
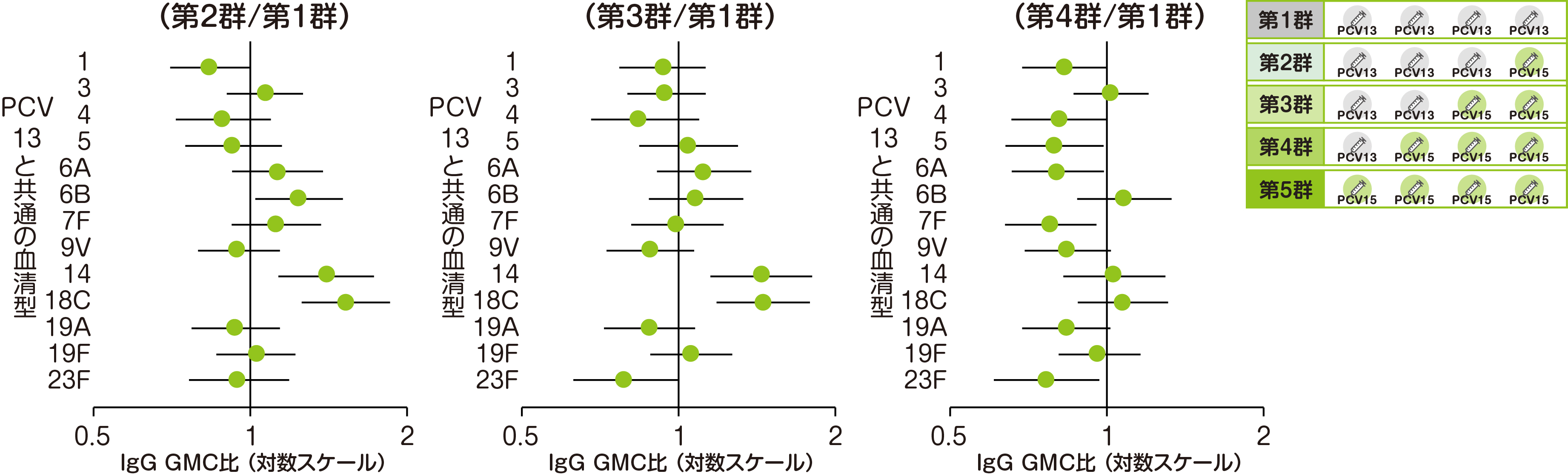
• 第1群:n=146~148、第2群:n=150~151、第3群:n=127~128、第4群:n=138~139
• それぞれの血清型において解析可能な例数は異なる。治験実施計画書を逸脱していない全ての被験者(PP集団)を用い、本評価において、解析可能な例数を用いて集計を行った。
• 血清型特異的IgG GMC比(95%CI)
• 接種群および層別因子(組入れ時のB型肝炎ワクチン接種歴の有無)を要因とした共分散分析モデルを用いて算出した。
※ GMC:幾何平均抗体濃度
副次評価項目である3回接種後30日目の血清型特異的IgG抗体保有率(血清型特異的IgG抗体濃度≧0.35μg/mLの被験者割合)を接種群(第1~5群)ごとに評価した結果を、ご紹介します。
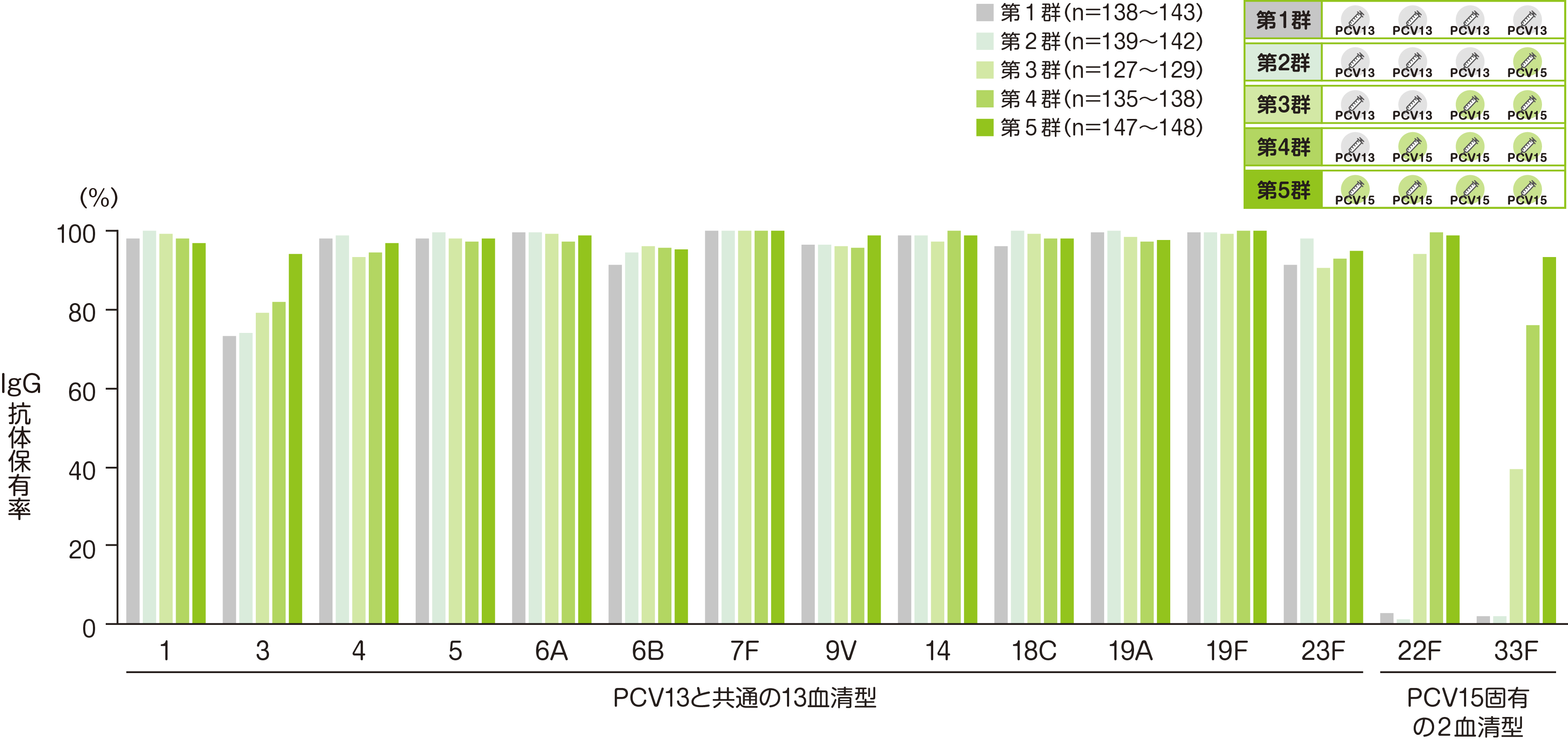
• それぞれの血清型において解析可能な例数は異なる。治験実施計画書を逸脱していない全ての被験者(PP集団)を用い、本評価において、解析可能な例数を用いて集計を行った。
※ 血清型特異的IgG抗体保有率:血清型特異的IgG抗体濃度≧0.35μg/mLの被験者割合
免疫原性における副次評価項目である3回接種後30日目におけるバクニュバンス®固有の2血清型の血清型特異的IgG GMCを評価した結果をご紹介します。
4回接種後30日目における血清型特異的IgG GMCは、右側の図の通りとなっています。
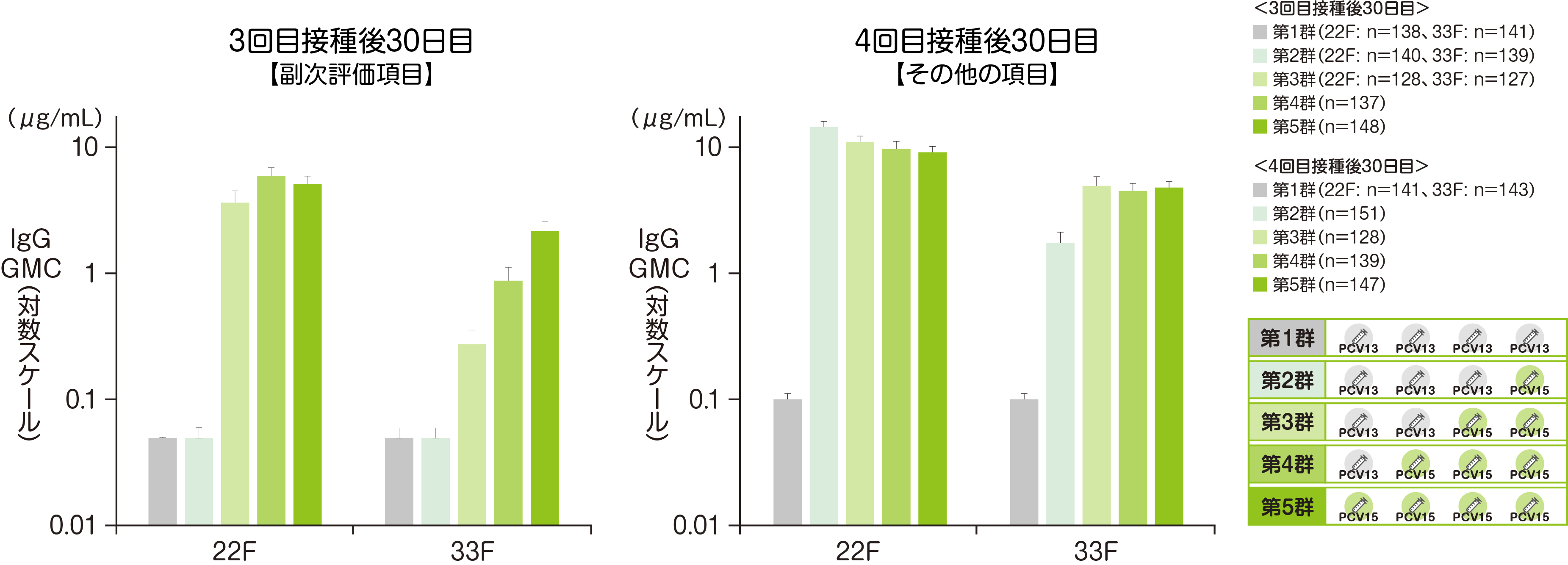
• それぞれの血清型において解析可能な例数は異なる。治験実施計画書を逸脱していない全ての被験者(PP集団)を用い、本評価において、解析可能な例数を用いて集計を行った。
• 血清型特異的IgG GMCのCIは、t分布に基づき自然対数値の平均のCIを累乗して算出した。
※ GMC:幾何平均抗体濃度
安全性に関する主要評価項目である「バクニュバンス®およびPCV13接種後14日までの事前に規定した注射部位の有害事象(発赤/紅斑、腫脹、圧痛/疼痛および硬結)、および全身性の有害事象(易刺激性、傾眠/傾眠状態、食欲減退および蕁麻疹/膨疹)、試験期間中の重篤な副反応」では、安全性解析対象例(第1群179例、第2群181例、第3群178例、第4群179例、第5群179例)中、接種後14日間の事前に規定した注射部位の有害事象(全ての時点の治験薬接種後)は第1群で128例、第2群で114例、第3群で123例、第4群で121例、第5群で127例に認められました。
また、接種後14日間の事前に規定した全身性の有害事象(全ての時点の治験薬接種後)は第1群で139例、第2群で136例、第3群で137例、第4群で147例、第5群で143例に認められました。
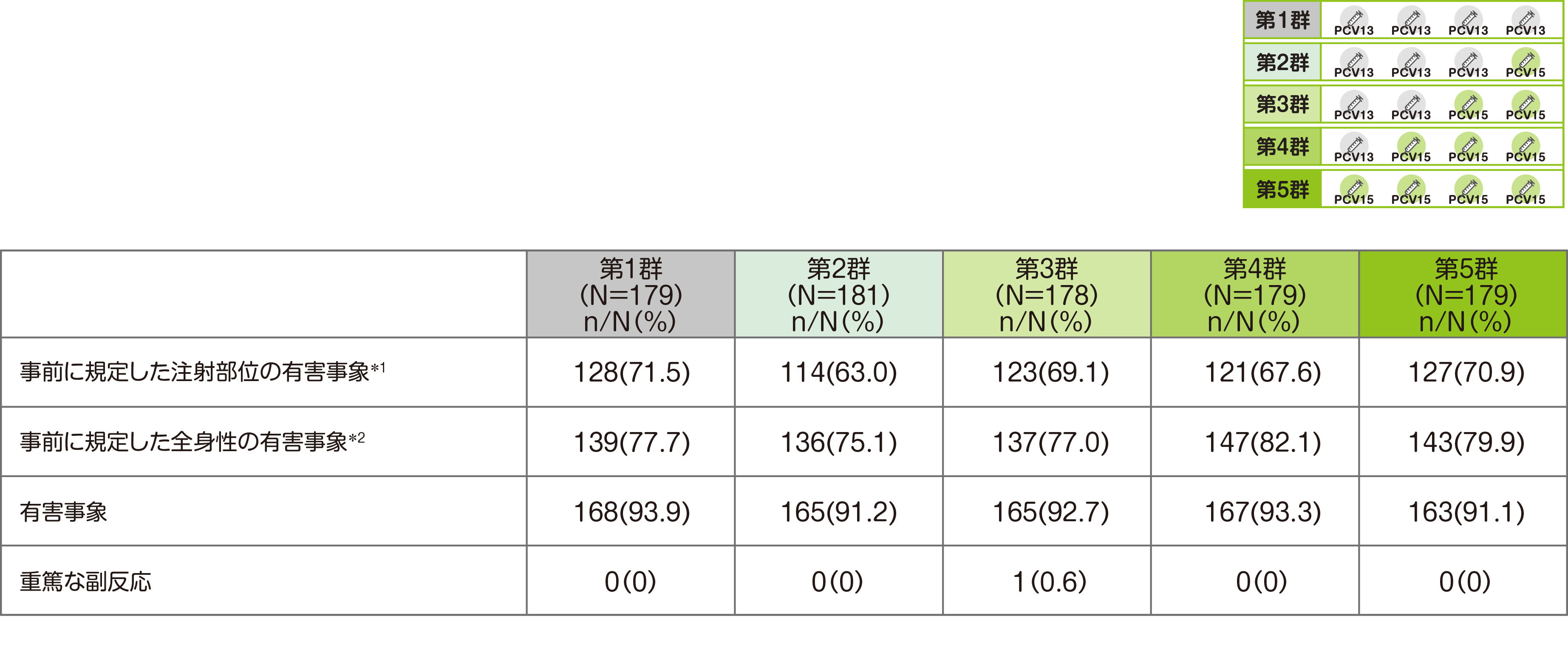
*1 発赤/紅斑、硬結、圧痛/疼痛、腫脹のいずれかが1件以上発現した数
*2 食欲減退、易刺激性、傾眠/傾眠状態、蕁麻疹/膨疹のいずれかが1件以上発現した数
MedDRA ver. 24.1
試験期間を通じての有害事象は、第1群で168例(93.9%)、第2群で165例(91.2%)、第3群で165例(92.7%)、第4群で167例(93.3%)、第5群で163例(91.1%)に認められました。
重篤な副反応は第3群の2回目接種後に1例(てんかん)認められ、当該患者は試験を中止し、死亡の報告はありませんでした。試験中止例は、第1群で15例(親または保護者の判断9例、医師の判断4例、追跡不能2例)、第2群で14例(親または保護者の判断8例、追跡不能6例)、第3群で33例(親または保護者の判断25例、医師の判断1例、追跡不能7例)、第4群で20例(親または保護者の判断17例、追跡不能3例)、第5群で13例(親または保護者の判断9例、医師の判断2例、追跡不能2例)でした。

本動画では、小児侵襲性肺炎球菌感染症予防の観点から、0歳児における初回免疫での免疫獲得の重要性について、詳しくご説明いたします。


バクニュバンス®は、新たに侵襲性の高い22Fと33Fの血清型を追加した、沈降15価肺炎球菌結合型ワクチンです。本動画では、小児肺炎球菌感染症に関する血清型におけ […]
WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?