腹腔内感染症
臨床成績
1)承認時評価資料:複雑性腹腔内感染症を対象とした国内第Ⅲ相臨床試験(013試験)
試験概要

| CE 集団: | 以下を満たす組み入れられたすべての患者 ・3日間以上治験薬を投与される/・治験薬の投薬率が80~120%/・治験実施計画書にて規定された複雑性腹腔内感染症の疾患定義に合致/・試験手順を遵守/・規定された来院範囲内に該当する来院時の臨床効果の結果を有する |
| EME 集団: | 治験薬への感受性にかかわらず、ベースライン時に1つ以上の腹腔内原因菌が特定されたことにより複雑性腹腔内感染症と判定され、すべてのCE集団の基準を満たす、組み入れられたすべての患者 |
| MITT 集団: | 治験薬への感受性にかかわらず、ベースライン時に1つ以上の腹腔内原因菌が特定されたことにより複雑性腹腔内感染症と判定され、組み入れられたすべての患者 |
1. 臨床効果
TOC時点のCE集団における臨床効果(有効率)は92.0%、疾患別有効率は90.2~93.5%であった。
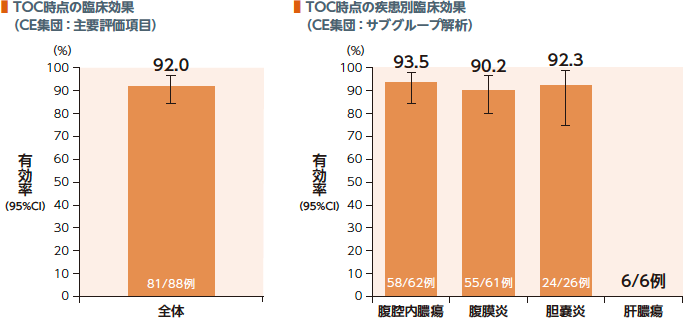
| 臨床効果: | 臨床効果判定において、「臨床的治癒(感染の徴候及び症状の完全な消失又は顕著な改善を認め、当該感染に対する抗菌薬療法の追加、外科的処置又はドレナージを必要としない)」と判定された場合を有効とした。 |
TOC時点の1回以上治験薬が投与された集団における臨床効果(有効率)は87.0%、疾患別有効率は86.6~90.0%であった。
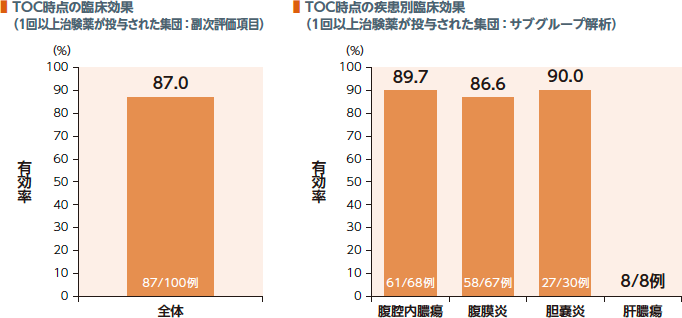
2. 細菌学的効果
TOC時点の細菌学的効果(有効率)はEME集団で90.2%(55/61例)、MITT集団で84.8%(56/66例)であった。なお、原因菌別有効率は以下の通りであった。
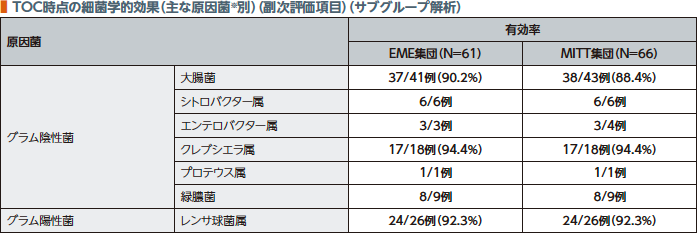
※ザバクサ®適応菌種のみ
例数(%)
| 細菌学的効果: | 細菌学的効果判定において、「消失(感染部位から適切に採取された検体において、ベースライン時の原因菌が検出されない)」及び「推定消失(臨床効果で「臨床的治癒」と判定され、かつ培養検査に用いる検体が存在しない)」と判定された場合を有効とした。 |
3. 安全性
副作用は100例中19例(19.0%)に認められた。主な副作用は、AST増加11例(11.0%)及びALT増加9例(9.0%)であった。重篤な副作用、投与中止に至った副作用は認められなかった。死亡(びまん性大細胞型B細胞性リンパ腫)が1例に認められたが、薬剤との因果関係はなしと判定された。
2)承認時評価資料:複雑性腹腔内感染症を対象とした海外第Ⅲ相臨床試験(CXA-cIAI-10-08/09試験)
試験概要

| CE 集団: | ITT集団のうち、治験薬が規定どおり投与され、治験実施計画書で規定する複雑性腹腔内感染症の診断基準を満たし、治験実施計画書の手順を遵守し、規定された来院時期の許容範囲内にTOC時点の評価結果を有するすべての患者 |
| ME 集団: | CE集団のうち、ベースライン時に治験薬に感性を示す腹腔内の原因菌が検出されたすべての患者 |
| ITT 集団: | 治験薬投与の有無にかかわらず、無作為割り付けされたすべての患者 |
1. 臨床効果
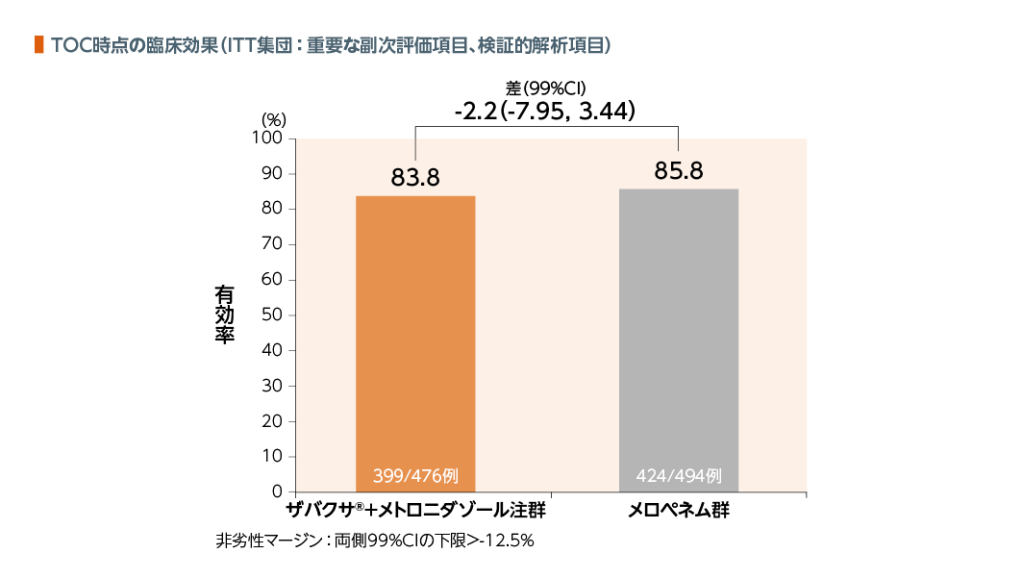
TOC時点のCE集団における臨床効果において、ザバクサ®+メトロニダゾール注群はメロペネム群に対して非劣性であることが検証された。
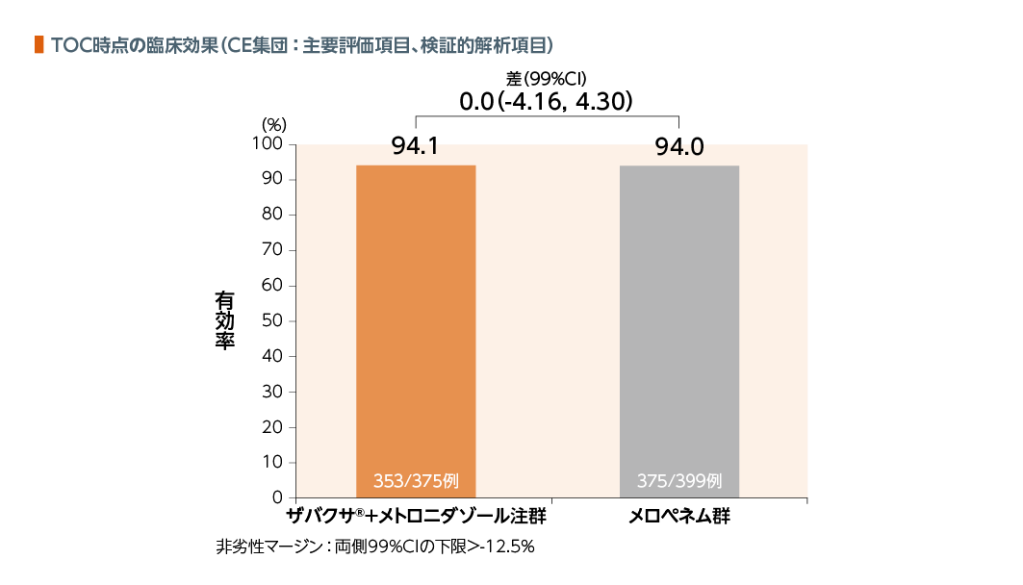
| 臨床効果: | 臨床効果判定において、「臨床的治癒(感染の徴候及び症状の完全な消失又は顕著な改善を認め、当該感染に対する抗菌薬療法の追加、外科的処置又はドレナージを必要としない)」と判定された場合を有効とした。 |
TOC時点のITT集団における臨床効果(有効率)において、ザバクサ®+メトロニダゾール注群はメロペネム群に対して非劣性であることが検証された。
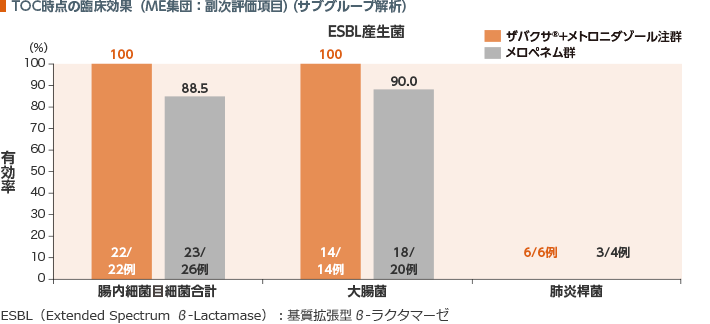
TOC時点のME集団におけるESBL産生腸内細菌目細菌に対する臨床効果(有効率)は、ザバクサ®+メトロニダゾール注群が100%、メロペネム群が88.5%であった。
2.細菌学的効果
TOC時点のME集団における原因菌別細菌学的効果(有効率)は、ザバクサ®+メトロニダゾール注群で85.7~100%であった。
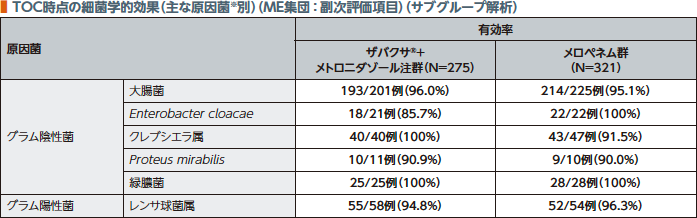
※ザバクサ®+メトロニダゾール注群で10例以上、ザバクサ®適応菌種のみ
例数(%)
| 細菌学的効果: | 細菌学的効果判定において、「消失(感染部位から適切に採取された検体において、ベースライン時の原因菌が検出されない)」及び「推定消失(臨床効果で「臨床的治癒」と判定され、かつ培養検査に用いる検体が存在しない)」と判定された場合を有効とした。 |
3.安全性
副作用はザバクサ®+メトロニダゾール注群で472例中38例(8.1%)、メロペネム群で485例中44例(9.1%)に認められた。主な副作用はザバクサ®+メトロニダゾール注群で下痢12例(2.5%)、悪心10例(2.1%)、頭痛4例(0.8%)、メロペネム群で下痢12例(2.5%)、静脈炎5例(1.0%)であった。重篤な副作用はクロストリジウム・ディフィシレ大腸炎がザバクサ®+メトロニダゾール注群及びメロペネム群でそれぞれ1例にみられた。投与中止に至った副作用は、ザバクサ®+メトロニダゾール注群で3例3件(腹痛、急性腎不全及び心不快感各1件)、メロペネム群で4例6件(悪心、口腔内不快感、味覚異常、クロストリジウム・ディフィシレ大腸炎、急性肺水腫及びアレルギー性皮膚炎各1件)であった。ザバクサ®+メトロニダゾール注群で11例、メロペネム群で8例に死亡が認められたが、薬剤との因果関係はなしと判定された。
メトロニダゾール点滴静注用の国内における効能又は効果(抜粋)
〇嫌気性菌感染症
<適応菌種>
本剤に感性のペプトストレプトコッカス属、バクテロイデス属、プレボテラ属、ポルフィロモナス属、フソバクテリウム属、クロストリジウム属、ユーバクテリウム属
<適応症>
・敗血症・深在性皮膚感染症・外傷、熱傷及び手術創等の二次感染・骨髄炎・肺炎、肺膿瘍、膿胸・骨盤内炎症性疾患・腹膜炎、腹腔内膿瘍・胆嚢炎、肝膿瘍・化膿性髄膜炎・脳膿瘍
【禁忌を含む注意事項等情報】等はこちらをご参照ください。



