肺炎・敗血症
臨床成績


1)承認時評価資料:院内肺炎を対象とした国際共同第Ⅲ相臨床試験(008試験)
試験概要

| ITT集団: | 治験薬の投与の有無にかかわらず、無作為化された全患者 |
| MITT集団: | ITT集団のうち、投与量にかかわらず治験薬を投与され、ベースライン時の下気道検体の培養で治験薬の1つ以上に感受性の下気道病原菌が1種類以上検出された患者 |
| 安全性解析 対象集団: | ITT集団のうち、投与量にかかわらず治験薬を投与された患者 |
| TOC (Test of Cure): | 治癒判定(投与終了後7~14日目) |
| VNP: | Ventilated nosocomial pneumonia |
| VABP: | Ventilator-associated bacterial pneumonia |
| HABP: | Hospital-acquired bacterial pneumonia |
1. 臨床効果
TOC時点のITT集団における臨床効果(有効率)において、ザバクサ®群はメロペネム群に対して非劣性であることが検証された。
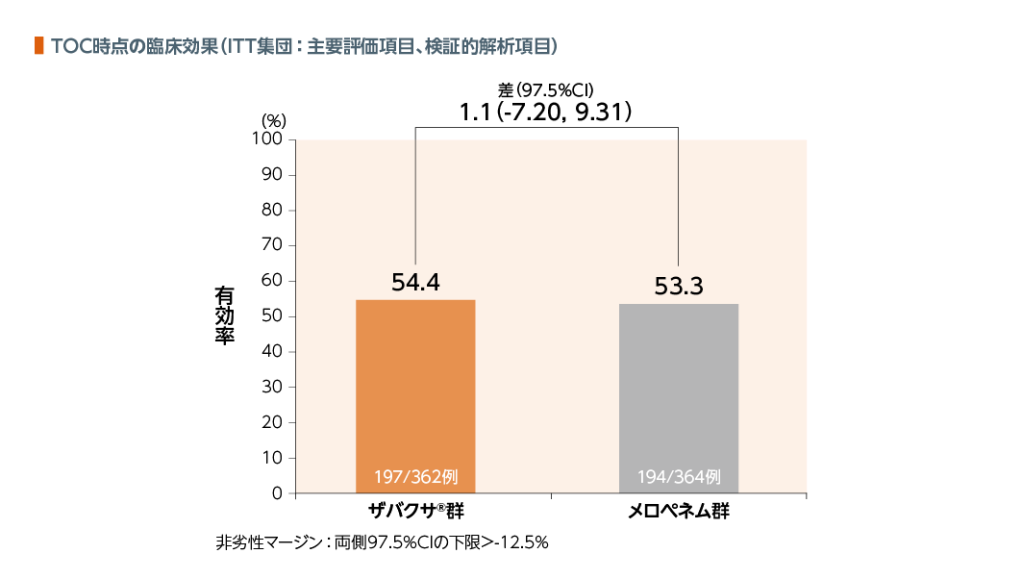
| 臨床 効果: | 臨床効果判定において、「治癒」と判定された場合を有効とした。 治癒の定義は「ベースライン時に認められていたVNPの臨床徴候及び症状のすべて又はほぼすべてが完全に消失した」かつ「VNPに起因する新たな徴候、症状、合併症が認められない」かつ「VNPに対する抗菌薬の追加投与がない(承認された補助療法は除く)」かつ「患者が生存している」とした。 |
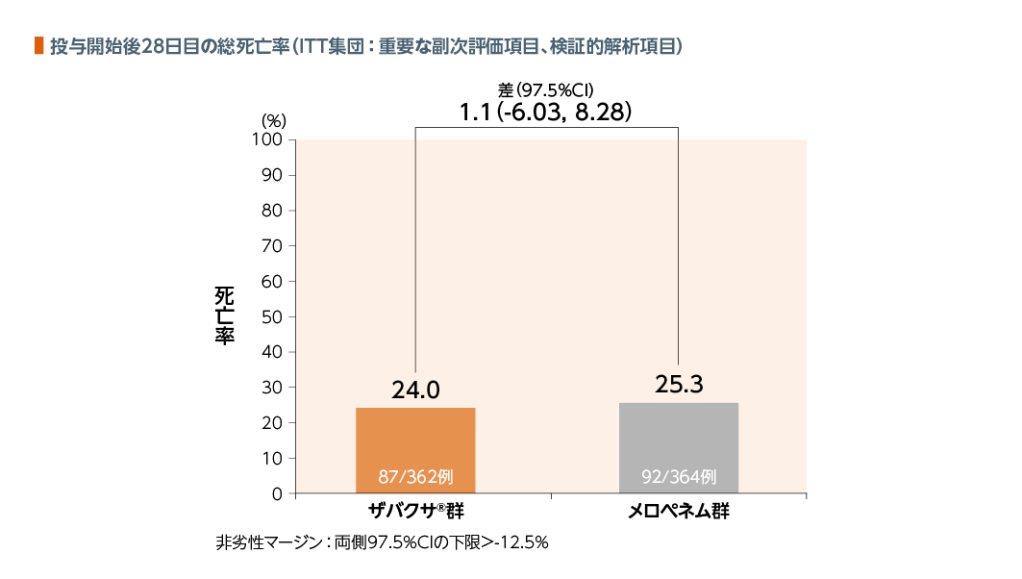
2. 総死亡率
ITT集団における投与開始後28日目の総死亡率において、ザバクサ®群はメロペネム群に対して非劣性であることが検証された。
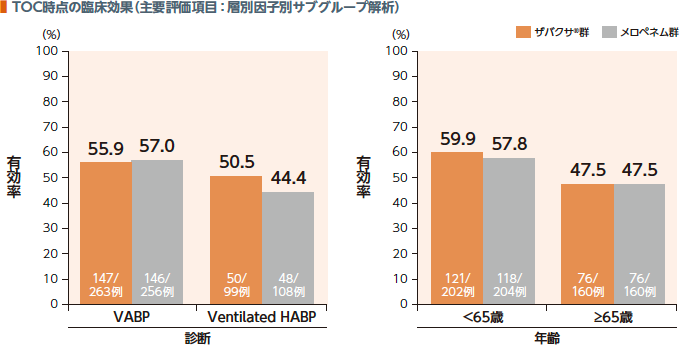
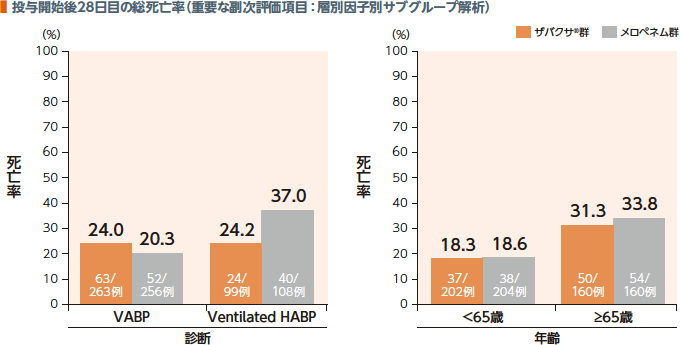
3. 臨床効果、総死亡率(層別因子別サブグループ解析)
TOC時点の臨床効果(有効率)及び投与開始後28日目の総死亡率において、診断別、年齢別のサブグループ解析の結果は以下のとおりであった。
【参考】本試験における「人工呼吸器を装着している院内肺炎(VNP)患者」の定義
VABP(人工呼吸器関連肺炎)
・人工呼吸器の装着時間が48時間以上であり、以下について1つ以上認められること。
-酸素投与の追加が必要な人工呼吸器システムの急激な変化(動脈血ガス酸素分圧の悪化又はPaO2/FiO2比の悪化で判定)。
-低酸素血症[室内空気呼吸時の動脈血ガス酸素分圧が60mmHg未満(又は同等のFiO2)、室内空気呼吸時のパルスオキシメトリでの酸素飽和度が90%未満(又は同等のFiO2)、又はPaO2/FiO2の比が悪化と定義]。
Ventilated HABP(人工呼吸器を装着しているHABP患者)
・48時間以上入院している患者又は退院してから7日以内の患者(高度看護施設又はその他の長期療養施設に入院中の患者を含む)で、挿管前24時間以内又は挿管後48時間以内に以下の徴候及び/又は症状のうち1つ以上が認められること。
-咳嗽の新たな発現(又はベースライン時の咳嗽の悪化)。
-呼吸困難、頻呼吸、呼吸数が1分間に30回を超える、特にこれらの徴候又は症状のいずれか又はすべてが進行している場合。
-低酸素血症[室内空気呼吸時の動脈血ガス酸素分圧が60mmHg未満、室内空気呼吸時のパルスオキシメトリでの酸素飽和度が90%未満、又は酸素分圧と吸入酸素濃度(PaO2/FiO2)の比が悪化と定義]。
4. 細菌学的効果
TOC時点のMITT集団における細菌学的効果(有効率)は以下のとおりであった。
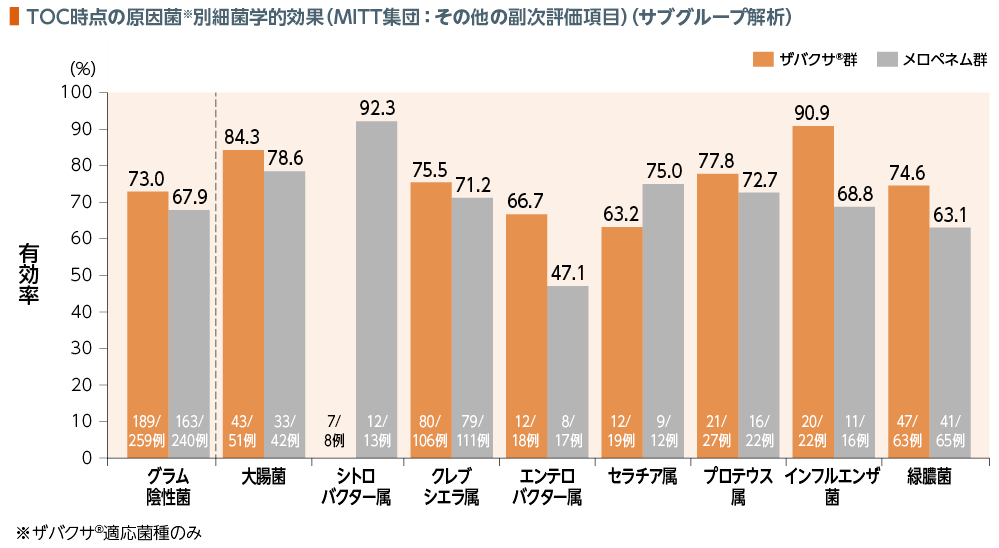
| 細菌学的 効果: | 細菌学的効果判定において、「治癒又は推定治癒(ベースライン時に検出された菌がすべて消失/消失が推定される、又は臨床的治癒とされた患者においてTOC時点の培養する下気道検体がない)」と判定された場合を有効とした。 消失の定義は「菌が検出されない。ベースライン時に検出された菌の対数減少量が1log以上、かつ、フォローアップ下気道検体の培養で菌ごとの数が、ETA又は喀痰検体で104CFU/mL以下、BAL検体で103CFU/mL以下、PBS検体で102CFU/mL以下」とした。推定消失の定義は「臨床効果が治癒とされた患者で培養する下気道検体がない(例えば人工呼吸器を抜管した患者で下気道検体を培養することができない)」とした。 |
5. 安全性
副作用はザバクサ®群で361例中38例(10.5%)、メロペネム群で359例中27例(7.5%)に認められた。主な副作用はザバクサ®群で下痢、クロストリジウム・ディフィシレ大腸炎、肝酵素上昇、肝機能検査異常各4例(1.1%)、メロペネム群で下痢6例(1.7%)、ALT増加4例(1.1%)であった。重篤な副作用はザバクサ®群で8例(クロストリジウム・ディフィシレ大腸炎2例、徐脈、イレウス、胆汁うっ滞性肝炎、エンテロバクター性菌血症、敗血症性脳症各1例、ALT増加、AST増加及びγ-GTP増加1例)、メロペネム群で2例(胆汁うっ滞性肝炎、クロストリジウム・ディフィシレ感染各1例)にみられた。投与中止に至った副作用は、ザバクサ®群で4例6件(胆汁うっ滞性肝炎、肝酵素上昇、AST増加、ALT増加、γ-GTP増加、肝不全各1件)、メロペネム群で5例6件(肝酵素上昇2件、胆汁うっ滞性肝炎、発疹、好酸球増加症、汎血球減少症各1件)であった。ザバクサ®群で105例、メロペネム群で101例に死亡が認められたが、薬剤との因果関係はなしと判定された。

1)承認時評価資料:院内肺炎を対象とした国際共同第Ⅲ相臨床試験(008試験)
試験概要

| 敗血症評価対象集団: | 1回以上治験薬を投与され、本解析における敗血症の診断基準をすべて満たすVNP患者 |
敗血症に対する臨床効果及び細菌学的効果
国際共同第Ⅲ相臨床試験での敗血症の診断基準を満たす院内肺炎患者のサブグループ解析におけるTOC時点の臨床効果(有効率)はザバクサ®群で24.6%、メロペネム群で17.9%であった。
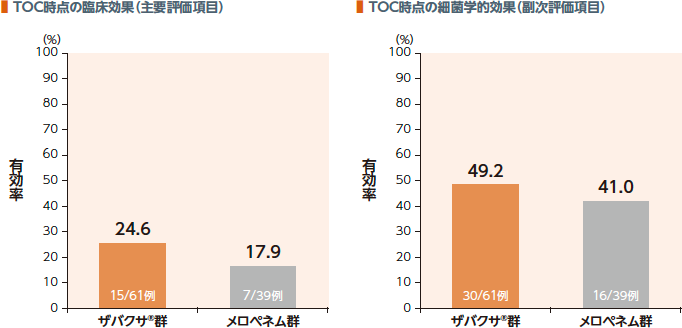
| 臨床 効果: | 臨床効果判定において、「治癒(敗血症関連の臨床症状が、TOC時点ですべて消失した。すなわち、敗血症の診断基準の項目のデータがすべてあり、いずれの項目も診断基準に該当しない。)」と判定された場合を有効とした。 |
| 細菌学的効果: | 細菌学的効果判定において、「消失(治験薬投与開始以降、TOC時点までの最終の血液培養検査が陰性であった。)又は推定消失(治験薬投与開始以降、血液培養検査が実施されず、かつTOC時点の敗血症の臨床効果が治癒であった。)」と判定された場合を有効とした。 |
【禁忌を含む注意事項等情報】等はこちらをご参照ください。